中国抗癌协会
立即下载App期刊 | 微小RNA抗肿瘤治疗研究——不忘初心、砥砺前行
过去的十多年里,对微小RNA(miRNA)的过热追捧以及随之出现的大量良莠不齐的论文让这个曾经的明星分子逐渐受到争议和质疑。就肿瘤研究而言,在某一种特定肿瘤的发生过程中往往有数百种miRNA的表达发生变化,哪些才是真正关键的miRNA,哪些属于伴随性效应,需要根据这些研究中采用的方法是否严谨、数据是否详实等要素进行综合判断。来自哈佛大学医学院附属布列根和妇女医院的Khalid Shah教授就miRNA在肿瘤治疗中的作用及新一代应用策略进行了系统综述。作者通过对大量相关文献进行仔细查证,重新总结了miRNA在肿瘤中常见的异常表达情况、miRNA调控肿瘤生物学特征的分子机制、以及对肿瘤微环境的重塑作用,并重点归纳了最新的miRNA抗肿瘤靶向递送策略及其在肿瘤治疗中的具体应用。
我们邀请南京大学医学院附属苏北人民医院王磊教授与王霄霖教授共同对该文章进行了解读。


文章学术观点
No.1 miRNA在肿瘤发生发展中的作用
miRNA作为一类主要从转录后水平对基因表达进行调控的内源性分子,其往往在特定的生理病理条件下通过序列依赖的方式结合特定信使RNA来发挥作用。需要注意的是,miRNA的表达与大多数编码蛋白基因一样具有高度时空特异性,正因为此,对miRNA功能的研究不能一味求全,而应以剖析不同miRNA在不同生物学过程中的具体作用为目标。癌细胞与肿瘤微环境的交互作用对于形成适宜肿瘤生长的生态位、促进肿瘤发生免疫逃逸并最终远端转移都有重要影响。在此过程中,有多个重要的miRNA分子(miR-7、miR-9、miR-15、miR-16、miR-21、miR-29、miR-155等)通过介导癌细胞与肿瘤微环境中特定细胞(肿瘤相关成纤维细胞、血管内皮细胞、树突状细胞、巨噬细胞、NK细胞、髓源性抑制细胞等)之间的交互作用而对肿瘤微环境起到改造和重塑作用(图1)。
从肿瘤治疗学角度,如果能够实现在肿瘤组织中高效特异地调节特定miRNA 或miRNA组合的分子表达,将会对抗肿瘤治疗产生积极作用。目前,调节miRNA表达的技术已较为成熟,主要策略有人工合成miRNA拟似物、 miRNA表达载体、反义寡核苷酸AMOs、miRNA海绵、小分子miRNA抑制剂SMIRs等。然而,miRNA在肿瘤治疗中的临床应用还相对滞后,一个重要制约因素就是miRNA抗肿瘤靶向递送策略还不够成熟,因此亟需开发新型的miRNA递送系统与治疗方案。
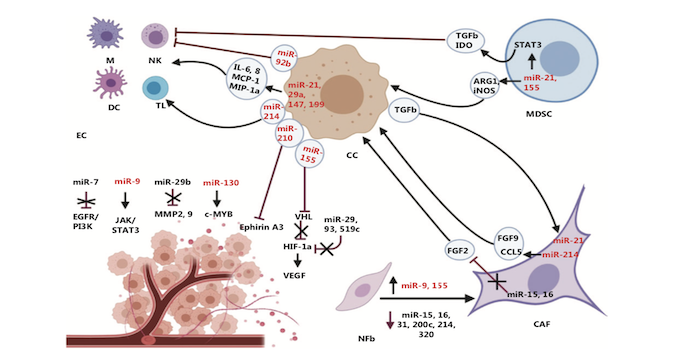
图1:miRNA对肿瘤免疫微环境的重塑作用
No.2 新型miRNA递送系统与治疗方案
miRNA给药方式主要可分为全身给药和局部给药两种,其中全身给药在靶向肿瘤转移灶和肿瘤血管方面具有优势,而局部给药能减少内源性RNA酶对小RNA的降解、用药剂量和毒副作用都相对更小。但是,对于细胞外游离的miRNA分子而言,其本身携带负电荷产生的亲水特性让其难以独自穿透细胞膜进入细胞。因此,miRNA药物需要在载体协助下进入细胞并释放。同时,为了最大限度地发挥miRNA的肿瘤杀伤潜力,载体系统还必须保护小RNA不被降解、延长它们在血流中的循环时间、并增加肿瘤细胞对其特异性的摄取。
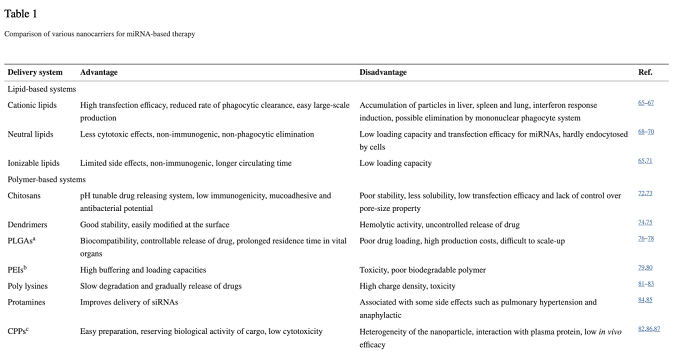
根据这些特点与要求,近年来发展出多种miRNA递送系统,主要包括:纳米颗粒递送载体、外泌体递送载体、重组病毒载体、病毒样颗粒载体、以及基于间充干细胞(MSC)的递送系统等(图2)。目前,在纳米颗粒介导miRNA递送方面的研究进展最为迅速,具体可细分为脂质纳米载体、纳米聚合物、无机纳米颗粒、核酸纳米颗粒四个亚类,这四类纳米载体各有所长,在具体应用时需要根据其不同特性做出选择。此外,纳米颗粒的一大优势是可进一步与抗体分子偶联,从而增强对肿瘤细胞的特异识别和杀伤作用。
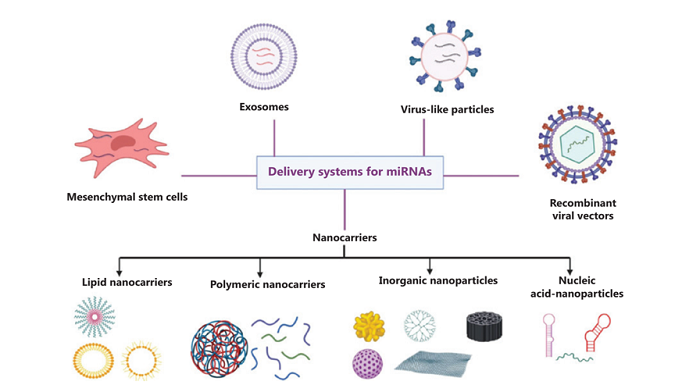
图2:主要的miRNA递送系统
专家解读
“千淘万漉虽辛苦”-
无冕之王miRNA面临的质疑与挑战
miRNA作为一类在进化上高度保守的内源性基因,于二十世纪九十年代初被发现与线虫的发育调控密切相关。进入二十一世纪后,miRNA又被证实拥有与“RNA干扰”(2006年诺贝尔生理医学奖)高度相似的作用机制而引起学术界的广泛关注和浓厚兴趣,同时也涌现出大量与之相关的重要研究论文与课题。
然而,受miRNA临床应用相对滞后以及近年来一些“论文工厂”把目标对准miRNA领域等不利因素的影响,不少学者开始不同程度地质疑miRNA功能是否被夸大。从技术角度进行分析,对miRNA相对表达水平变化的片面关注(忽视miRNA绝对丰度对其功能效应的影响)以及方法上过度依赖miRNA过表达策略(使miRNA在细胞中的丰度远超出正常生理水平)等原因,往往会导致研究结论出现偏差,进而给基础研究成果的临床转化带来负面效应。
从短期影响来看,之前处于过热状态的miRNA研究目前已经迅速冷却了下来;但从长远来看,符合科学精神的质疑将对miRNA研究的去伪存真产生积极有益的影响。站在基因进化与选择压力的角度,人类基因组中上千种不同的miRNA基因能够在物种演化的历史长河中得以保留且序列上高度保守,本身就提示miRNA一定具有特定的生物学功能。因此,如何客观公正地看待miRNA这个“无冕之王”、如何从海量文献中抽丝剥茧获取真正有价值的信息,对于指导今后开展高质量的miRNA研究并正确评价miRNA临床应用潜力都具有极为重要的意义。
哈佛大学医学院Khalid Shah教授最近在Cancer Biology & Medicine 杂志上发表的这篇综述提出了自己对于miRNA的独特见解,将目光聚集于miRNA的临床转化,显示出一个优秀科研工作者对于解决实际临床问题的勇气与决心。
“吹尽狂沙始见金”-
曲折中前进的miRNA抗肿瘤治疗之路
肿瘤的发生发展是个极为复杂的过程,常常涉及到基因组不稳定性、表观遗传修饰改变、肿瘤免疫逃逸、肿瘤微环境重塑等一系列变化,转录组研究发现肿瘤组织中常常会有上千种基因的表达水平发生变化并且不同肿瘤不同患者中存在高度异质性,这大大增加了肿瘤研究的难度。值得庆幸的是,研究人员已经证实肿瘤发生过程中存在着一些发挥核心作用的“驱动基因”,如果能够对这些关键基因进行有效调控,将对肿瘤治疗产生极为有利的影响。
目前,已经上市的抗肿瘤靶向药主要包括小分子药物和单克隆抗体两大类,其靶点通常是某种单一的关键基因,优点在于成药性良好、对特定分子亚型的肿瘤患者疗效显著,但同时也存在适用面较窄且易发生耐药的限制。而miRNA功能的发挥通常依赖于其“种子序列”,因此理论上一个miRNA能够对多个甚至上百个基因的表达进行调节,这是miRNA用于抗肿瘤治疗的潜在优势之一。不过需要特别强调的是,miRNA对下游靶基因的抑制作用远非生物信息学预测那么简单,其能否真正发挥生物学效应还取决于miRNA的丰度水平、miRNA与靶mRNA在亚细胞水平的共定位关系、靶mRNA空间构象及RNA结合蛋白是否对miRNA功能发挥造成阻碍等因素。
miRNA用于抗肿瘤治疗的另一个潜在优势是miRNA的调控作用不局限于单个物种体内,最新研究表明miRNA能够实现跨物种的通讯甚至功能调控。植物中的miRNA(如miR168a、miR156a等)可以通过日常饮食进入人体循环并且稳定存在,甚至调控肝脏脂代谢功能,造成胆固醇水平异常。人体内分泌的miRNA也可以进入肠道菌群中,选择性的构建肠道微生态,被“重塑”的肠道菌群也可反向影响人体的正常生理功能。这些借由miRNA实现的跨物种调控给miRNA的肿瘤精准治疗带来了新的启示:miRNA的跨物种调控中跨越了整个消化系统的miRNA如何保持高稳定性、高丰度及实现靶向调控?多吃富含抗肿瘤特性miRNA的食物能否预防及治疗癌症?相信在不久的将来,这些问题将逐一解决,miRNA制剂将真正进入临床使用,造福肿瘤患者。
“笋因落箨方成竹,鱼为奔波始化龙”-
miRNA临床转化研究的机遇与挑战
miRNA的一个重要特点是在人体外周血及靶器官中广泛存在,其在肿瘤发生发展过程中特异性表达的特性已经被作为生物学标志物进入临床试验,在不久的将来可能投入临床使用。此外,miRNA本身属于内源性小分子,因此miRNA在纳米载体的应用领域具有得天独厚的优势,如目前研究众多的外泌体本身就是携带miRNA的天然载体,这为miRNA纳米递送载体的设计与改良提供了一个极佳的参考。
我们有理由相信,在不久的将来一定会有新型miRNA递送技术与治疗方案的突破,miRNA肿瘤治疗的临床应用将更加安全、有效、便捷。
南京大学医学院附属苏北人民医院王霄霖研究员
南京大学医学院附属苏北人民医院 王磊研究员
