中国抗癌协会
立即下载App期刊 | 细胞免疫治疗在血液系统疾病中的应用进展及展望
近几十年来,血液系统疾病的治疗模式发生了巨大的变化。传统的治疗模式下,比如化疗、局部放疗和姑息性的支持治疗,患者的预后较差,死亡率较高。然而,细胞免疫治疗的应用,使血液系统疾病治疗发生了革命性的变化。
在血液系统恶性肿瘤治疗领域,代表性的细胞免疫疗法主要包括嵌合抗原受体T细胞(CAR-T)治疗,基于自然杀伤(NK)细胞的免疫疗法和异基因造血干细胞移植(allo-HSCT)。北京大学人民医院黄晓军教授团队发表综述,讨论了细胞免疫治疗在血液系统疾病领域的最新进展和未来发展前景。
CBM邀请青年编委徐州医科大学附属医院朱锋教授进行解读。


文章学术观点
No.1 CAR-T细胞治疗--血液系统肿瘤最有前景的领域
CAR-T细胞疗法作为最有前途的细胞免疫治疗措施之一,在血液系统肿瘤中已表现出显著的抗肿瘤效果。鉴于CAR-T技术在B细胞恶性肿瘤中取得的初步疗效,其应用领域已扩展到其他血液系统疾病,如多发性骨髓瘤(MM),T细胞白血病/淋巴瘤和髓系恶性肿瘤等(见表1)。
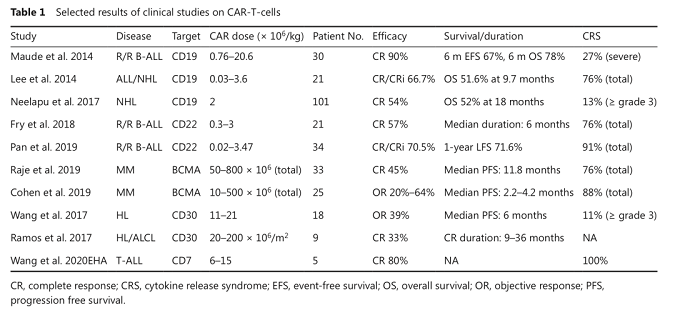
(1)CAR-T细胞治疗B细胞肿瘤
CD19靶向CAR-T疗法在复发/难治B-ALL、复发/难治B-NHL、CLL等临床试验中表现出快速而持久的抗肿瘤效应。因接受CD19靶向CAR-T细胞治疗的患者中,会由于抗原丢失等因素导致耐药复发,因此靶向CD22的CAR-T细胞的应用,可能对CD19靶向CAR-T治疗后复发的患者有效。CD79b是成熟B细胞发育的重要调控器,靶向CD79b的CAR-T细胞治疗在体内外试验中同样取得了令人欣喜的结果。
(2)CAR-T细胞治疗其他血液系统肿瘤
CAR-T细胞在治疗B细胞恶性肿瘤中取得成功后,迅速扩展到其他血液系统恶性肿瘤,包括MM,霍奇金淋巴瘤(HL),T细胞恶性肿瘤和急性髓性白血病(AML),各种疾病针对的靶抗原也有差异(表2)。
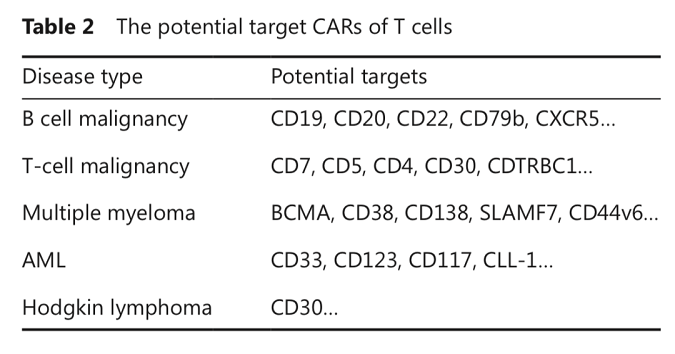
B细胞成熟抗原(BCMA)表达于几乎所有的MM细胞表面,因此靶向BCMA的CAR-T细胞治疗在MM中表现出令人满意的完全缓解率。此外,同时靶向BCMA和CD38/CD19的CAR-T细胞疗法也取得了令人欣喜的数据。
CD30是治疗复发/难治HL安全且有效的靶点。在多项I期临床研究中,靶向CD30的CAR-T细胞治疗已体现出显著的抗肿瘤活性和较低的毒性。
针对T细胞恶性肿瘤的CAR-T研究目前仍处于早期阶段,发展较缓慢。目前处于临床研究阶段的主要靶点是CD7,像CD5、CD4、CD30和CDTRBC1等靶点也正处于临床试验中。
因为缺少AML表面特异性强的靶点,CAR-T细胞治疗AML仍有很大的提升空间。现阶段针对AML的CAR-T细胞治疗靶点主要集中在CLL(CLEC12A)、CD33和CD123等,但临床疗效仍不确定。
(3)CAR-T细胞治疗面临的问题及思考
① 耐药复发问题:开发人源性CAR-T产品是解决抗原阳性复发的有效手段之一,使用人工抗原递呈细胞激活CAR-T细胞、调控CAR-T细胞表型以及联合免疫检查点抑制剂等方法,同样有助于降低抗原阳性复发的几率。双/多靶点CAR-T细胞方法有望克服靶抗原丢失或下调肿瘤细胞逃逸。
② 毒副作用:几乎所有接受CAR-T细胞治疗的患者都出现不同程度的毒副作用,主要包括细胞因子释放综合征(CRS)和神经毒副作用等。毒副作用是目前限制CAR-T疗效的重要因素,阻碍了通过增加CAR-T细胞剂量、增强CAR-T细胞的抗肿瘤作用。
No.2 NK细胞为基础的细胞免疫治疗
NK细胞无需抗原致敏,可迅速识别并杀伤肿瘤细胞,从而使其成为细胞免疫疗法的候选。随着对NK细胞的研究不断深入,基于NK细胞的免疫疗法治疗血液系统肿瘤已取得了长足的进步(表3)。本篇综述主要关注同种异体NK细胞和CAR-NK细胞治疗。
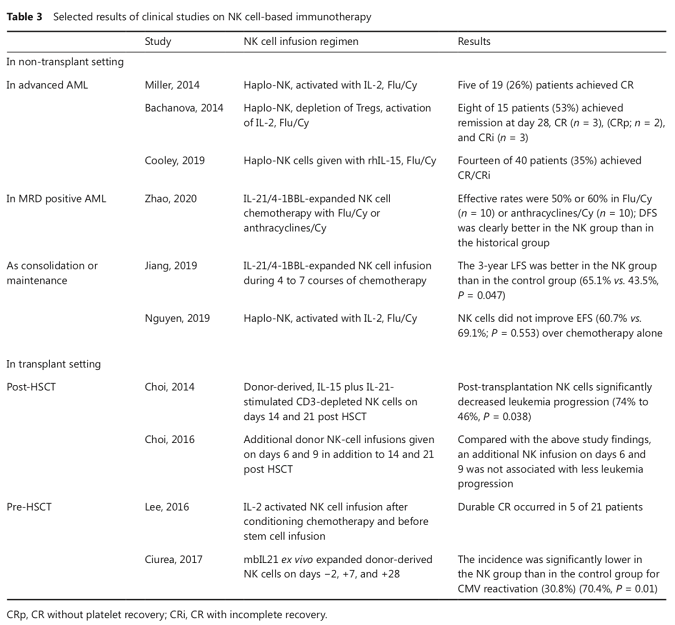
图1 CART治疗相关CRS中巨噬细胞的活化机制
(1)同种异体NK细胞治疗
IL-2和IL-15,作为NK细胞的激活型细胞因子,有助于诱导NK细胞数量上升,并在复发/难治AML等疾病中提高疗效。但低剂量的IL-2会激活Treg的功能,限制NK细胞的响应,从而影响临床应用。另一种方法是通过NK细胞系如NK-92,来扩增NK细胞水平。
NK细胞的突出优势是在保证移植物抗白血病(GVL)效应的同时,不会诱发移植物抗宿主病(GVHD)。多项研究已证实,移植后早期输注异体NK细胞,可促进植入,诱导GVL效应,不增加GVHD发生率。此外,AML患者在预处理后、干细胞输注前,应用异体NK细胞,也不会影响植入成功率和增加GVHD发生的风险。目前有大量针对同种异体NK细胞输注的时间、剂量等的研究。
(2)CAR-NK细胞治疗
与CAR-T细胞相比,CRA-NK细胞具有独特的优势。NK细胞寿命较T细胞短,分泌的细胞因子水平相对更低,因而可能会降低与自身免疫和CRS相关的不良反应发病率和严重程度。然而,他们在维持体内水平的持久性也影响了其潜在的疗效。目前CAR-NK细胞治疗血液系统肿瘤的研究较少,有限的临床研究主要集中在CD33-CAR-NK细胞和CD19-CAR-NK细胞,均证明了一定的疗效和安全性。
No.3 Allo-HSCT--最早出现但能达到根治效果的细胞免疫治疗方式
Allo-HSCT,目前仍然是治愈血液系统恶性肿瘤的主要手段,能使患者达到长期的无病生存。随着临床适应症的不断拓展和供者可选择性不断增加,每年行allo-HSCT患者的例数也不断增加。
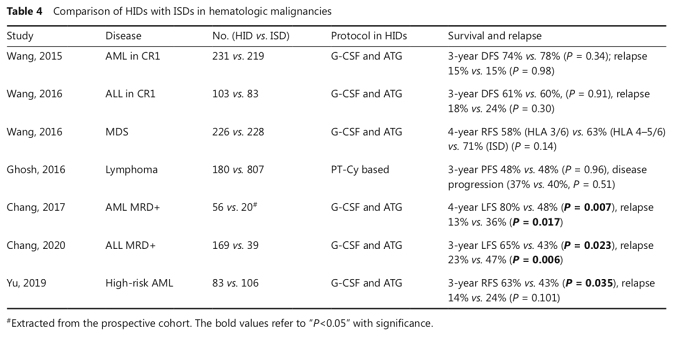
G-CSF联合抗胸腺细胞球蛋白的非去T单倍体移植方案(即北京方案),目前已作为allo-HSCT重要的模式,被国际认可并广泛推广。随着新的预处理方案出现,GVHD得到有效的预防,Haplo-HSCT的移植效果得到了明显改善(表4)。许多研究已证实,在不同的血液系统肿瘤中,Haplo-HSCT与全相合HSCT的疗效相当。此外,在临床研究及动物模型中均发现,与全相合HSCT比较,Haplo-HSCT保留有更强的GVL效应,从而降低HSCT后复发的风险。
No.4展望
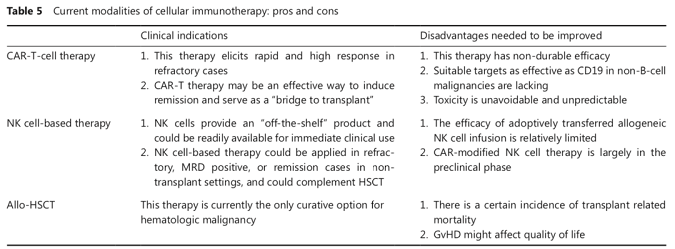
上述细胞免疫治疗策略在治疗血液系统肿瘤中均取得了不同程度的成功(表5)。但不同的免疫治疗手段各有优势,同样有不足之处待解决。将来有待临床进一步探索,以最大程度改善血液系统恶性肿瘤患者的预后。
专家解读
目前,恶性血液疾病是严重威胁人类健康的重大疾病。细胞免疫治疗已成为放疗和化疗以外血液系统肿瘤重要的有效治疗手段,它包括传统的allo-HSCT,还有近些年新出现的CAR-T细胞治疗和基于NK细胞的免疫治疗。
Allo-HSCT,目前依然是血液系统肿瘤可能达到根治效果的主要治疗措施。以“北京方案”为突出代表的单倍体移植模式可最大程度的解决allo-HSCT供者来源受限的不足,但在提高GVL效应的同时如何尽可能降低GVHD的严重程度以及移植相关死亡等方面,仍有进一步探索的潜在价值,尤其是针对复发/难治的恶性血液病患者,目前尚缺乏有效的治疗方法,预后较差,挽救性HSCT的5年生存率仅约为20%。
CAR-T细胞治疗的出现,为血液系统恶性肿瘤尤其是复发/难治患者迅速缓解,提供了一条崭新的治疗途径和希望。但该治疗方法在取得显著效果的同时,也伴随着严重并发症,如CRS、免疫效应细胞相关神经毒性综合征(ICANS)、脱靶效应等。此外,CAR-T细胞治疗后复发也是亟待解决的临床难题。
基于NK细胞的免疫疗法有望克服CAR-T细胞治疗的上述不足,且已在多种血液系统恶性肿瘤中进行尝试,但目前该治疗手段仍主要在临床前和初步临床研究阶段,仍面临体外原代NK细胞持久扩增和激活等挑战。
正如本篇综述中提到的,临床上还有很多问题有待进一步回答。在HSCT的背景下,哪种细胞免疫治疗作用最佳?哪种细胞免疫治疗更适合桥接HSCT,或者在HSCT复发后作为优先选择?哪种细胞免疫治疗方法更适用于不适合行HSCT的患者?因此,传统的allo-HSCT以及CAR-T细胞治疗和基于NK细胞的免疫治疗等细胞免疫治疗方法任重而道远,但我们有理由相信,随着分子生物学、免疫学等技术不断发展进步,细胞免疫治疗有望进一步改变现有的血液系统肿瘤的治疗模式。

朱锋,博士,副主任医师,副教授,硕士生导师,徐州医科大学附属医院血液科淋巴瘤诊疗中心副主任,美国Duke大学医学中心高级访问学者。
国家自然科学基金及省自然科学基金评审专家
中华医学会血液学分会实验诊断学组委员
中国抗癌协会血液肿瘤专业委员会T细胞淋巴瘤工作组委员
中国老年医学学会血液学分会委员
中国生物医学工程学会免疫治疗工程分会会员
江苏省研究型医院学会淋巴瘤专委会副主任委员
江苏省研究型医院学会细胞治疗(CAR-T)专业委员会委员
江苏省医学会血液学分会淋巴瘤-骨髓瘤学组委员
江苏省抗癌协会淋巴瘤专业委员会委员
江苏省肿瘤防治联盟淋巴瘤专委会委员
江苏省“333”工程培养对象
江苏省“六大人才高峰”人才
淮海经济区淋巴瘤联盟秘书
徐州市医学会血液病学专委会淋巴瘤学组副组长
徐州市抗癌协会血液肿瘤专委会秘书长
主要研究方向为淋巴瘤的基础和临床研究。以第一作者及通讯作者在Leukemia、Blood Advances、BBMT、Annals of hematology等发表论文数十篇,Cancer Biology & Medicine杂志青年编委,International Journal of Oncology、Cancer Control等杂志审稿专家,参编《基础血液学》、《实验血液学》等论著。