中国抗癌协会
立即下载App肿瘤标志物新进展(9)|梁文华教授解读影像AI鉴别磨玻璃肺癌的EGFR突变状态

关键词:
肺癌,磨玻璃,EGFR突变,影像组学,人工智能
文献题目:
Predicting EGFR mutation status in lung adenocarcinoma presenting as ground-glass opacity: utilizing radiomics model in clinical translation
全部作者:
Bo Cheng, Hongsheng Deng, Yi Zhao, Junfeng Xiong, Peng Liang, Caichen Li, Hengrui Liang, Jiang Shi, Jianfu Li, Shan Xiong, Ting Lai, Zhuxing Chen, Jianrong Wu, Tianyi Qian, Wenjing Huan, Man Tat Alexander Ng, Jianxing He*, Wenhua Liang*
发表期刊:
European Radiology 欧洲放射学学会会刊
出版时间:
2022年3月
影响因子:
5.3
文章概述:
该研究基于目前最大样本量,成功建立了预测患者肺磨玻璃(GGO)病灶EGFR突变状态的影像组学模型,并在国际上首次将EGFR突变的预测模型应用于患者队列,证实利用模型筛选可显著提升GGO患者接受EGFR-TKIs治疗的有效率,为超早期肺癌患者的基因诊断以及治疗决策的制定提供了重要工具。广州医科大学附属第一医院、广州呼吸健康研究院、国家呼吸医学中心何建行教授、梁文华教授为共同通讯作者,在读博士研究生程博、腾讯AI lab熊俊峰博士为主要第一作者。
文章背景:
1.对于肺腺癌,有超过60%的患者携有能够指导治疗决策的驱动突变。其中,表皮生长因子受体(EGFR)突变作为最常见的驱动突变之一,其靶向药(EGFR-TKIs)是目前治疗肺腺癌患者的重要手段,显著提高了EGFR突变阳性的晚期肺腺癌患者的远期生存。此前,何建行/梁文华教授团队曾在Signal Transduction and Targeted Therapy (IF= 18.187)发文证实EGFR-TKIs对早期磨玻璃样(GGO)肺癌同样具有治疗作用,提出了超早期肺癌以及多原发肺癌药物治疗的新模式。2而在开展治疗前确定病灶的EGFR突变状态,是治疗决策制定的关键环节。
2.基于肿瘤组织的基因检测是EGFR突变诊断的金标准,但处于磨玻璃状态的早期小结节病灶往往难以穿刺活检,也较难获取足够数量及质量合格的肿瘤组织;作为另一常用手段,基于循环肿瘤DNA(ctDNA)的液体活检同样存在一定短板,如早期肺癌中的ctDNA水平较低导致的检测结果假阴性,对于多发结节的患者检测结果无法定位到具体病灶等问题;近年来,随着人工智能(AI)技术的逐渐成熟,建立基于患者CT图像的突变预测AI模型,可以有效克服上述问题。
3.目前已有的EGFR突变预测模型,主要是针对较晚期影像特征明显的肺癌病灶。从印象出发,与具有典型CT特征的大病灶(肺癌的“成年时期”)不同,一般会认为GGO正处于“婴儿”时期,还不足以从“外观”(CT典型特征)鉴别出深藏在分子层面的基因突变。因此,建立一个针对患者GGO病灶,利用AI“看穿”CT图像的内在特征,进行无创诊断,能够突破当前基因诊断的“禁区”,具备重要的临床意义。
研究结果:
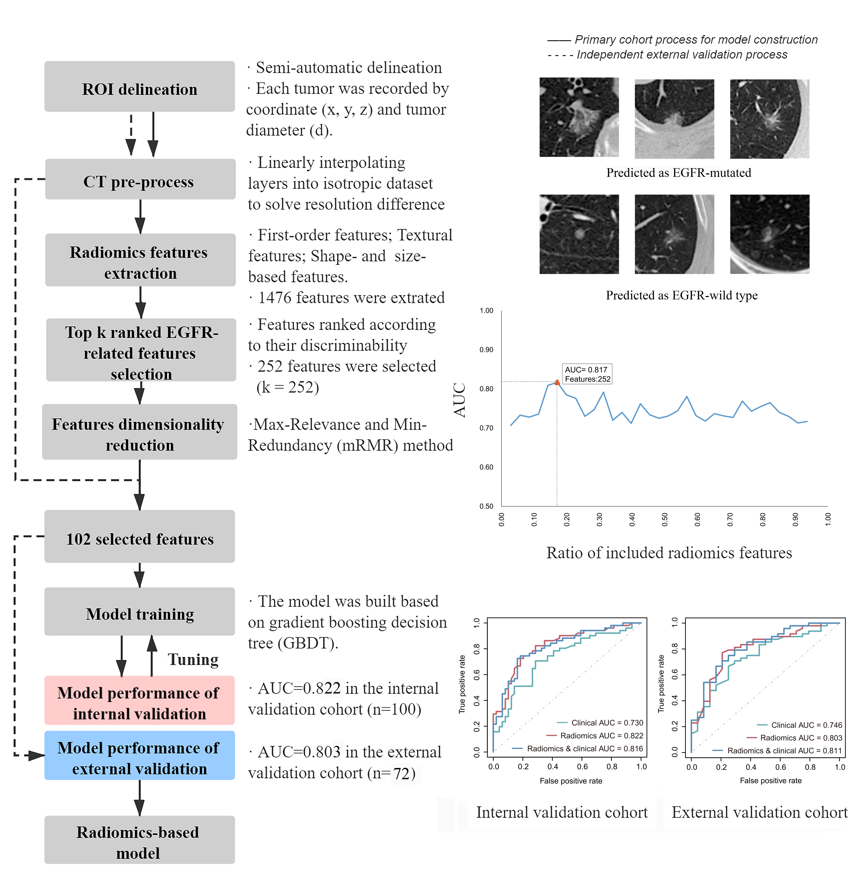
01.该研究共纳入了636例含有GGO结节(纯磨玻璃或磨玻璃为主)同时匹配基因测序信息的非小细胞肺癌患者,是目前建立相关模型的最大队列。其中,包含模型的训练队列464例,内部验证队列100例,以及外部验证队列72例,以检验预测模型的准确性及稳定性。
02.最终,研究者建立了一个纳入102个影像组学特征的预测模型(图1),并利用相同队列建立了基于患者临床特征(年龄,性别,吸烟史等)的逻辑回归模型,以及影像组学-临床特征联合模型,利用受试者工作特征(ROC)曲线进行分析比较。
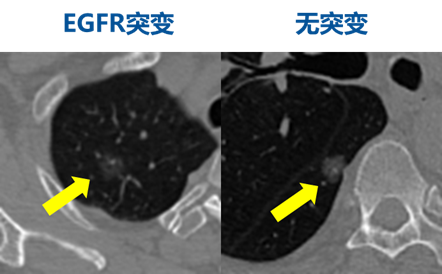
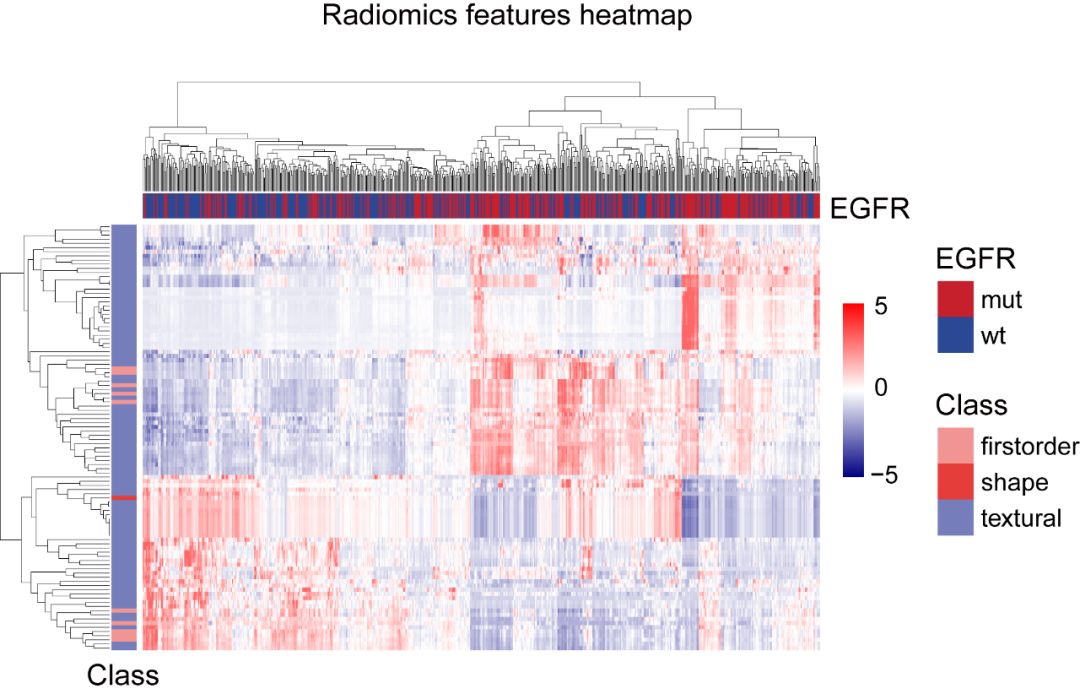
(图1)EGFR突变与野生型的影像组学特征
03.其中,影像组学模型在三个队列中的曲线下面积(AUC)分别为0.838,0.822以及0.803,显著优于临床特征模型(0.838 vs 0.674,0.822 vs 0.730,0.803 vs 0.746),且与联合模型相比未见差异(0.838 vs 0.846,0.822 vs 0.816,0.803 vs 0.811),说明所建立的影像组学模型准确率较高且性能稳定(图2)。此外,临床特征的纳入并不能提升影像组学模型的预测效能,因而使用独立的影像组学模型进行预测是足够优秀的。
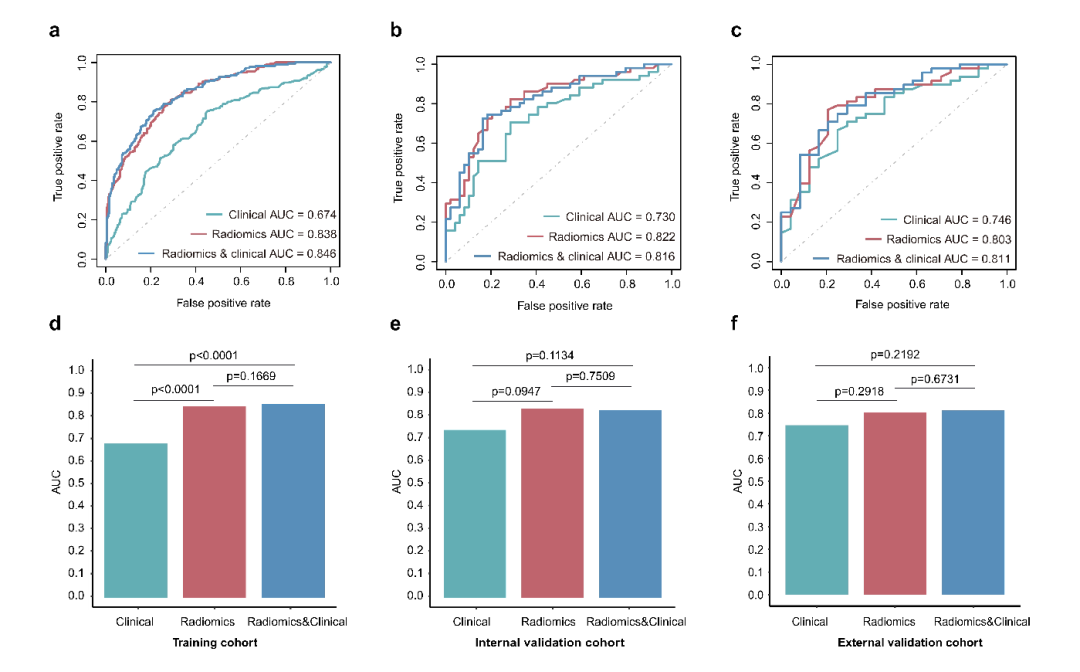
(图2)模型效能
04.此外,研究者开创性地将预测模型应用于临床队列,以验证该模型对于目标患者群体的筛选作用,为国际上首次。研究者收集了一个包含52名多原发肺癌患者的队列,这些患者在采取主病灶切除后接受了辅助EGFR-TKIs治疗,并且在用药期间肺内仍剩余有GGO病灶(共108个)。研究者对这些病灶进行了回顾性验证,病灶经模型预测前(基线)的有效率,以及经模型预测后表现为EGFR阳性病灶的有效率,证实所建立的影像组学模型可以有效筛选出EGFR-TKIs用药获益(EGFR+)的患者,用药有效率显著提高(预测前:25.9% [28/108] vs预测后:53.8% [14/26], P=0.006),说明了该模型应用于临床实践的良好可行性(图3)。
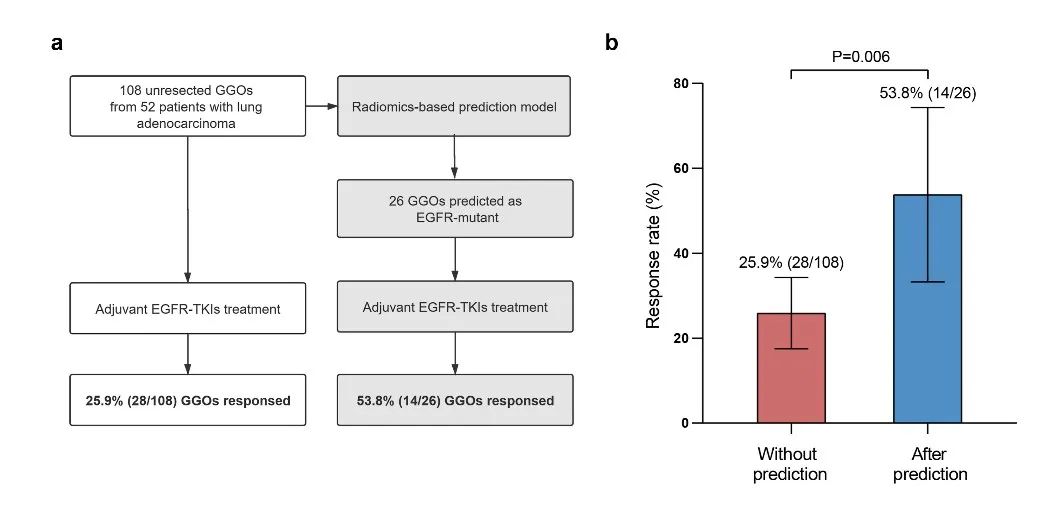
(图3)“盲用”与基于模型预测的EGFR突变病灶的用药效果对比
专家解读
随着各类抗肿瘤药物用药阶段的逐渐提前,EGFR-TKIs在早期磨玻璃样肺癌以及多原发肺癌患者中的应用业已在望。
此前,何建行/梁文华教授团队发文,在国际上首次证明了EGFR-TKIs对多原发肺癌患者早期磨玻璃样病灶具有治疗作用,而其有效率相比于晚期EGFR突变肺癌患者较低的原因,主要源于多原发肺癌患者不同病灶间的基因异质性(即不同病灶的驱动基因突变可能不同)。2,3因而,确认这些病灶的基因突变状态,是制定用药决策的关键环节。此次研究中所建立的预测肺腺癌患者GGO病灶EGFR突变状态的影像组学模型,作为一项方便、快捷、无创且准确的诊断工具,可以有效识别EGFR阳性即受益人群,提高患者的用药受益。
在2021年美国临床肿瘤学会(ASCO)年会上,何建行/梁文华教授团队也公布了其开展的全球首个PD-1抗体治疗早期磨玻璃样多原发肺癌的II期临床研究“CCTC-1901”的初步结果,显示PD-1抗体对于早期磨玻璃样肺癌具有一定的治疗效果,但其受益人群有待进一步精准化。4而该影像组学模型的建立,有助于筛选免疫治疗获益较少或无效(即EGFR阳性)的患者,从而有的放矢,实现精准用药。
近年来,何建行/梁文华教授团队致力于探索超早期肺癌以及多原发肺癌药物治疗的新模式,并取得显著成果。本次研究中所开发的针对肺GGO病灶的EGFR突变预测模型,可以快速准确的进行基因诊断,精准筛选用药受益的患者,对于超早期肺癌患者的临床治疗具备重要意义。

解读专家

