中国抗癌协会
立即下载App期刊 | CAR T细胞治疗相关细胞因子释放综合征——聚焦巨噬细胞
细胞因子释放综合征(CRS)已成为限制CAR T细胞疗法广泛应用于肿瘤治疗的主要挑战之一。CRS常见于感染(如新冠肺炎)、免疫治疗(如治疗性抗体、移植)以及一些自身免疫性疾病(如嗜血细胞综合征、巨噬细胞活化综合征)。迄今为止对CRS机制的研究表明,肿瘤微环境中的巨噬细胞可能是调节CRS发病机制的潜在关键细胞,它们参与了CRS核心细胞因子的产生和释放,包括白介素(IL)-1、IL-6和干扰素(IFN)-γ。阐明CRS的免疫机理,找到有效干预手段,已成为细胞治疗等前沿领域的重大科学问题。
吉林大学第一医院崔久嵬教授就巨噬细胞在CAR T细胞治疗相关的CRS中的作用机制进行综述,总结了CRS过程中巨噬细胞激活和相关细胞因子致病机制的研究进展,同时提出具有临床指导价值的治疗策略。


文章学术观点
No.1 CRS的核心细胞因子
CRS是免疫系统对致病物质的过度应答而释放的多种趋化因子的复杂级联反应。研究显示,CRS中众多关键细胞因子的过度产生都与巨噬细胞功能失调相关,包括IL-1, IL-6, IL-18和TNF-α。IL-1可诱导肝脏急性期蛋白合成,引起发热和恶病质等全身临床反应。TNF-α和IL-6及其下游效应分子可导致内皮细胞激活、血管通透性增加、血管张力丧失、补体系统激活、凝血级联反应及随后出现弥散性血管内凝血(DIC)和心肌功能障碍,并诱导中性粒细胞和成纤维细胞向肺上皮细胞迁移,导致胶原和纤维蛋白沉积增加和肺组织受损。TNF-α和IFN-γ协同作用可诱导包括凋亡、焦亡、坏死在内的细胞死亡。在CRS过程中,Th17细胞分泌单核-巨噬细胞集落刺激因子(GM-CSF),肿瘤细胞响应细胞因子如IL-1、IL-6、TNF-α或TGF-β刺激时NF-κB通路激活导致的单核趋化蛋白(MCP-1)高水平表达,均与巨噬细胞募集相关。
No.2 CRS中巨噬细胞激活的方式
巨噬细胞在CAR T细胞治疗相关CRS的发生发展中起着关键作用。CAR T细胞可能通过CD40L-CD40相互作用直接激活巨噬细胞,也可通过肿瘤细胞焦亡产物间接刺激巨噬细胞,导致失控的细胞因子释放。此外,巨噬细胞中还发现肾上腺素受体激活后儿茶酚胺分泌正反馈通路的存在,这可导致巨噬细胞持续激活(见图1)。
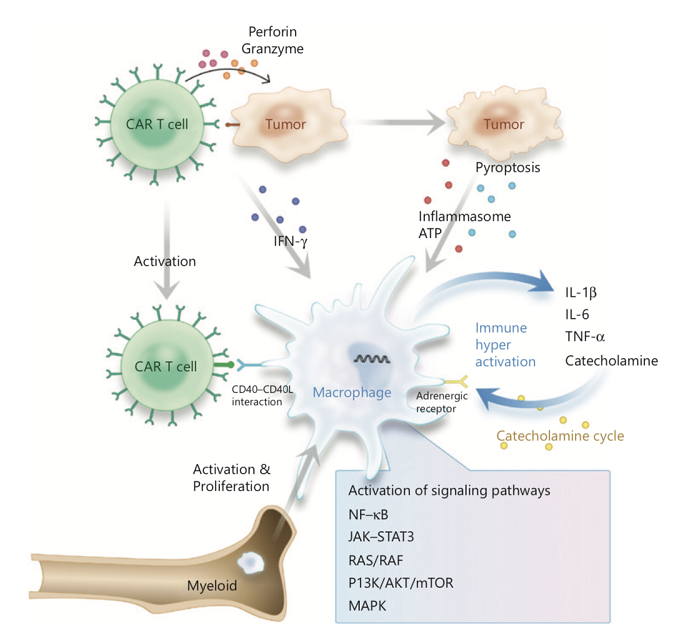
图1 CART治疗相关CRS中巨噬细胞的活化机制
No.3 CRS标志物
血清炎症和细胞因子可以作为生物标志物用于CRS的预测和诊断。许多细胞因子在CRS发生时增高,如IL-1、IL-18、IL-6、IL-10、IL-15、IFN-γ、MCP-1、Ang2/Ang1、GM-CSF、TNFRp55和MIP-1β。IL-6是一个较为公认的CRS严重程度评估和预后指标。急性期反应蛋白(CRP)和铁蛋白的增高也被认为与CAR T治疗中的CRS相关,但预测特异性较低。
No.4 CRS的预防与治疗
预防
基于肿瘤负荷调整剂量,或者改变CAR T结构均可有效防治严重CRS。在回输CART细胞后,建议每2 h 进行1次生命体征监测,每日复查IL-6、铁蛋白、CRP、血常规及血生化等指标。
一般处理原则
对于1级CRS,应该密切监护,评估感染,予以对症支持治疗;2~4 级 CRS 患者推荐给予IL-6受体的单克隆抗体托珠单抗和皮质类固醇。
药物研究进展
皮质类固醇可以有效抑制CRS,是治疗CRS的首选。托珠单抗能够迅速逆转CRS的症状,对免疫系统没有明显不利影响,已被FDA批准用于CRS治疗,但托珠单抗不能穿过血脑屏障,建议联合皮质类固醇用于控制神经毒性。其他靶向CRS相关细胞因子的治疗正在探索之中,如IL-1R拮抗剂Anakinra、抗GM-CSF单克隆抗体Lenzilumab等。
专家解读
免疫细胞在抵抗外来入侵或清除异常细胞(如肿瘤)时会释放大量促炎因子。当免疫系统过度激活时,这些过多的细胞因子不再受控于免疫系统,攻击机体的正常细胞,引发全身炎症反应、器官衰竭,甚至造成死亡。INF-γ、IL-1、IL-6、TNF和IL-18是CRS中的关键细胞因子。最近研究显示,巨噬细胞过度激活并分泌过量的细胞因子在CAR T细胞治疗相关的CRS形成过程中可能发挥核心作用。鉴于CRS已成为CAR T细胞治疗在肿瘤治疗应用的主要障碍之一,亟需进一步研究CAR T细胞治疗相关CRS的发生机制和预测标志物,实现CAR T细胞治疗不良反应的有效控制。
目前研究CRS的一大挑战是小鼠模型难以满足研究需求。在构建体内肿瘤模型时,首选免疫缺陷小鼠,但是CRS是免疫系统的过度反应,这意味着免疫缺陷小鼠可能无法完全重现CAR T细胞治疗后发生CRS的情况。人类和小鼠的物种差异(导致不同的免疫系统组成)、不同小鼠种系之间的遗传背景差异都会对CRS模型的建立产生影响,如Severe Combine Deficiency Mouse (SCID)小鼠的CRS比NOD-SCID IL-2 receptor gamma null(NSG)小鼠更严重。
综上,近年来对CART细胞治疗相关CRS的机制研究显示,巨噬细胞可能是防治CRS的关键,通过靶向巨噬细胞活化和相关炎症因子的CRS治疗策略也在探索之中。但CRS的发病机制涉及多种免疫细胞、信号通路和细胞因子,这之间复杂、相互关联及动态变化的网络关系仍有待进一步的研究探索,这些研究有望在将来为CRS个体化治疗、拓宽CAR T细胞治疗的适应症提供理论基础。
供稿:崔久嵬教授 吉林大学第一医院
郭寒菲 吉林大学第一医院

教授、主任医师、博士生导师,白求恩名师,现任吉林大学第一医院肿瘤中心肿瘤科主任,兼任中国抗癌协会青年理事会副理事长、中国研究型医院生物治疗委员会副主任委员、中国研究型医院分子诊断委员会副主任委员,中国医药质量管理协会细胞治疗质量控制与研究专业委员会常委、中华医学生物免疫学会常务委员、中国研究型医院学会生物治疗学专业委员会肺癌生物治疗学学组组长、中国抗癌协会营养与支持委员会肿瘤免疫营养学组组长、中国临床肿瘤学会(CSCO)理事、中国免疫学会肿瘤免疫与生物治疗分会委员、中国医药生物技术协会医药生物技术临床应用专业委员会委员等。主持和参加国家科技部重大慢性疾病项目1项,国家自然基金重点项目1项,国家自然基金4项,国家卫生部临床重点项目3项,教育部科学技术研究重大项目1项等,在Blood、Leukemia、Mol Cell Proteomics、Clin Cancer Res 等国际期刊上发表SCI收录文章80余篇,主编学术专著4部,主译学术专著2部。