中国抗癌协会
立即下载App肿瘤标志物新进展(8)|温倜教授谈靶向HIF-1a通过抑制肿瘤微环境PD-L1增强CTLA4抗体疗效


文章简介
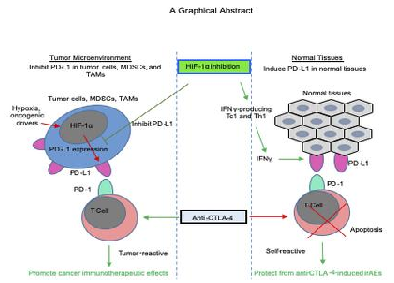
Wang Yin团队首先确定了一个肿瘤PD-L1表达特异性调控靶点HIF-1α,进一步研究发现靶向HIF-1α抑制了肿瘤细胞和肿瘤浸润的髓样细胞上的PD-L1表达。同时,在正常组织中发现,HIF-1α抑制剂可通过IFN-γ依赖性机制诱导PD-L1表达,诱导免疫耐受。应用棘霉素靶向肿瘤细胞中的HIF-1α-PD-L1轴可重新激活肿瘤浸润淋巴细胞(TIL)并引起肿瘤排斥。小鼠肿瘤模型给予HIF-1α抑制剂棘霉素,增强了CTLA-4抗体的癌症免疫治疗效果,其疗效与CTLA-4抗体联合PD-1抗体相当。但棘霉素通过增加正常组织中的PD-L1水平减少了应用CTLA-4抗体后正常组织中T细胞的浸润。综上,HIF-1α抑制剂可在增强CTLA-4抗体疗效的同时降低免疫相关不良反应(irAE),可能是未来CTLA-4抗体联合治疗的更好选择。
研究背景
CTLA-4抗体与PD-1抗体联合治疗是一种有效的肿瘤免疫治疗策略,然而,联合用药可显著增加严重irAE的发生率。因此,双重免疫治疗的一个重要挑战是如何在不损害协同疗效的情况下降低irAE。抗PD-1/PD-L1的一个主要限制是无法区分肿瘤微环境及正常组织中PD-1与PD-L1的相互作用。靶向肿瘤特异性PD-L1是更可取的,因为它可以实现癌症免疫治疗疗效而不引起irAE。既往研究报道,控制PD-L1表达的分子机制在正常组织和癌症有所不同,因此靶向肿瘤特异性PD-L1是有可能实现的。缺氧是区分实体瘤和正常组织的主要标志之一,它通过HIF-1α在肿瘤和髓样细胞中诱导PD-L1。这些发现提出了一种可能性,即抑制HIF-1α可能会选择性地抑制癌症中PD-L1的表达。
研究思路

重要结果
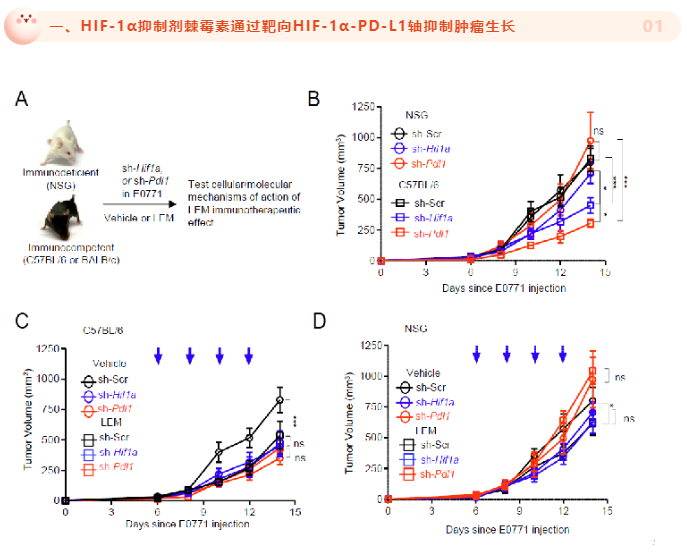
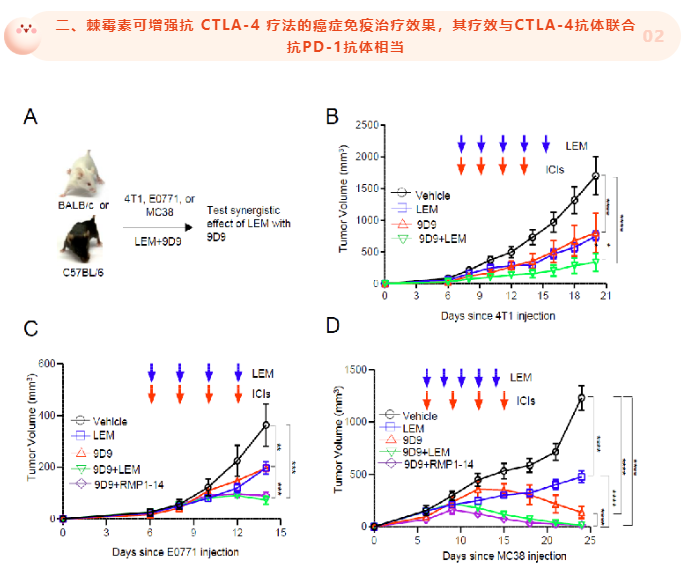
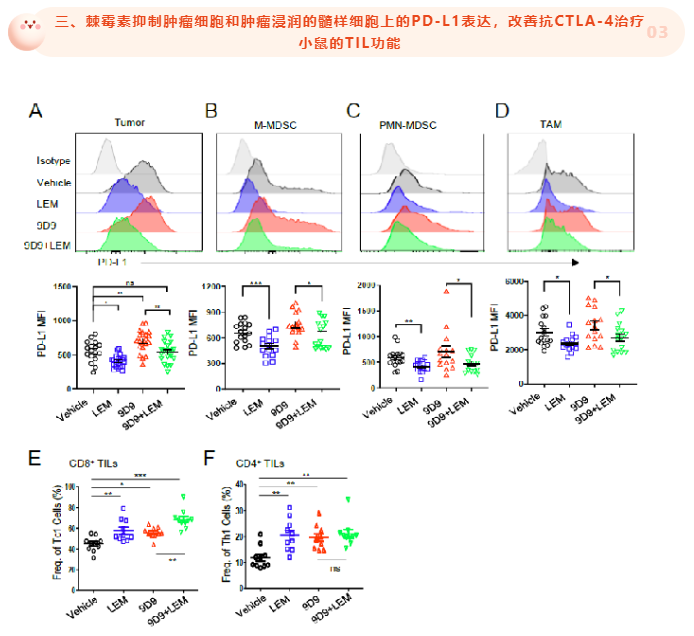
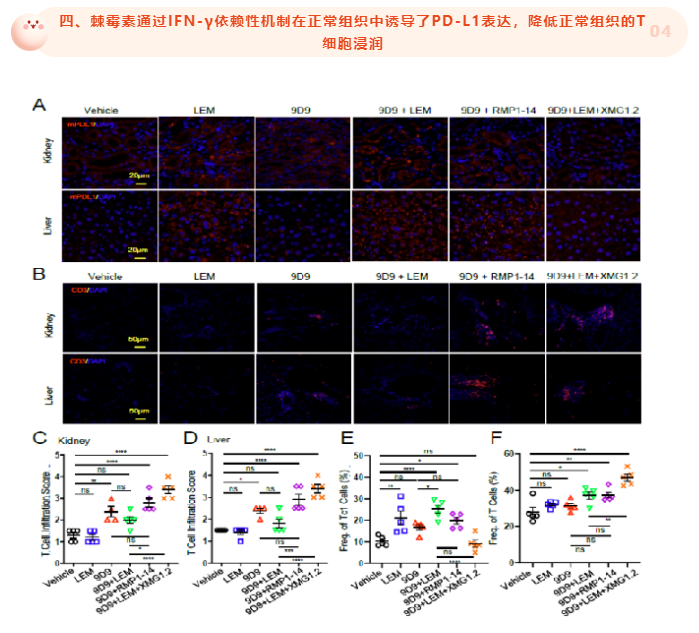
机制总结
靶向 HIF-1α 抑制了肿瘤细胞和肿瘤浸润髓样细胞上的 PD-L1 表达,激活肿瘤浸润淋巴细胞 (TIL) 并引起肿瘤排斥,增强了抗 CTLA-4 疗法的癌症免疫治疗效果;而HIF-1α 抑制剂通过 IFN-γ 依赖性机制在正常组织中诱导 PD-L1表达增加,从而降低治疗中irAE的发生。


1.新靶点
免疫治疗如免疫检查点阻断等方法在临床应用日益广泛,然而药物疗效时常伴随治疗相关副反应的产生。如何在不损害免疫治疗疗效的情况下降低irAE是目前免疫治疗所面临的一个重要挑战。本研究特色在于通过分析肿瘤和正常组织之间的差异,确定了一个肿瘤PD-L1表达的特异性调控靶点HIF-1α,并通过大量体内、外实验探索了在肿瘤与正常组织中,靶向HIF-1α对PD-L1表达的不同调控机制。研究同时证实了HIF-1α抑制剂棘霉素可以增强小鼠CTLA-4抗体的抗肿瘤疗效,其疗效与抗CTLA-4抗体联合抗PD-1抗体相当。临床实践中PD-1抗体与CTLA-4抗体(Ipilimumab)联合治疗容易引发irAE,本研究小鼠模型结果证实,HIF-1α抑制剂棘霉素联合CTLA-4抗体相比前者降低irAE的发生。本研究针对临床实际问题,为CTLA-4抗体联合治疗提供了一个非常有前景的新靶点,也为未来免疫联合治疗的探索提供了新的思路。
2.研究方法值得学习借鉴
本研究中应用了大量动物实验进行验证,研究人员首先分别在免疫缺陷(NSG)和免疫活性(BALB/c或C57BL/6)小鼠荷瘤模型上验证了HIF-1α抑制对小鼠肿瘤生长率的影响,又比较了HIF-1α或PD-L1靶向敲除对免疫活性或免疫缺陷小鼠的肿瘤生长动力学影响。接着应用三种肿瘤细胞系(4T1、E0771和MC38)的小鼠荷瘤模型,验证了CTLA-4单抗联合棘霉素的治疗效果,同时对小鼠模型的肿瘤组织和正常组织进行流式分析与免疫荧光染色进一步验证结果并探索相关机制。最后还应用人源化小鼠的胃肠道irAE模型验证了棘霉素对CTLA-4抗体(Ipilimumab)引发的irAE的保护作用。整个研究工作量大且验证充分,相关实验方法值得我们借鉴与参考。
3.展望
免疫检查点阻断治疗的风险/受益比率依赖于药物对宿主免疫耐受/肿瘤免疫逃逸两方面的博弈。目前尚未发现可以将正常组织免疫耐受和肿瘤免疫逃逸解偶联的办法。本研究从肿瘤局部缺氧特征入手,缺氧可通过HIF-1α在肿瘤和髓样细胞中诱导PD-L1表达,HIF-1α通常在肿瘤细胞中较稳定,但在正常组织中失活。这种差异性使研究人员提出了一个新模式:证明了靶向HIF-1α可以在癌症的临床前模型中实现这种疗效与irAE的解耦效果,这为未来免疫治疗药物的开发提供了新靶点与新思路,未来可借鉴这种“基于肿瘤和正常组织差异特性”进行靶点的筛选,然而如何将此靶点应用于实际临床还需要进一步的实验与探索。本研究验证了靶向抑制HIF-1α可以增强CTLA-4抗体的疗效并降低相关irAE,而HIF-1α抑制剂对于其他免疫检查点阻断剂的作用也值得进一步探索。

