中国抗癌协会
立即下载App期刊|精准医学时代中的个体化肿瘤免疫治疗
个体化免疫治疗
近年来,二代测序技术(Next-generation sequencing,NGS)发展迅速,我们可以绘制多种全面的肿瘤癌症基因组图谱,包括基因突变、基因表达和表观遗传图谱。基于个体癌症基因组信息,有望开发更多可以应用于临床的靶点,这有助于为癌症患者寻找合适的个体化治疗策略。
然而,由于分子靶向药物的种类有限,仅有一小部分癌症患者可以从基因测序中获益。免疫治疗是一种新型疗法,包括免疫检查点抑制剂(ICIs)、个体化癌症疫苗和过继T细胞疗法。来自日本癌症研究基金会癌症精准医疗中心主任、东京大学名誉教授Yusuke Nakamura教授就个体化免疫治疗进行了综述。作者总结了基于肿瘤基因组和分子特征的个体化药物筛选的现状,强调了如何进一步利用个体基因组信息,以及所面临的挑战。
我们邀请中山大学药学院(深圳)高艳锋教授对该文章进行了解读。

No.1 基于体细胞突变的分子靶向药物筛选
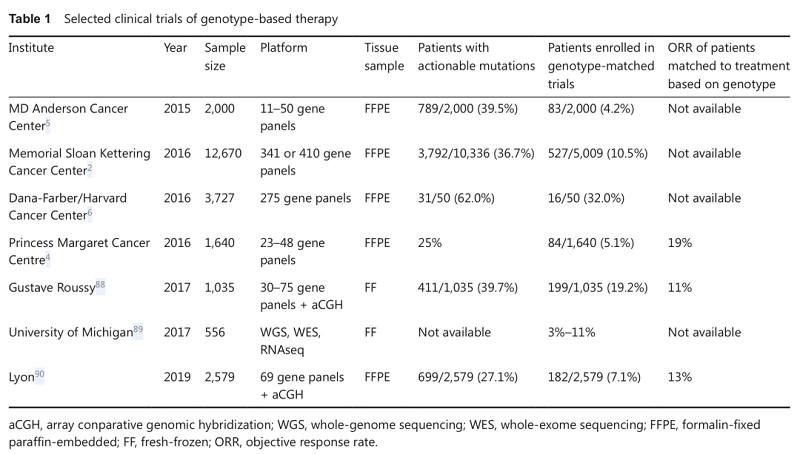
个体肿瘤的遗传或分子特征能够提供精确的信息来预测药物的疗效和/或不良反应风险。随着测序技术的进展,包括体细胞和生殖细胞突变、基因扩增或融合在内的多个遗传生物标志物被发现。有研究表明,与非个体化治疗的临床反应率相比,基于生物标志物筛选的个体化治疗的临床反应率显著提高。NGS靶向基因组测序显示,高达80%的肿瘤至少有一个基因变异,约有40%的患者有一个或多个潜在的治疗靶点。然而,由于患者体能状况、临床试验纳入标准限制或分子靶向药物可及性等因素限制,仅有10%~15%的患者最终接受了适当的靶向药物治疗(表1和图1)。2017年美国美国食品药品监督管理局(FDA)批准了MSK-IMPACT和FoundationOne CDx这两项基于NGS的癌症基因检测分析平台。
与靶向基因组测序相比,全基因组测序(WGS)和全外显子组测序(WES)提供了个体肿瘤患者更全面的基因组图谱信息。WES/WGS和RNAseq提高了生物标志物或驱动突变的检出率,但它们为癌症患者带来的临床获益仍然有限。因此,亟需进一步开发新型分子靶向药物和其他治疗方案。
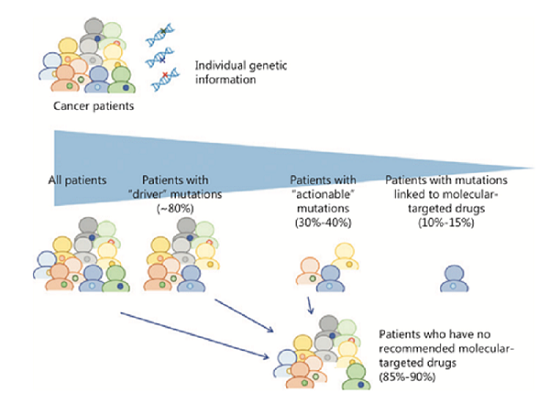
图1 基于基因检测的靶向治疗在肿瘤患者中的应用现状
No.2 免疫检查点抑制剂
旨在恢复T淋巴细胞抗肿瘤功能的ICIs在癌症治疗中展现出独特的优势。目前,靶向PD-1的纳武利尤单抗、帕博利珠单抗和Cemiplimab,靶向PD-L1的Avelumab、阿替利珠单抗和度伐利尤单抗,以及靶向CTLA-4的伊匹木单抗的多款ICIs被美国FDA批准。但仅有20%~30%的患者能够从免疫治疗中获益,由此可见,寻找有效的生物标志物对预测患者临床获益和免疫相关不良反应风险是非常必要的,可以提高免疫治疗的安全性并减少不必要的医疗成本。
PD-L1表达量、PD-L1基因组扩增、高肿瘤突变负荷(TMB)和MSI-H都被用于预测ICIs的临床反应率。但是,仅PD-L1表达量并不能有效预测疗效,这可能与PD-L1蛋白的N-糖基化有关。TMB(≥20个突变/Mb)可以作为预测接受ICIs治疗患者的无疾病生存期(PFS)和总生存期(OS)的独立因素,但是目前仍没有一个通用的TMB阈值标准。当然,抗原提呈元件和IFN信号通路的功能缺失突变、患者外周血TCR的动态变化等其它的因素也与ICIs的临床应答有关。
No.3 新抗原
新抗原是一类在正常细胞中不表达,由肿瘤细胞体细胞突变产生的肿瘤特异性抗原,被认为是理想的免疫治疗靶点。高新抗原负荷与肿瘤内高T淋巴细胞浸润,以及更好的临床疗效之间的相关性已经在多种肿瘤中被证实。
每一种癌症都有其特有的突变,每个癌症患者体内能够诱导细胞毒性T淋巴细胞(CTL)的新抗原差异很大,仅通过现有的基于新抗原表位肽与HLA分子之间亲和力的预测软件很难确定每个患者中是否存在新抗原特异性T细胞。因此,准确预测患者体内能实际诱导CTL的新抗原仍然是当前面临的挑战。该研究组利用WES和/或RNAseq数据开发了一个新抗原预测方法,主要包括4个步骤(图2)。第一步:基于WES和/或RNAseq数据,应用OptiType和Polysolver等方法确定HLA分型;第二步和第三步:确定新抗原和检测突变RNA水平的表达;第四步:预测新抗原多肽和HLA分子之间的亲和力,常用的算法包括NetMHC和NetMHCpan等。
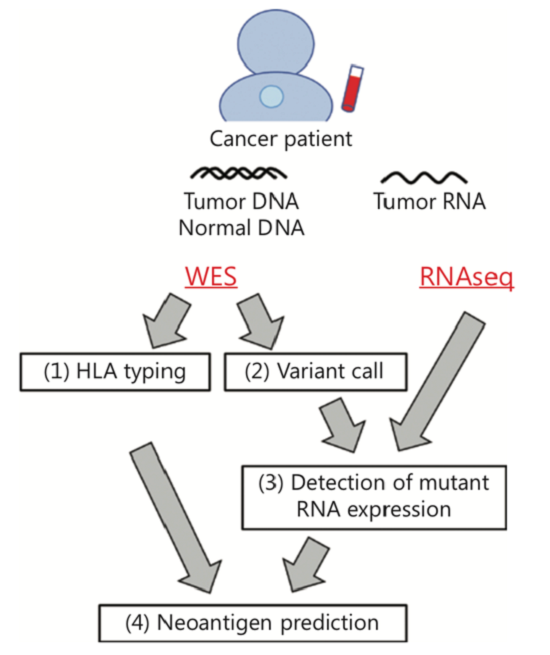
图2 通过基因组测序预测新抗原的流程
尽管由于生信预测软件的显著改进和大量实验数据的积累,我们能够预测多肽与HLA分子之间的相互作用,但是,HLA-肽复合物和TCR之间的相互作用仍很难预测。因此,患者中新抗原肽的免疫原性仍然需要进行实验验证。除了新抗原肽的特性和免疫原性外,还需要考虑肿瘤的异质性和免疫相关基因表达,以便更有效地筛选新抗原。由于抗原递呈信号的缺失是肿瘤细胞最常见的免疫逃避机制,所以筛选来自驱动突变的新抗原更为重要。
No.4 靶向肿瘤特异性新抗原的个体化免疫治疗
近年来,通过增强CTL介导的抗肿瘤免疫应答的几种癌症免疫疗法备受关注,包括肿瘤浸润T淋巴细胞(TILs)的过继转移疗法、肿瘤疫苗和TCR-T细胞过继转移疗法。一项TILs过继疗法治疗转移性黑色素瘤的临床试验结果显示,22%的患者达到完全缓解(CR),总体客观有效率达到了56%。多项TILs疗法的临床试验也正在多种实体瘤中开展。
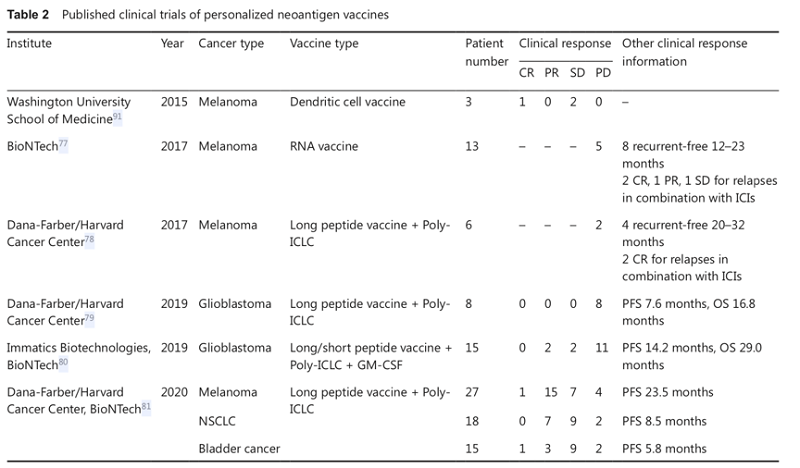
此外,本文还总结了以新抗原或共享抗原为靶点的个体化肿瘤多肽疫苗和树突状细胞疫苗的I期临床试验(表2)。结果显示基于新抗原的癌症疫苗无论是单独使用,还是与抗PD-1抗体联用,都能够在癌症患者中达到获得显著的临床获益。TCR-T细胞过继疗法更是显示出其独特的优势。截至目前的研究都提示我们,基于新抗原的个体化疫苗和过继T细胞疗法将使癌症患者的个体化治疗成为可能。
专家解读
免疫治疗无疑是目前最受关注的肿瘤治疗手段,这篇综述全面总结了NGS诊断与靶向治疗、免疫检查点抑制剂、新抗原以及细胞治疗等在肿瘤个体化治疗中的应用。在精准医学的背景下,肿瘤的个体化免疫疗法已经在临床上展现出一定的疗效,但目前仍然存在一些问题需要今后深入的研究:
个体化与普适性之间的平衡:大多数的肿瘤新抗原人群覆盖率比较低,这是限制基于新抗原的治疗性疫苗和TCR-T细胞治疗临床应用的主要因素之一,筛选具有较高人群覆盖率的共享新抗原和热点突变,并探索针对多种HLA分子均具有较好亲和力的新抗原具有广泛的应用前景。另外,尽管新抗原的表达具有很好的特异性,但是突变抗原肽与野生型抗原肽之间的交叉反应性和TCR识别的特异性问题也不容忽视,这可能会影响新抗原疫苗临床应用的安全性。
肿瘤细胞的免疫逃逸:除了上调免疫检查点分子等抑制性信号,很多肿瘤细胞还可以通过下调HLA分子和下游信号降低对TCR的识别和响应,因此,除了特异性的识别机制,探索更好的联用策略,研发更好的佐剂,尤其是通过激活固有免疫和改善肿瘤微环境显得尤为重要。
实体瘤的物理屏障和代谢微环境:无论是治疗性疫苗还是TCR-T/TIL/CAR-T等细胞治疗手段,都是希望增加肿瘤组织中的抗肿瘤免疫细胞并增强其功能,但是,实体瘤组织的胶原纤维等基质屏障,以及机械力等力学屏障,是阻碍免疫细胞进入实体瘤组织和降低其疗效的重要因素。此外,进入肿瘤组织中的免疫细胞将会面临不一样的营养和代谢微环境,这都给肿瘤的免疫治疗带来了很多挑战。

中山大学药学院(深圳)“百人计划”教授、博士生导师。主要从事肿瘤免疫治疗多肽药物高通量筛选与设计、多肽药物口服递送、多肽疫苗设计与递送。百千万人才工程国家级人选/国家有突出贡献中青年专家(2017),国家优青基金获得者(2018),享受国务院特殊津贴专家(2019)。近年来主持国家优秀青年基金、联合基金重点项目等科研课题,广东省珠江团队和深圳市海外高层次人才团队项目核心成员。获中国抗癌协会青年科学家奖、中国免疫学会青年学者奖、中国多肽产业联盟杰出青年奖、中国药物化学年会青年学者优秀报告奖、中国国际多肽会“Young Peptide Scientist Award”等荣誉。担任中国抗癌协会青年理事会常务理事、中国民族卫生协会临床医学分会理事、APSB和Cancer Biology & Medicine杂志青年编委、Frontiers in Immunology和Pharmacological Research杂志Guest editor等,在Nat Commun、Angew Chem Int Ed、JITC、Nano Lett和J Control Release等杂志发表SCI论文50余篇,获国家发明专利授权25项,并成功转化获试剂盒批号,申请国际PCT专利2项。