中国抗癌协会
立即下载App期刊|转移性乳腺癌内分泌治疗新格局
乳腺癌内分泌治疗的历史悠久,可谓是靶向治疗的探路者、分类治疗的先行者,是激素受体(HR)阳性、人表皮生长因子受体2(HER2)阴性转移性乳腺癌 (MBC)的主要治疗手段。随着对HR+乳腺癌复发特性的认知加深,药物毒性及依从性的日益关注,内分泌治疗新药的不断涌现和快速审批,MBC内分泌治疗模式及管理流程也愈加纷繁复杂。
西雅图癌症治疗联盟/华盛顿大学Poorni M. Manohar教授就MBC内分泌治疗进行综述,回顾了内分泌治疗的发展历程,讨论了该领域的重要临床试验,强调内分泌在HR+/HER2- MBC治疗格局中发挥的作用,同时提出具有临床指导价值的治疗策略。
我们邀请中国医科大学附属一院徐莹莹教授进行解读。


文章学术观点
No.1 MBC的治疗原则
MBC属不可治愈性疾病,临床医生应与患者共同决策以最大限度地延长生命、提高生活质量。对于MBC患者,首先应明确疾病的分子状态,这是预后判断和治疗选择的关键因素,在很多患者中可见原发肿瘤和转移部位之间的受体表达差异。评估患者症状和疾病负荷是选择治疗方案的下一个关键步骤。内分泌治疗已成为HR+/HER2- MBC的首选治疗策略,仅对于有内脏危象的患者需要进行化疗以获得快速缓解。但目前对于内脏危象并没有被广泛接受的定义,一般指疾病负担过重或转移部位对器官功能具有较重影响,如肺淋巴管转移、骨髓浸润、癌性脑膜炎、弥漫肝转移等。最后需考量接受内分泌治疗与发生复发转移的时间间隔,对于辅助内分泌治疗期间或完成治疗1年内发生转移的患者应慎重给予内分泌治疗,以避免由于耐药导致的治疗失败。
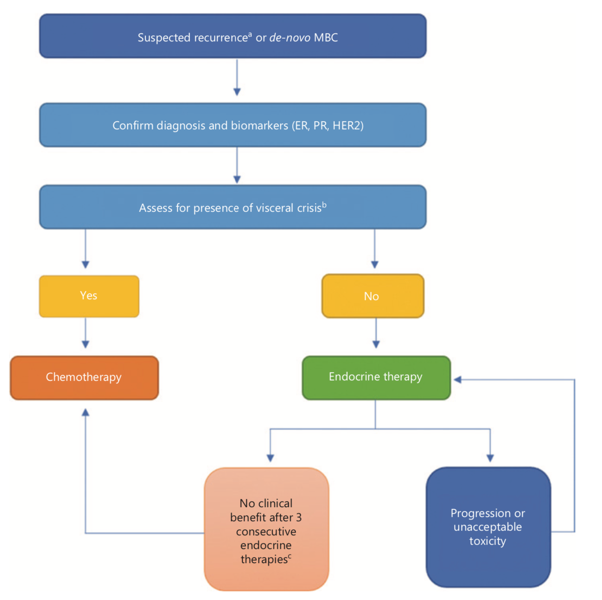
图1 HR+/HER2- MBC治疗选择的一般流程
No.2 HR+/HER2-转移性乳腺癌的内分泌治疗选择
对于没有内脏危象的患者,内分泌治疗是 HR+/HER2- MBC的主要方式。既往以消耗雌激素配体或靶向雌激素受体信号通路为目标的单药内分泌治疗一直是标准治疗方案。研究显示,芳香化酶抑制剂(AI)较他莫昔芬显著改善了绝经后MBC患者的无进展生存期(PFS),成为一线治疗选择,并且三种AI的疗效相当。后续研究表明,雌激素受体降解剂氟维司群(fulvestrant)较AI有更显著的PFS提升,尤其对于既往未接受过辅助内分泌治疗的患者。此外,与非甾体芳香化酶抑制剂(NSAI)单药相比,联合氟维司群具有显著的OS获益。
No.3 联合靶向治疗
二代测序技术的进步促进乳腺癌精准诊疗发展,据报道,约40% HR+/HER2- MBC患者存在PIK3CA的激活突变。研究表明,与单用氟维司群相比,PIK3CA抑制剂联合氟维司群显著提高患者的PFS。mTOR信号通路的胞内激活也被认为是MBC内分泌治疗抵抗的机制之一。对于一线内分泌治疗进展且没有内脏危象的患者,可选择联合mTOR抑制剂依维莫司进行二线治疗。表观遗传修饰基因表达变化也可导致耐药,HDAC抑制剂可逆转耐药,既往使用NSAI出现疾病进展的MBC患者,使用依西美坦联合HDAC抑制剂恩替诺特可显著改善PFS和OS。但联合用药时应注意身体状况评估及毒副反应监测,如PIK3CA抑制剂可引起高血糖血症,据报道约36%患者发生3~4级不良反应;mTOR抑制剂与更多的3~4级贫血、高血糖和肺炎相关。
No.4 CDK4/6抑制剂
CDK4/6抑制剂出现之前,HR+/HER2- MBC患者的中位OS为16~26个月,CDK4/6抑制剂的问世显著提高了此类患者的PFS和OS。临床前研究表明,持续的cyclin D1表达和CDK4/6的结构性激活可导致内分泌治疗耐药,为开展CDK4/6抑制剂联合内分泌治疗研究提供了强有力的依据。
Ⅱ期临床试验PALOMA-1首次证实CDK4/6抑制剂哌柏西利联合内分泌作为一线治疗的协同优势,并在随后的PALOMA-2 Ⅲ期试验中得到验证。PALOMA-2研究纳入666例未经系统治疗的绝经后 ER+/HER2- MBC 患者,2:1 随机接受哌柏西利(palbociclib)+来曲唑或来曲唑单药治疗,结果显示联合组显著改善患者的PFS(24.8个月 vs 14.5个月, P<0.0001),亚组分析表明无论既往是否接受过内分泌治疗、无病间期(TFI)时长、以及是否有内脏转移,联合组均有显著生存获益。另外两种CDK4/6抑制剂也报道了相似结果,表明其在MBC中的出色疗效。MONALEESA-2研究中ribociclib联合来曲唑一线治疗可显著提高绝经后ER+/HER2- MBC患者的PFS。MONALEESA-7研究首次将ribociclib应用于绝经前患者,中位随访42个月联合组的OS率达70.2%,显著高于单纯内分泌治疗组,2018年获批成为首个一线治疗绝经前MBC的CDK4/6抑制剂。MONARCH-3试验中位随访26个月的结果表明,阿贝西利(abemaciclib)联合NSAI一线治疗绝经后HR+/HER2- MBC的PFS为28.1个月,显著高于NSAI组的14.7个月(P=0.000002)。
对既往经过解救内分泌治疗的患者,MONARCH-2研究证实阿贝西利联合氟维司群显著改善患者中位OS至46.7个月。PALOMA-3研究的数据支持哌柏西利联合氟维司群用于二线治疗,并且其疗效与内分泌耐药程度、激素受体表达水平和PIK3CA突变状态无关。同样,MONALEESA-3研究结果也支持ribociclib联合内分泌作为既往未使用过CDK4/6抑制剂患者的二线选择。MONARCH-1研究显示阿贝西利单药治疗既往内分泌治疗或化疗进展后的HR+/HER2-晚期乳腺癌能够带来生存获益。
总的来说,在一线治疗中,CDK4/6抑制剂将MBC患者的PFS提高了一倍,并取得OS获益,CDK4/6抑制剂高效低毒的特性使其成为 HR+/HER2- MBC 治疗的首选。在二线治疗中,既往未使用过CDK4/6抑制剂的患者也可以选择CDK4/6抑制剂。此外,阿贝西利是三种 CDK4/6抑制剂中唯一单药治疗有效的药物,可作为一线、二线选择。作者归纳了一个简化的治疗策略流程图以指导临床应用(图 2)。
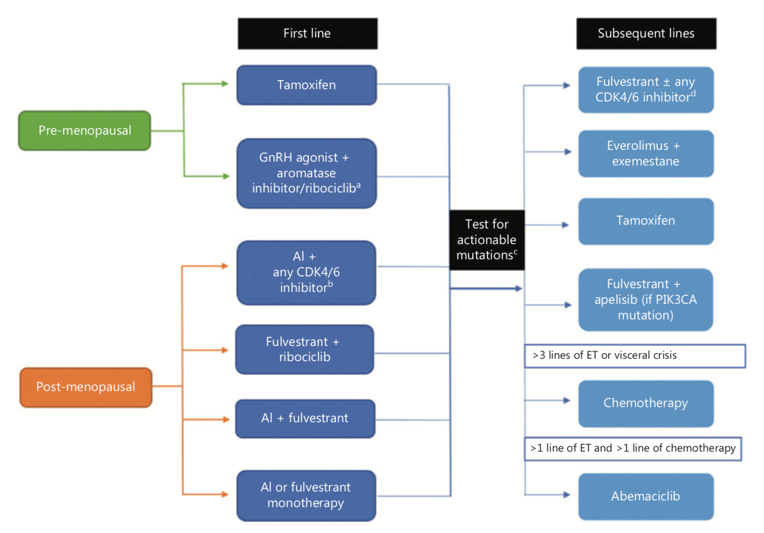
图 2 HR+/HER2- MBC癌的治疗策略
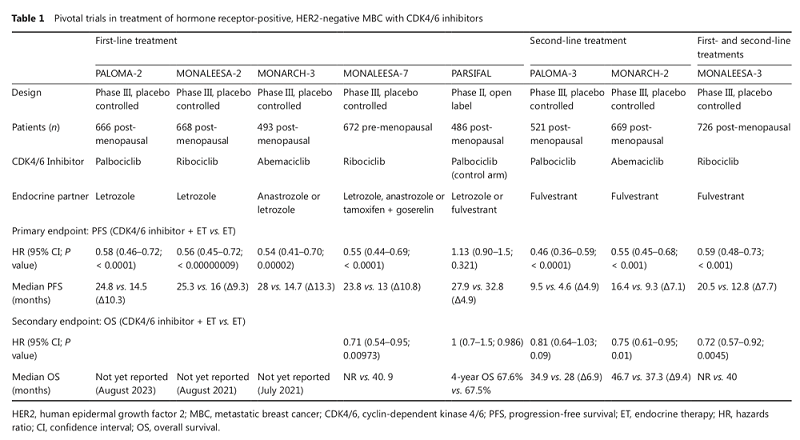
图3 CDK4/6抑制剂治疗HR+/HER2- MBC的关键性研究
No.5 特殊的注意事项
辅助内分泌治疗期间或完成后1年内复发
此类患者对一线内分泌治疗的效果不佳,并且常被排除在临床试验之外,甚至许多关键的CDK4/6抑制剂研究也未将该类人群纳入。PALOMA-3研究包含了辅助内分泌治疗后1年内复发的患者,提示哌柏西利联合氟维司群可作为一种治疗选择。另一种策略是将化疗作为一线治疗以获得最大肿瘤缓解,然后进行内分泌维持治疗。PEARL研究中包含了完成NSAI辅助内分泌治疗1年内复发、AI停药一个月内复发或AI治疗中复发的人群,虽然哌柏西利联合内分泌对比卡培他滨没有取得疗效上的优效结果,但从安全性来看内分泌治疗还是“略胜一筹”。未来研究将继续聚焦内分泌耐药患者的治疗策略。
不能耐受 CDK4/6 抑制剂的患者
中性粒细胞减少、疲倦、恶心是CDK4/6抑制剂的常见不良反应。虽然在PALOMA-2研究中,56.1%的患者出现了3度中性粒细胞减少,但发热性粒细胞减少的比例很低。肝毒性和QT间期延长是ribociclib较为少见的不良反应,用药期间需监测转氨酶和心电图。阿贝西利的不良反应主要为腹泻,但多数为1级,由于其优先靶向CDK4而非CDK6的独特作用机制,骨髓毒性较低,可以持续给药。此外,与其他CDK4/6抑制剂相比,阿贝西利具有更好的中枢神经组织(CNS)穿透能力。
虽然CDK4/6抑制剂的获益不受年龄限制,但75岁以上患者中有88.8%会发生3~4级严重不良反应,<75岁的患者中有73.4%发生严重不良反应,导致患者 生活质量降低。因此,对于基线即存在中性粒细胞减少、一般状态不佳或高龄不能耐受CDK4/6抑制剂的患者,可选择AI或氟维司群单药治疗。
同期进行姑息放疗
他莫昔芬和AI与姑息性放疗同时进行的安全性已有报道。临床前研究显示,在小鼠模型中哌柏西利可以使放疗增敏,一些回顾性研究报道了CDK4/6 抑制剂同步放疗的安全性。其他靶向药物包括alpelisib和依维莫司与放疗的关系尚未见报道。靶向联合内分泌治疗与放疗的时序问题有待大样本临床试验给出答案。
ESR1突变作为内分泌耐药的分子标志物
内分泌耐药的机制纷繁复杂,包括ER表达缺失、ER活性改变、凋亡和细胞周期信号失调、酪氨酸激酶和应激/细胞激酶途径过度活化等。其中,ESR1突变被认为在获得性内分泌耐药中发挥关键作用。约20%~40%的HR阳性MBC患者存在ESR1突变,晚期疾病中发生率更高,大多发生在AI辅助治疗后。PADA-1研究在一线应用CDK4/6抑制剂联合AI患者中,每两个月进行一次游离DNA ESR1突变检测,与 ESR-1野生型患者(中位PFS)26.7个月)相比,ESR1突变患者预后较差(中位PFS 11.0个月)。有趣的是,治疗1个月后ESR1突变转阴的患者,PFS几乎等同于基线ESR-1野生型患者,这表明AI和CDK4/6抑制剂在该人群中仍具有一定活性。
专家解读
随着CDK4/6 抑制剂、mTOR 抑制剂、PI3K 抑制剂等新药的问世,“靶向联合内分泌”模式开辟了MBC内分泌治疗的新格局。本综述就当前的治疗原则、治疗流程及治疗策略进行更新及梳理。耀眼新星CDK4/6抑制剂在PALOMA、MONALEESA及MONARCH系列研究中均有不俗表现,如与单药内分泌相比延长近2倍的PFS,联合氟维司群二线治疗既往AI 失败患者的PFS达11~18个月,MONALEESA-7研究取得绝经前人群的突破,极大提升了MBC治疗疗效,延长了患者OS,提高了生活质量,树立了其在HR+/HER2- MBC中的一线及二线治疗地位。
治疗格局的改变,也促使2021年第6届ESO-ESMO晚期乳腺癌国际共识大 会(ABC6)重新定义了内分泌敏感性问题,从原来的两分法划分成目前的三类人群:①未曾接受内分泌治疗的naïve患者;②原发性内分泌耐药患者,包括辅助内分泌治疗2年內复发或晚期一线内分泌治疗6个月内进展;③继发性内分泌耐药患者,定义为所有其他情况。这意味着继发内分泌耐药所覆盖的范围进一步扩大,包含了既往内分泌敏感的部分人群。
解救治疗中疾病进展的判断对治疗决策至关重要。骨“假性进展”是指在治疗过程中CT/MRI证实骨内有新病灶,多为成骨性改变,容易出现在使用CDK4/6 抑制剂的患者中,此时不应停药。研究表明,继续原方案治疗的中位PFS和骨外客观缓解率与未出现骨新发病灶的患者相当,故应制定更为精确的评估方法,以确保患者获益最大化。
尽管CDK4/6抑制剂疗效显著,但仍会出现耐药。那么,耐药后治疗策略如何调整,耐药机制是什么,如何筛选患者,这些问题都亟需解答。然而目前能给出的答案并不多。二代测序(NGS),尤其是高通量ctDNA检测,能够反映突变情况,有助于耐药识别并辅助医生制定下一步策略。与CDK4/6抑制剂耐药相关的突变包括RB1丢失、AURKA扩增、ERBB2(HER2)激活、FGFR2激活、RAS激活、PI3K/AKT突变、CCNE2扩增、ESR1突变等。一些新药研发及临床试验也正在如火如荼的开展,PI3K抑制剂的后续潜力初现端倪。SOLAR-1研究中包含不足 10% CDK4/6抑制剂失败的患者,结果表明PI3K抑制剂(Alpelisib)联合氟维司群较单药氟维司群显著延长中位PFS近1倍(11个月 vs 5.7个月)。BYLieve研究则主要针对CDK4/6抑制剂耐药的PIK3CA突变患者,Alpelisib联合内分泌的中位PFS可达5.6个月。虽然仅为小样本的Ⅱ期临床研究,我们也看到其在CDK4/6 抑制剂后线治疗的潜力。Aurora激酶抑制、FGFR抑制剂已经在临床前研究中显示出治疗活性。未来,乳腺癌领域的研究将继续在耐药机制方面深入探索,通过基础转化研究探寻出路,晚期药物向早期乳腺癌阶段的拓展也是研究方向之一,将不断重塑乳腺癌治疗新格局。

教授/主任医师,博士生导师。中国医科大学附属一院乳腺外科行政副主任。辽宁省特聘教授。中华医学会肿瘤学分会委员,中国抗癌协会协会青年理事会理事,中国抗癌协会乳腺癌专业委员会委员,中国抗癌协会乳腺癌专业委员会青委会副主任委员,辽宁省医学会肿瘤学分会青委会主任委员。MD Anderson Cancer Center 访问学者,主持国家自然科学基金课题3项,省部级课题7项。荣获省部级科技进步奖5项,第九届辽宁青年科技奖。入选辽宁省百千万人才工程“百”层次,荣获辽宁省“科技创新领军人才”称号。