中国抗癌协会
立即下载App2020版ESMO指南:早期乳腺癌的治疗要点

编者按
2019年欧洲肿瘤医学协会(ESMO)发布了最新版原发性乳腺癌诊断、治疗和随访临床实践指南。鉴于种族和地域不同,2019年6月韩国KSMO、中国CSCO、印度ISMPO、日本JSMO、马来西亚MOS和新加坡SSO的专家齐聚首尔,经面对面讨论,以最新ESMO指南为基础,制定了2020版泛亚ESMO早期乳腺癌管理指南,全文发表于《肿瘤学年鉴》(Ann Oncol)杂志。
早期乳腺癌的治疗
一般原则
1、建议乳腺癌患者在专业认证机构认证的乳腺癌专业医学中心治疗。专业的乳腺癌单位/中心能够为收治的大量乳腺癌患者(每年至少150例新的早期乳腺癌病例)提供专业治疗,并改善患者生活质量(QoL)。
2、早期乳腺癌治疗复杂,包括:局部治疗[手术、放疗(RT)]、全身治疗(ChT、ET、分子靶向治疗)和支持治疗。诊断技术涉及生物标志物检测,如ER、PgR、HER2和Ki67,并根据已批准的基因组帮助患者确定治疗方向。
3、治疗策略的选择应基于肿瘤负荷/部位(原发性肿瘤大小和部位、病变数量、淋巴结受累程度)、生物学(病理,包括生物标志和基因表达)以及患者年龄、绝经情况、一般健康状况和偏好。
4、年龄应与其他因素综合考虑,不应作为停止或推荐某个治疗的唯一决定因素。尤其是对于年轻的绝经前患者,在开始任何全身治疗前,如果有需求,应讨论有关生育的问题,并讨论生育能力保存技术。有关生育能力保存的详细信息,请参阅相应的ESMO临床实践指南。
局部治疗
手术治疗
保乳手术(BCS) 目前,在西欧60%-80%新诊断癌症在诊断时或PST后均可接受保乳治疗(广泛的局部切除和放疗)。在对ChT高度敏感的亚型中,如三阴性和her2阳性,在肿瘤>2cm或阳性的腋窝中,应首选新辅助治疗。保乳手术需满足:①对于多数早期乳腺癌患者,BCS是优选局部治疗,必要时通过肿瘤整形技术,以保证有难度的病例也能保持良好的乳腺外观。②仔细评估切缘的组织学,需要墨染的边缘无肿瘤残留,原位癌需>2mm。
乳房切除 除乳房切除术和保留乳头的乳房切除术(SSM)外,保留乳头切除乳房切除术(NSM)在过去十年中得到了越来越多的应用。从肿瘤学的角度来看,NSM在选定的患者中已被证明是安全的,并可以改善治疗和预防性手术的美容结果。①应进行乳房重建,并应告知所有需要乳房切除的女性有乳房重建可用。②绝大多数患者应进行即时乳房重建,炎性乳腺癌除外。③每个患者的最优重建技术应个体化确定,应考虑解剖、治疗和患者相关风险因素以及偏好。
腋窝治疗进展 ①SLNB(前哨淋巴结活检),而非全腋窝淋巴结清扫,是早期、临床淋巴结阴性乳腺癌的标准腋窝分期。②腋窝疾病负荷较低患者(微转移或1~2个SLNs转移需术后乳腺RT),SLNB分期阳性后进一步行腋窝手术并无必要。③无论乳腺手术类型,SLNB阳性患者行腋窝放疗是有效的替代治疗。
手术治疗原位恶性肿瘤(上皮内瘤变) ①对于DCIS,BCS后全乳放疗或全乳切除是可接受的治疗方案。②采用BCS治疗时,对于全乳放疗的DCIS,2mm的切缘足矣。③DCIS不应常规进行SLNB,除非是大的和/或高级别肿瘤,特别是需要乳房切除时。
隐匿性乳腺癌的处理 隐匿性乳腺癌是一种表现为淋巴结转移的肿瘤,在乳腺内没有可识别的原发病变。它占所有新诊断乳腺癌病例的0.5%。常规诊断,除了标准的乳房和腋窝成像外,还需要乳房MRI和PET-CT(以排除另一个原发肿瘤部位)。首选局部处理是ALND(腋窝淋巴结切除)和全乳放疗。
减低风险的乳腺切除 ①减低风险手术(预防性双侧乳腺切除和重建)适用于风险极高女性,如BRCA1或BRCA2基因突变携带者或因淋巴瘤接受过胸部放疗者。进行这种手术之前,应强制性进行仔细的遗传评估和心理辅导,还应讨论密切随访。②对于选择双侧乳房切除术(对侧减低风险手术)而不是首选保乳手术的非高危患者,应该使其了解早期乳腺癌采用BCS治疗的生存结果可能会好于(至少不差于)接受乳房切除术的患者。
全身治疗(PST)后手术 ①早期乳腺癌患者PST后的手术应根据一般原则进行,兼顾基线肿瘤特征及治疗后结果。②如拟进行BCS,必须标明肿瘤位置,治疗前后的乳腺评估应使用MRI或其他可选的影像学方法。③临床阴性腋窝,SLNB可在PST前或PST后进行,PST 后SLNB优选。④基线腋窝受累淋巴结转变为阴性患者,部分可进行SLNB,如阴性则可避免腋窝手术。⑤PST后SLNB中发现肿瘤结节,提示应进行ALND。
放射治疗
BCS后全乳放疗 ①BCS术后强烈推荐RT。②较高局部复发风险患者,推荐加量放疗以减少乳房内复发风险。
BCS后部分乳腺加速放疗(APBI) APBI适用于低危局部复发患者。
乳腺切除术后放疗(PMRT) PMRT推荐用于高危患者,包括切缘受累、腋窝淋巴结受累和T3-T4肿瘤,1~3个腋窝淋巴结阳性患者也应考虑进行PMRT。对于有PMRT适应征的患者,考虑美观和并发症风险,通常通过自体组织重建进行乳房重建。
区域放疗 ①如果需要术后放疗,可在即时乳房重建后进行。②需要多学科和患者参与的交互式方法,确定个体化的最佳顺序、乳房重建类型和放疗。
放疗剂量及分割 乳腺癌常规术后放疗推荐中等分割计划(15~16分割,≤3 Gy /分割),可根据当地医保和设备情况进行调整。
原位恶性肿瘤(上皮内瘤变)放疗 ①减低风险手术(预防性双侧乳腺切除和重建)适用于风险极高女性,如BRCA1或BRCA2基因突变携带者或因淋巴瘤接受过胸部放疗者。进行这种手术之前,应强制性进行仔细的遗传评估和心理辅导,还应讨论密切随访。②对于选择双侧乳房切除术(对侧减低风险手术)而不是首选保乳手术的非高危患者,应该使其了解早期乳腺癌采用BCS治疗的生存结果可能会好于(至少不差于)接受乳房切除术的患者。
全身治疗(PST)后手术 ①多数BCS治疗的DCIS,推荐全乳放疗。②低危DCIS,不放疗也是一种选择。③较高风险发生局部治疗失败的患者,可考虑瘤床加量。④DCIS不推荐PMRT。
全身治疗
新辅助全身治疗
一般原则
1、辅助性全身治疗宜在术后3~6周内开始,新辅助全身治疗应在诊断和分期完成后开始,理想情况下2~4周内。
2、辅助治疗的决定应基于个体复发风险(取决于肿瘤负荷和肿瘤生物学)、特定类型治疗的敏感性预测、治疗获益以及相关的长短期毒性、患者生理年龄、一般健康状况、并发症和偏好。
3、所有luminal样癌症均应进行ET治疗。
4、多数luminal A样肿瘤不需要化疗,但高负荷疾病时除外。
5、luminal B样HER2阴性患者是否化疗取决于复发风险、预估的ET治疗反应以及患者偏好。
6、辅助化疗适应症不确定时(考虑所有临床和病理因素后),可使用uPAPAI1表达或基因表达分析帮助决策,如MammaPrint、Oncotype DX、Prosigna、Endopredict或Breast Cancer Index。
7、Luminal B样HER2阳性肿瘤应采用化疗、ET和抗HER2治疗。部分低危患者存在化疗禁忌症时,可考虑抗HER2和ET治疗。
8、TNBC(三阴性乳腺癌)应接受化疗,低危的特殊组织学亚型可能例外,如分泌性幼年性癌或腺样囊性癌。
9、HER2阳性癌症应接受化疗+抗HER2治疗,除了非常低危的部分病例,如T1aN0肿瘤。
10、除GnRH类似物用于卵巢保护外,化疗不应与ET同时应用。
11、抗HER2治疗可与非蒽环为基础的化疗、ET和RT联合应用。
12、抗HER2治疗、ET、非蒽环非紫杉为基础的化疗期间,RT可安全使用。
13、如果需要化疗和RT,化疗通常先于RT 。
乳房切除 ①应进行乳房重建,并应告知所有需要乳房切除的女性有乳房重建可用。②绝大多数患者应进行即时乳房重建,炎性乳腺癌除外。③每个患者的最优重建技术应个体化确定,应考虑解剖、治疗和患者相关风险因素以及偏好。
腋窝治疗进展 ①SLNB(前哨淋巴结活检),而非全腋窝淋巴结清扫,是早期、临床淋巴结阴性乳腺癌的标准腋窝分期。②腋窝疾病负荷较低患者(微转移或1~2个SLNs转移需术后乳腺RT),SLNB分期阳性后进一步行腋窝手术并无必要。③无论乳腺手术类型,SLNB阳性患者行腋窝放疗是有效的替代治疗。
手术治疗原位恶性肿瘤(上皮内瘤变) ①对于DCIS,BCS后全乳放疗或全乳切除是可接受的治疗方案。②采用BCS治疗时,对于全乳放疗的DCIS,2mm的切缘足矣。③DCIS不应常规进行SLNB,除非是大的和/或高级别肿瘤,特别是需要乳房切除时。
隐匿性乳腺癌的处理 首选局部处理是ALND(腋窝淋巴结切除)和全乳放疗。
减低风险的乳腺切除 ①减低风险手术(预防性双侧乳腺切除和重建)适用于风险极高女性,如BRCA1或BRCA2基因突变携带者或因淋巴瘤接受过胸部放疗者。进行这种手术之前,应强制性进行仔细的遗传评估和心理辅导,还应讨论密切随访。②对于选择双侧乳房切除术(对侧减低风险手术)而不是首选保乳手术的非高危患者,应该使其了解早期乳腺癌采用BCS治疗的生存结果可能会好于(至少不差于)接受乳房切除术的患者。
全身治疗(PST)后手术 ①早期乳腺癌患者PST后的手术应根据一般原则进行,兼顾基线肿瘤特征及治疗后结果。②如拟进行BCS,必须标明肿瘤位置,治疗前后的乳腺评估应使用MRI或其他可选的影像学方法。③临床阴性腋窝,SLNB可在PST前或PST后进行,PST 后SLNB优选。④基线腋窝受累淋巴结转变为阴性患者,部分可进行SLNB,如阴性则可避免腋窝手术。⑤PST后SLNB中发现肿瘤结节,提示应进行ALND。
内分泌治疗
绝经前患者 ①绝经前女性,5~10年他莫昔芬是标准治疗,第一个5年他莫昔芬治疗期间绝经的患者,应考虑转换为来曲唑,这取决于晚期复发风险。②需要化疗的高危患者中,恢复月经者应强烈考虑在ET基础上增加OFS(尤其是第1年,前2年内亦可接受),并进行个体化评估。③高危患者可考虑AI代替他莫昔芬,并强制性进行有效的OFS治疗,以生化控制雌激素水平。④<35岁不需要化疗患者中,OFS的作用并不清楚,但年轻Luminal型早期乳腺癌患者的结果更差,提示应使用最有效的ET(如联合OFS)治疗。⑤化疗期间OFS对卵巢功能有一定保护作用,对肿瘤结果无不良影响,因此应向患者推荐。然而,对于想要怀孕患者,它不应成为唯一的生育保护方法。
绝经后患者 ①对绝经后女性,AIs(非甾体和甾体类)和他莫昔芬均是标准治疗。②AIs可一线使用(非甾体AI和依西美坦),2~3年他莫昔芬后使用(非甾体AI和依西美坦)或作为5年他莫昔芬后的延长辅助治疗(来曲唑和阿那曲唑)。③应与所有患者讨论延长辅助治疗,除了极低复发风险患者。但最佳辅助ET治疗时间和方案目前仍不清楚,AIs使用>5年只有很小的获益。④接受OFS和AIs的患者应补充足够的钙和维生素D3,并定期评估骨密度( DEXA扫描)。⑤CYP2D6多态性决定是否使用他莫昔芬辅助治疗还未得到证实。
化疗
1、 化疗应使用12~24周(4~8个周期)。
2、序贯蒽环/紫杉为基础的方案是多数患者的标准治疗。
3、部分较低危患者可采用4个周期的蒽环或紫杉为基础的化疗或CMF方案。
4、非蒽环类方案可用于有心脏并发症风险的患者。
5、蒽环为基础的方案最好不包括5-FU(EC或AC是标准方案)。
6、辅助治疗时不应常规使用铂剂。
7、应考虑使用剂量-密度方案(粒细胞集落刺激因子[G-CSF]支持),特别是高度增殖的肿瘤。
抗HER2治疗
1、新辅助曲妥珠单抗治疗非常有效,所有早期HER2阳性乳腺癌且没有禁忌症的患者均应使用,除了极低风险病例,如T1aN0肿瘤。
2、如果在另一种分析方法检测后,HER2结果仍不确定,此时仍要考虑HER2靶向治疗。
3、1年的(新)辅助曲妥珠单抗治疗对于多数HER2阳性患者仍是标准治疗。
4、低危患者接受蒽环-紫杉为基础的化疗后,可考虑曲妥珠单抗持续时间缩短到6个月。
5、曲妥珠单抗通常不应与蒽环类化疗同时进行,可与非蒽环为基础的化疗安全的联合应用(如紫杉醇),而且这种联合治疗较序贯治疗更有效。
6、曲妥珠单抗开始前和治疗期间应强制性的进行心脏常规监测。
7、曲妥珠单抗/拉帕替尼双重阻断治疗并未改善长期结果,因此不推荐。
8、曲妥珠单抗/帕妥珠单抗双重阻断治疗可考虑用于高危患者(定义为淋巴结阳性或ER阴性),治疗时间1年,手术前后开始均可[ESMO MCBS v1.1 评分B]。
9、 新辅助化疗联合抗HER2治疗完成后,残留侵袭性疾病时,辅助T-DM1治疗应取代辅助曲妥珠单抗治疗。
10、部分高危、既往未进行过双靶阻断治疗患者可考虑使用奈拉替尼延长抗HER2治疗,治疗时应给予腹泻预防和管理。
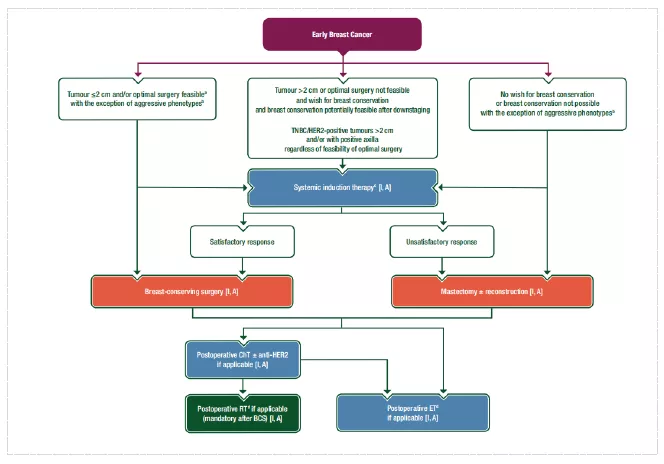
(新辅助)全身治疗
1、PST用于减少局部晚期或大肿瘤的手术范围,特别是由于肿瘤大小而需乳房切除术时。对于所有肿瘤>2cm、需要化疗的患者均应考虑PST,特别是三阴性和HER2阳性亚型。
2、术前使用的药物和方案的选择应遵循与术后治疗相同的原则,多数患者推荐蒽环和紫杉序贯方案。
3、三阴性肿瘤和/或携带有害BRCA1/2突变患者可考虑加入铂剂治疗。
4、如果使用PST,所有化疗应于术前完成。
5、高危、三阴性患者标准新辅助化疗后没有达到pCR,术后应考虑增加卡培他滨治疗6~8个周期。
6、绝经后、ER阳性/ HER2阴性需要PST的患者,应考虑术前ET (4~8个月或直到最大治疗反应),术后亦应继续ET治疗。

对早期乳腺癌亚型的系统治疗建议
双磷酸盐治疗
1、推荐双磷酸盐用于早期乳腺癌、处于低雌激素状态(OFS或绝经后)患者,特别是高危复发患者。
2、双磷酸盐也推荐用于治疗相关骨质疏松患者。
其他临床情况
老年患者的治疗
1、老年早期乳腺癌患者的治疗应适应其生物学年龄,对体弱患者应采用较温和的治疗方案,适用于标准化疗的患者应给予标准的多药方案。
2、 治疗决策前应进行老年评估。
男性乳腺癌治疗
1、男性乳腺癌的标准辅助ET是他莫昔芬。
2、如果存在他莫昔芬禁忌,可考虑AI联合LHRH激动剂,并与患者讨论这种治疗的较高毒性问题以提高治疗依从性。
3、男性乳腺癌患者不能单独使用AI作为辅助ET治疗。
4、化疗、抗HER2治疗适应症以及治疗方案应遵循女性乳腺癌的推荐。
导管原位癌的全身辅助治疗
1、DCIS局部保留性治疗后,可使用他莫昔芬和AIs防止局部复发和减少第二原发乳腺癌的发生。
2、 DCIS乳房切除术后,对于高危新发乳房肿瘤患者,可考虑使用他莫昔芬或AIs减少对侧乳腺癌风险。
个体化治疗
1、ER、PgR和HER2状态指导所有全身治疗决策。
2、基于ER、PgR、HER2和Ki67确定肿瘤表型,定义乳腺癌亚类。
3、 当治疗决定具有挑战性时,如luminal B样/ HER2阴性和淋巴结阴性/淋巴结1~3个阳性的乳腺癌,uPA-PAI1表达或多基因检测,如MammaPrint、Oncotype DX、EndoPredict、Prosigna或Breast Cancer Index,可与临床病理因素联合指导全身治疗。