中国抗癌协会
立即下载App盘点2020 | 武爱文教授:2020年度结直肠癌外科治疗领域进展

一个年度的盘点,也是下一个年度的起点
酸甜交错的2020离我们远去
充满期盼的2021向我们走来
【医悦汇】保持传统
诚邀肿瘤领域大咖
推出新年特辑【年度盘点】
总结盘点2020年度肿瘤学科进展
以字为媒,以言为镜
汇集和解读属于肿瘤学者的2020
第20期

北京大学肿瘤医院胃肠肿瘤中心 武爱文教授
北京大学肿瘤医院胃肠肿瘤中心 陈楠
2020年度结直肠癌外科治疗领域进展
特邀专家

盘点2020年度结直肠癌外科治疗领域进展
2020年的结直肠癌外科治疗领域进展颇多,笔者从临床实践的角度,以外科医师的视角,盘点笔者认为重要的进展,以飨读者。
主要包括:COVID-19对结直肠癌疾病治疗策略的影响;直肠癌新辅助的进展;结直肠癌手术进展;辅助化疗进展。
1 COVID-19对结直肠疾病治疗策略的影响
客观讲,对整个全球结直肠癌外科治疗影响最大的莫过于COVID-19。2020年初的新冠疫情给世界范围内带来了巨大变化,也为结直肠癌的全程管理带来了前所未有的挑战。由于防疫措施包括限制人员流动、医疗资源短缺、医疗防护加强等诸多因素,导致结直肠癌诊断治疗过程的各个环节都收到不同程度的影响,诊断迟滞,手术延后甚至停滞,围手术期治疗延迟或方案改变[1]。值得注意的是,COVID-19蔓延期间带来的就医及诊治模式的改变或将长期存在。在两难的情况下,更多的患者选择接受术前治疗(新辅助放疗、放化疗或化疗)而延后手术,新辅助放疗短程方案显示出优势[2],居家口服药物方案更为普遍,远程医疗模式成为就诊的重要部分。2 直肠癌新辅助的进展
2020年是结直肠癌新辅助治疗史上的重要节点。全程新辅助治疗、等待观察策略、新辅助免疫治疗等结果可圈可点(见表1)。
2020年多项针对局部进展期直肠癌的新辅助治疗研究结果公布。全程新辅助治疗(TNT)治疗模式成为最受关注的话题之一。笔者总结全程新辅助治疗的几大优势:TNT化疗前移显著提高全身治疗完成度,增加了术前治疗的强度;TNT高治疗强度提高了pCR的比例;TNT提升了肿瘤退缩程度,显著提升了cCR比例,为等待观察(Wait & Watch,W&W)策略提供了临床可行性;TNT模式研究可能降低了复发转移率,改善肿瘤学生存。
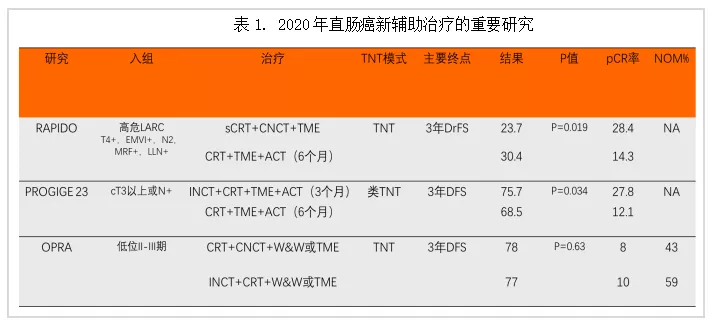
注:TNT:全程新辅助治疗;LARC,局部进展期直肠癌;EMVI:壁外血管侵犯;MRF:直肠系膜筋膜;LLN:侧方淋巴结;CRT:同步放化疗;SCRT:短程放疗;ACT:辅助化疗;INCT:诱导化疗;CNCT:巩固化疗;TME:全直肠系膜切除术;W&W:等待观察;DrFS:疾病相关治疗失败率;DFS:无病生存;pCR:病理完全缓解;NOM:非手术治疗。RAPIDO
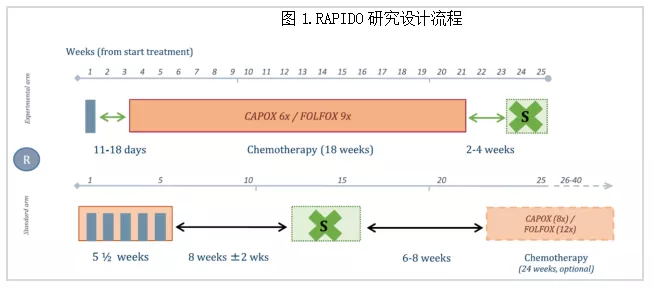
国际多中心Ⅲ期临床试验,旨在研究短程放疗(SCRT)后延迟手术联合巩固化疗能否在不影响局部控制的情况下降低全身复发的风险(见图1)。研究入组高分辨率MRI评价为高危转移复发的局部进展期直肠癌(LARC)。核心结果:试验组和对照组的病理完全缓解率分别为27.7%和13.8%(P<0.001);3年相关治疗失败率(Disease-related Treatment Failure,DrTF)分别为23.7%和30.4%(P=0.02);3年远处转移率和局部复发率分别为19.8% vs 26.6%(P=0.004)和8.7% vs 6.0%(P=0.10);两组患者的总体健康状况、生活质量和前切除综合征评分无明显差异[3]。
研究评述
第一大亮点:短程放疗的TNT联合方案获得总生存获益。从新辅助放疗方案的选择角度,短程相比于长程,肿瘤退缩不明显,短程联合延迟手术(Stockholm III)虽然能获得与长程类似的肿瘤退缩,但放疗-手术间期延长带来潜在的复发转移风险成为短程放疗的短板[4];而RAPIDO研究在获得较高pCR率的同时,提高了生存。第二大亮点:本研究用MRI筛选高危LARC患者作为研究对象,因此在研究结果的临床意义解读中,我们应该看到,直肠癌的危险分层是精准治疗的前提,基于危险分层的优化治疗选择才是未来临床研究的关键切入点。第三大亮点:短程放疗联合化疗可能成为未来治疗的方向;与长程放疗相比,短程放疗花费低,患者治疗周期短,符合卫生经济学高效低费原则。
PRODIGE 23
是一项多中心Ⅲ期临床试验,旨在研究在传统新辅助放化疗(CRT)之前应用诱导三药(mFOLFIRINOX)方案对LARC患者安全性和生存的影响(图2)。研究结果:研究组和对照组对新辅助治疗的耐受性均良好(三药诱导化疗组91.6%患者完成6周期的计划治疗,3-4度毒性发生率包括中性粒细胞减少(16.9%)、腹泻(11.1%)、疲乏(7.1%)、恶心和呕吐(6.2%和4.9%);中位随访46.5个月,研究组3年无病生存(DFS)显著优于对照组(75.7% vs 68.5%,HR=0.69,P=0.034);3年无转移生存(MFS)也明显优于对照组(78.8% vs 71.7%,HR=0.64,P<0.02);3年总生存(OS)有优于对照组的趋势(90.8% vs 87.7%, HR=0.65,P=0.077)[5]。
研究评述
1. 本研究应归为“类TNT”新辅助治疗,提高了诱导化疗的强度(加入伊立替康),三药的安全性和术后并发症发生率无显著性差异,提示目前肠癌的三种常见药物(氟尿嘧啶,奥沙利铂,伊立替康)组合在围手术期具有良好的安全性。2. 严格的说,PRODIGE 23仍属于“三明治(新辅助+手术+术后)”治疗策略,术后辅助治疗3-4度毒性发生率对照组也全面高于研究组,提示化疗前移患者完成度更好。3. 本研究入组人群包含复发转移低风险患者(高位,T3,MRF-等),而对低复发转移风险患者,强力三药治疗是否过度仍值得商榷。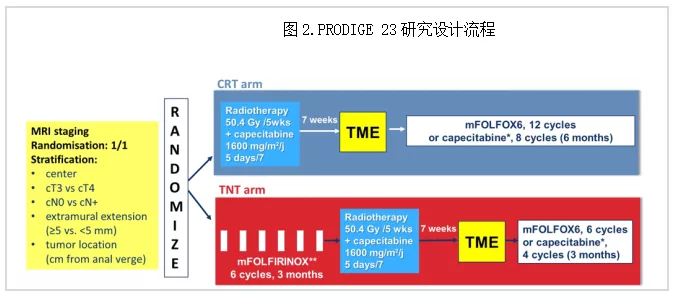
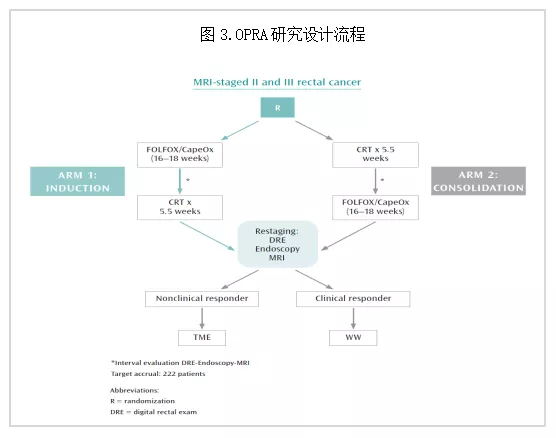
OPRA
来自美国斯隆凯瑟琳癌症中心的是一项随机多中心II期临床研究。旨在评估TNT后全系膜切除术(total Mesenchymal Excision,TME)或WW治疗较常规新辅助治疗后手术是否改善进展期直肠癌患者无病生存时间(Disease Free Survival,DFS)(图3)。研究结果:中位随访时间是2.1年,主要终点DFS方面,常规新辅助治疗后手术组、巩固组、诱导组DFS分别为75%、77%、78%。而次要终点方面,巩固化疗3年器官保留率显著高于诱导组(58% vs 43%,p = 0.01),而化疗耐受度类似、无远处转移生存率相近(83% vs 81%)[6]。
研究亮点
1. 筛选人群为低位-中低危患者:直肠新辅助放化疗的指征一直以来都被定义为cT3以上或cN+患者,对于低位早期患者(I-II期)则建议直接APR手术。OPRA研究率先实现了被动性W&W向主动性W&W的转变。低位患者应尽量暴露在强力治疗下,尽可能争取cCR和W&W,从而避免不保肛手术。2. 对于W&W组患者,长期随访证明在DFS方面甚至优于现有指南的治疗方式(根治性手术);3. 针对新辅助放化疗化疗和放疗的时间安排,巩固还是诱导问题,该研究提供了相对高级别的证据,应用巩固化疗的TNT方案器官保留率更高;4. 该研究的不足,对照组为回顾性队列,证据级别相对有限。
从2020年直肠癌新辅助治疗的研究看,直肠癌的治疗已经进入TNT时代,同时功能保留的需求引领肿瘤非手术治疗的潮流。TNT的方案显著提升了pCR的比例(从传统CRT的15-20%,到TNT时代的近30%左右),从传统的长程放疗联合放疗,向短程放疗和强化化疗这两个趋势演变;未来的研究势必会集中于基于核磁分层基础上的短程放疗联合不同化疗方案,及TNT方案中优化的放疗和化疗组合等方面;此外,方兴未艾的免疫治疗与短程放疗的协同作用可能是另一个改变直肠癌综合治疗的方向。另一方面,患者保肛基础上的功能需求日益突出,这要求结直肠外科医生在精进低位保肛技术的前提下,更新理念,大胆尝试,对于新辅助治疗后临床完全缓解(cCR)患者尝试W&W策略。OPRA研究在新辅助治疗的背景下,探索了低位直肠癌患者非手术治疗的可行性及长期肿瘤学安全性。2020年基于中国人群的直肠癌“等待+观察”数据库(CWWD)成立、中国W&W专家共识及相关的伦理问题的专家意见都为W&W探索奠定了坚实的基础。
结肠癌的术前新辅助治疗
结肠癌的新辅助治疗在过去的10年一直处于探索阶段,且其临床意义仍饱受争议。迄今为止全球最大型的III期对照研究FOxTROT(奥沙利铂为基础新辅助化疗对比直接手术)于2020年公布长期生存结果[7]:1. 主要研究终点(2年肿瘤无复发转移率)虽有降低趋势,但并无统计学差异(17.2%对比13.6%,HR=0.75,P=0.08),在亚组分析中,左半结肠癌[HR=0.58(95%CI:0.38-0.91)]、T4肿瘤[HR=0.59(95%CI:0.35-1.00)]、pMMR群体[RR=0.72(95%CI:0.52-1.00)]可从新辅助化疗中获益;2. 新辅助化疗提高了外科的R0切除率(88.9%提高到95.2%,P=0.001);3. 靶向药物EGFR(表皮生长因子受体)单抗帕尼单抗加入化疗不能给KRAS野生型结肠癌带来更多获益;4. dMMR(错配修复功能缺失)/MSI-H(高度微卫星不稳定)结肠癌患者,不能从新辅助化疗中获益。
临床意义解读
对可切除局部进展期结肠癌,标准的临床实践依然还是直接手术;新辅助化疗仍属研究范畴。对于一些特殊临床情况如无法扩大手术切缘的特殊/困难部位及左半结肠癌的患者,可在排除dMMR前提下选择术前新辅助化疗,以期获得R0切除机会。
早中期结直肠癌新辅助免疫治疗
荷兰的NICHE研究探索了MSI-H型早中期结直肠癌患者新辅助免疫治疗的临床意义[8]:对临床分期I-III期的患者,术前给予两个剂量的纳武利尤单抗和1个剂量的伊匹木单抗,20例MSI-H病例的客观缓解率(ORR)为100%,其中60%(12/20)达到pCR;此外,在错配修复基因完整(pMMR)患者,同样有27%可在免疫治疗后获得良好的反应。综合现有研究,MSI-H型结直肠癌均属于免疫检查点抑制剂治疗的优势人群,在次领域,免疫治疗未来极有可能替代现有的传统治疗模式。而对于MSS型结直肠癌,如果提高此类患者对免疫治疗的反应,成为位于研究的方向。
3 结直肠癌手术进展
2020年结直肠癌手术方面的进展不多,集中在几个话题:1. 在世界范围内TaTME受到质疑的时候,中国TaTME联盟的登记数据库汇报了中国TaTME从无到有的历程,协作组发布了中国TaTME手术专家共识,TaTME已从“大跃进”向“肿瘤学-功能学”满意的标准发展;2. 肖毅教授牵头的腹腔右半结肠淋巴结清扫(D2 v.s.D3)研究的安全性在Lancet oncology发表。
结直肠癌辅助化疗的进展
2020年IDEA研究团队更新5年总生存(OS)的数据:CapOx化疗对比3个月,5年OS率仅提高0.4%(82.8% v.s. 82.4%),而3个月治疗毒性却显著下降了2-6倍。虽然统计学上OS的非劣效性不能达成,但在足够大的样本和足够长的随访已给出了辅助化疗究竟做多久的明确答案,即仅高危III期且接受FOLFOX方案化疗的患者,3个月疗程的5年OS率较6个月疗程减少2.8%,超出了临床可接受的预期,其他情况(低危III期,CapOx化疗方案)3个月化疗的均不影响生存[9]。对于那些不愿意损失1%-2%生存获益的少数患者,或需要接受FOLFOX化疗的患者,则依然推荐6个月的化疗。后IDEA时代的结肠癌辅助化疗,还存在很多悬而未决的问题,随着精准医学理念和新的生物分子标志物发现,个体化辅助化疗已不在是天方夜谭;未来免疫评分、ctDNA等新的标志物可能成为我们解开结肠癌复发转移这个谜团的新钥匙。
小结
对于可治愈性肠癌,疫情给肿瘤患者的全程管理提出了新的挑战,在防疫抗疫背景下,外地患者更多选择本地治疗,肿瘤专科医院如何在病源改变的背景下,精细化管理患者,提高患者满意度,保证医疗的质量就成为医疗卫生行政领域的突出问题。2020年过去了,疫情给全世界带来了很多不可逆,但结直肠肿瘤的发展仍将继续。2021年,我们在路上。参考文献
1. O'Leary, M.P., et al., Management Considerations for the Surgical Treatment of Colorectal Cancer During the Global Covid-19 Pandemic. Ann Surg, 2020. 272(2): p. e98-e105.
2. Mirnezami, R., et al., Preoperative radiotherapy for locally advanced rectal cancer during and after the COVID-19 pandemic. Br J Surg, 2020. 107(8): p. e263.
3. Bahadoer, R.R., et al., Short-course radiotherapy followed by chemotherapy before total mesorectal excision (TME) versus preoperative chemoradiotherapy, TME, and optional adjuvant chemotherapy in locally advanced rectal cancer (RAPIDO): a randomised, open-label, phase 3 trial. Lancet Oncol, 2021. 22(1): p. 29-42.
4. Erlandsson, J., et al., Tumour regression after radiotherapy for rectal cancer - Results from the randomised Stockholm III trial. Radiother Oncol, 2019. 135: p. 178-186.
5. Conroy, T., et al., Total neoadjuvant therapy with mFOLFIRINOX versus preoperative chemoradiation in patients with locally advanced rectal cancer: Final results of PRODIGE 23 phase III trial, a UNICANCER GI trial. 2020. 38(15_suppl): p. 4007-4007.
6. Garcia-Aguilar, J., et al., Preliminary results of the organ preservation of rectal adenocarcinoma (OPRA) trial. 2020. 38(15_suppl): p. 4008-4008.
7. Seymour, M.T., D. Morton, and o.b.o.t.I.F.T. Investigators, FOxTROT: an international randomised controlled trial in 1052 patients (pts) evaluating neoadjuvant chemotherapy (NAC) for colon cancer. 2019. 37(15_suppl): p. 3504-3504.
8. Chalabi, M., et al., Neoadjuvant immunotherapy leads to pathological responses in MMR-proficient and MMR-deficient early-stage colon cancers. Nat Med, 2020. 26(4): p. 566-576.
9. Andre, T., et al., Effect of duration of adjuvant chemotherapy for patients with stage III colon cancer (IDEA collaboration): final results from a prospective, pooled analysis of six randomised, phase 3 trials. Lancet Oncol, 2020. 21(12): p. 1620-1629.