中国抗癌协会
立即下载App盘点2020 | 邵宗鸿教授:2020年度再障治疗领域研究进展

一个年度的盘点,也是下一个年度的起点
酸甜交错的2020离我们远去
充满期盼的2021向我们走来
【医悦汇】保持传统
诚邀肿瘤领域大咖
推出新年特辑【年度盘点】
总结盘点2020年度肿瘤学科进展
以字为媒,以言为镜
汇集和解读属于肿瘤学者的2020
第17期

天津医科大学总医院 邵宗鸿教授
2020年度再障治疗领域研究进展
特邀专家

盘点2020年度再障治疗领域研究进展
经过一个多世纪的研究,再生障碍性贫血(aplastic anemia,AA)作为骨髓衰竭症(bone marrow failure, BMF)的“总称”已逐渐被解析,以造血细胞质异常为特征的骨髓衰竭症(如MDS、PNH、CCUS等)已被赋予新名称而从BMF中出局,体液免疫异常相关的骨髓衰竭症因对CD20单抗反应好也被识别,若再除外了ICUS,AA目前被认为是一种由T淋巴细胞功能亢进所导致的骨髓造血功能衰竭症,主要表现为:外周全血细胞减少,骨髓造血功能低下(图1)。临床上可出现因血细胞减少而导致的各种症状,如贫血、感染和出血,严重时危及患者生命。我国AA的年发病率为0.74/10万人口,可发生于各年龄段,有两个发病高峰,分别为15~25岁的青少年和60岁以上的老年。
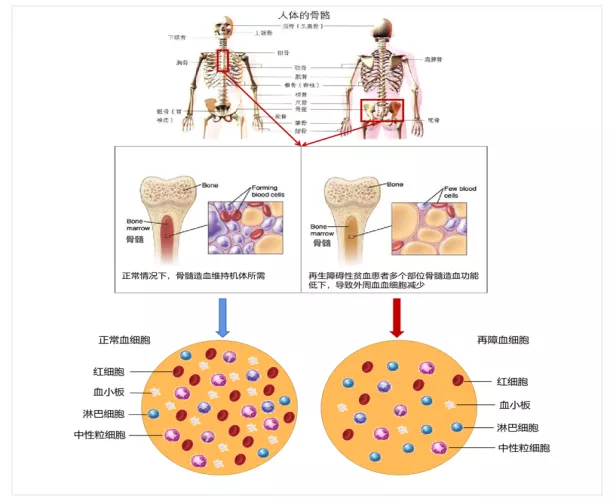
图1. 再生障碍性贫血患者多个部位(胸骨、髂骨)骨髓造血功能低下,骨髓腔内造血细胞被非造血细胞及脂肪细胞所替代,导致外周血细胞减少,淋巴细胞比例升高
1 再生障碍性贫血的发病机制
欲了解AA的治疗需首先了解AA的发病机制。总结前人研究发现:在某种或某些未知抗原刺激下,mDC持续向T细胞提供刺激信号,导致辅助性T细胞I型(Th1)、细胞毒T淋巴细胞(CTL)过度增殖、活化,Treg、NK等细胞调节功能不足,CTL持续攻击骨髓造血细胞,导致造血细胞凋亡增加,骨髓衰竭、全血细胞减少(图2)[1,2]。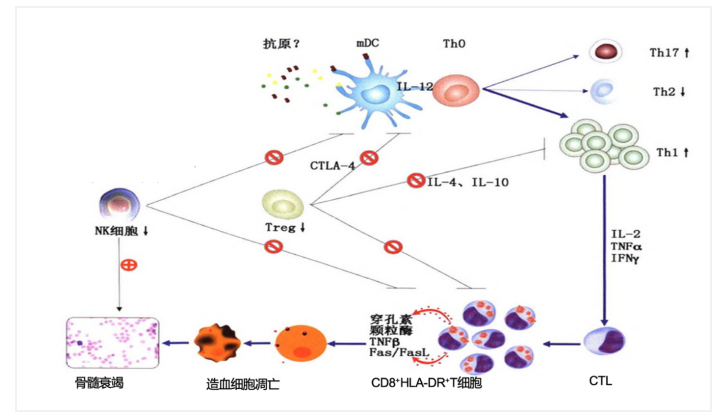
图2. 再生障碍性贫血的发病机制[1]因此,临床上治疗SAA的策略主要为“一压、一促、一保护”,“一压”为压制异常活化的细胞毒T细胞(CTL),核心为免疫抑制(IST)治疗;“一促”为促造血治疗,主要指各种造血刺激因子的治疗;“一保护”为隔离保护及输血支持治疗,主要指在应用免疫抑制治疗或造血干细胞移植治疗前及过程中把患者充分隔离保护起来,避免出现严重的感染,避免各种危及生命的出血、贫血性脏器功能损伤。本文将梳理AA的治疗核心框架并对2020年再障领域的新进展进行总结。
2
再生障碍性贫血的治疗
2.1针对CTL的治疗目前临床上,强效免疫抑制治疗仍然是40岁以上SAA患者或40岁以下无HLA同胞相合供者(MRD)的SAA患者的首选治疗方案。抗胸腺/淋巴细胞球蛋白(ATG/ALG)联合环孢素(CsA)可使SAA总反应率接近70%[1,2]。ATG使用疗程一般为5天,无明确治疗年龄上限。环孢素是治疗SAA的经典药物,主要通过抑制IL-2合成和释放,抑制T细胞的生长和功能,起到治疗AA的效果。临床上多数患者对ATG/ALG联合CsA方案耐受度良好,对少数不能耐受CsA患者也可换用雷帕霉素治疗。CsA应使用足疗程,避免过早停药出现复发。2.2针对造血细胞的治疗 SAA骨髓造血细胞与T淋巴细胞的交叉培养实验发现,SAA患者的骨髓细胞离开自身T淋巴的干预可分化出正常造血集落,因此认为SAA骨髓造血细胞自身不存在异常。然而, 部分研究机构发现SAA患者的“种子”也是存在异常的。如:G带法检测发现约20%AA患者存在染色体核型改变[5];SAA患者高比例出现非随机X染色体失活异常以及端粒缩短的现象[6-8];全基因组关联研究发现HLA-DPB1是SAA重要危险因素[9];二代测序技术证实AA患者高频出现某些基因突变,如:PIGA,BCOR \BCORL1,DNMT3A,ASXL1,而这些基因与SAA疾病进展及IST治疗反应密切相关[10],因此对40岁及以下MRD的SAA患者仍提倡早期造血干细胞移植治疗,5年总生存率约60%。年龄>40岁患者尚无明确治疗优势[11]。也有学者呼吁既然SAA已不再是几十年前的混杂“综合征”,此部分有质异常的BMF应从AA中剔除。虽然2020年ASH报道了欧洲骨髓移植协作组的结果,AA患者移植后5年总生存率可达75%[12]。然而,对于那些年龄<40岁无MRD的SAA患者,还应首选IST治疗。若患者年龄<20岁,虽无MRD但已找到无关供者(MUD)的SAA患者,需充分评价移植风险进行移植。对于难治复发SAA患者,有报道脐血移植1年OS可达88.5%,欧洲骨髓移植协作组(EBMT)回顾性分析显示脐血移植7年OS可达87.9%,急性GVHD15.2%,慢性GVHD14.5%[13]。因此对于难治复发患者,脐带血移植也可作为后备选择。2.3 促造血治疗 促造血治疗既可以通过直接作用在造血细胞表面相关分子受体上直接发挥促进“种子”生长的作用,也可以通过调节骨髓造血微环境,起到改善“土壤”的作用。现临床上应用的造血生长因子主要包括重组人促红细胞生成素(EPO)、粒细胞集落刺激因子(G-CSF)、粒单细胞集落刺激因子(GM-CSF)、重组人白细胞介素-11(IL-11)、重组人血小板生长因子(rhTPO)及小分子血小板受体激动剂(TPO-RA)提升血小板的数量。其中,G-CSF、GM-CSF的应用可以降低AA患者的早期感染发生率和住院天数[14,15]。TPO及TPO-RA的使用可提高病人的血液学缓解率及促进骨髓造血恢复。2020年最耀眼的SAA治疗非血小板生成素受体激动剂(TPO-RA)莫属。艾曲波帕,是一种口服TPO-RA,可与TPO-R的跨膜区结合,他不与内源性TPO竞争而是发挥协同作用,持续活化下游信号通路,显著增加巨核细胞的生成(图3)[16]。近期研究还显示艾曲波帕能特异性扩增SAA患者多能造血祖细胞,且对长期输血依赖的SAA患者起到祛铁治疗的作用[17,18]。美国国立卫生研究院(NIH)报道了艾曲波帕在初治SAA中的疗效:将初治应用IST(hATG+CsA)的SAA患者按照联合艾曲波帕的计量和时间不同分为3组,评价6个月疗效,结果发现,IST联合艾曲波帕较历史单用IST组疗效显著提高,且从IST第1天起持续应用艾曲波帕优于IST后14天开始使用艾曲波帕,总有效率(ORR)可达94%。同样地,另一项III期随机对照临床试验RACE结果显示,IST(hATG+CsA)联合艾曲波帕治疗初治SAA患者较单用IST治疗3个月时的完全缓解率(CR)明显提高至21.9%。此外,艾曲波帕在难治性AA患者的治疗中也取得了令人鼓舞的疗效[19,20],Thomas等人[21]最新研究显示延长艾曲波帕给药时间至6个月可挽救部分在3个月时无反应的难治性SAA患者的治疗效果。近期对艾曲波帕机制研究显示,艾曲波帕不仅可以刺激骨髓祖细胞向巨核细胞分化和增殖,促进血小板的生成,还有促进多能造血祖细胞的扩增作用[22]。与生理状态的TPO相比,TPO-RA作用于TPO-R的跨膜区,持续活化下游的信号通路,且不与体内内源性TPO竞争。AA患者血浆中存在高水平的IFN-γ, 后者与TPO结合成为异源二聚体,阻止TPO作用于TPO-R, 因此AA患者即使体内存在高水平的TPO也难以充分发挥作用。艾曲波帕不与IFN-γ相结合,也就克服了干扰素对TpoR的抑制作用[23]。此外,2020年ASH还报道了艾曲波帕有促进骨髓衰竭症患者铁蛋白代谢的作用,这种祛铁作用与铁螯合剂的作用相当,因此对于铁过载的SAA患者应用艾曲波帕治疗可谓一举多得[24]。除艾曲波帕外,罗米司亭也同属TPO-RA,相比之下,罗米司亭在AA中治疗的相关研究数据要明显少于艾曲波帕,疗效有待一步评估。
图3. 艾曲波帕与TPO作用位点不同,从而导致产生巨核细胞的能力不同[[25]
2.5 雄激素在治疗AA患者中的地位
雄激素作为最古老的促造血治疗药物,仍然占据着他不可或缺的地位。端粒是染色体末端的一段保护性DNA序列,随着细胞分裂,端粒会随之缩短,端粒酶能够帮助端粒延长使之维持在一定范围之内。近期研究发现AA患者存在端粒缩短的现象,且端粒缩短预示着AA患者IST治疗效果欠佳,可能与端粒酶活性减低有关。雄激素除了有刺激骨髓造血的作用以外,还可以增加端粒酶基因的表达,延长患者端粒长度,起到治疗AA的效果[26]。
3 总结
AA是一个T细胞介导的骨髓衰竭性疾病,目前对40岁以下有同胞相合供体的患者,可选择造血干细胞移植治疗。对于40岁以上患者及无同胞相合供体的SAA患者,IST治疗仍作为首选治疗方案。促造血治疗与IST可以发挥相得益彰的效果,能降低患者感染率及住院时间,促进AA患者早期血细胞恢复。艾曲波帕的加入进一步提升了IST的疗效,有望提升患者生存时间及生存质量。然而,对SAA研究的脚步还没有停止,一旦倒找诱发SAA的始动抗原,针对SAA的治疗将更加精准有效。参考文献:
1. Liu C, Sun Y, Shao Z. Current Concepts of the Pathogenesis of Aplastic Anemia. Curr Pharm Des. 2019;25(3):236-241.
2. Brzeźniakiewicz-Janus K, Rupa-Matysek J, Gil L. Acquired Aplastic Anemia as a Clonal Disorder of Hematopoietic Stem Cells. Stem Cell Rev Rep. 2020 Jun;16(3):472-481.
3. Scheinberg P, Nunez O, Weinstein B, et al. Horse versus rabbit antithymocyte globulin in acquired aplastic anemia. N Engl J Med. 2011;365:430–8.
4. Frickhofen N, Heimpel H, Kaltwasser JP, et al. Antithymocyte globulin with or without cyclosporin A: 11-year follow-up of a randomized trial comparing treatments of aplastic anemia[J]. Blood, 2003,101(4):1236-42.
5. Mortazavi Y, Chopra R, Gordon-Smith E C, Rutherford T R. Clonal patterns of X-chromosome inactivation in female patients with aplastic anaemia studies using a novel reverse transcription polymerase chain reaction method [J]. Eur J Haematol, 2000, 64(6): 385-395.
6. Wang T, Mei SC, Fu R, Wang HQ, Shao ZH. Expression of Shelterin component POT1 is associated with decreased telomere length and immunity condition in humans with severe aplastic anemia. J Immunol Res. 2014;2014:439530.
7. Park HS, Park SN, Im K, et al. Telomere length and somatic mutations in correlation with response to immunosuppressive treatment in aplastic anaemia. Br J Haematol. 2017 Aug;178(4):603-615.
8. Martínez P, Blasco MA. Telomere-driven diseases and telomere-targeting therapies. J Cell Biol. 2017 Apr 3;216(4):875-887.
9. Savage SA, Viard M, O'hUigin C, et al. Genome-wide Association Study Identifies HLA-DPB1 as a Significant Risk Factor for Severe Aplastic Anemia. Am J Hum Genet. 2020 Feb 6;106(2):264-271.
10. Yoshizato T. Chronologic analysis of clonal evolution in acquired aplastic anemia and sMDS. Rinsho Ketsueki. 2016 Apr;57(4):430-9.
11. Iftikhar R, Chaudhry QUN, Anwer F, et al. Allogeneic hematopoietic stem cell transplantation in aplastic anemia: current indications and transplant strategies. Blood Rev. 2020 Oct 31:100772.
12. Raynier Devillier et al. Gvhd and Relapse Free Survival (GRFS) after Allogeneic Transplantation for Idiopathic Severe Aplastic Anemia: An Analysis from the Saawp Data Quality Initiative Program of EBMT. 62th ASH annual meeting and exposition, poster #1852.
13. Pagliuca S, Peffault de Latour R, Volt F, et al. Long-Term Outcomes of Cord Blood Transplantation from an HLA-Identical Sibling for Patients with Bone Marrow Failure Syndromes: A Report From Eurocord, Cord Blood Committee and Severe Aplastic Anemia Working Party of the European Society for Blood and Marrow Transplantation. Biol Blood Marrow Transplant. 2017 Nov;23(11):1939-1948.
14. Tichelli A, Schrezenmeier H, Socie G, et al. A randomized controlled study in patients with newly diagnosed severe aplastic anemia receiving antithymocyte globulin (ATG), cyclosporine, with or without G-CSF: a study of the SAA Working Party of the European Group for Blood and Marrow Transplantation. Blood. 2011;117(17):4434-4441.
15. Dufour C, Svahn J, Bacigalupo A, Severe Aplastic Anemia-Working Party of the E. Front-line immunosuppressive treatment of acquired aplastic anemia. Bone Marrow Transplant. 2013;48(2):174-177.
16. Kovtonuyk LV, Manz MG, Takizawa H. Enhanced thrombopoietin but not G-CSF receptor stimulation induces self-renewing hematopoietic stem cell divisions in vivo. Blood. 2016;23:127.3175-9.
17. Oliveira et al. Eltrombopag Specifically Expands Hematopoietic Multipotent Progenitors in Human Aplastic Anemia. 62th ASH annual meeting and exposition, poster #932.
18. David J Young et al. Long-Term Eltrombopag for Bone Marrow Failure Depletes Total Body Iron. 62th ASH annual meeting and exposition, poster #1688.
19. Townsley DM, Scheinberg P, Winkler T, et al. Eltrombopag Added to Standard Immunosuppression for Aplastic Anemia. N Engl J Med. 2017;376(16):1540-1550.
20. Desmond R, Townsley DM, Dumitriu B, et al. Eltrombopag restores trilineage hematopoiesis in refractory severe aplastic anemia that can be sustained on discontinuation of drug. Blood. 2014;123:1818-25.
21. Winkler T, Fan X, Cooper J, et al. Treatment optimization and genomic outcomes in refractory severe aplastic anemia treated with eltrombopag. Blood. 2019 Jun 13;133(24):2575-2585.
22. Oliveira, et al. Eltrombopag Specifically Expands Hematopoietic Multipotent Progenitors in Human Aplastic Anemia. 62th ASH annual meeting and exposition, poster #932.
23. Alvarado LJ, Huntsman HD, Cheng H, et al. Eltrombopag maintains human hematopoietic stem and progenitor cells under inflammatory conditions mediated by IFN-γ. Blood. 2019 May 9;133(19):2043-2055.
24. David Young, et al. Long-Term Eltrombopag for Bone Marrow Failure Depletes Total Body Iron. 62th ASH annual meeting and exposition, poster #1688.
25. Hana Raslova , William Vainchenker, Isabelle Plo, Eltrombopag, a potent stimulator of megakaryopoiesis, Haematologica. 2016 Dec;101(12):1443-1445.
26. Townsley DM, Dumitriu B, Liu D, et al. Danazol Treatment for Telomere Diseases. N Engl J Med. 2016 May 19;374(20):1922-31.