中国抗癌协会
立即下载App盘点2020 | 黄晓军教授:2020年度白血病治疗进展

一个年度的盘点,也是下一个年度的起点
酸甜交错的2020离我们远去
充满期盼的2021向我们走来
【医悦汇】保持传统
诚邀肿瘤领域大咖
推出新年特辑【年度盘点】
总结盘点2020年度肿瘤学科进展
以字为媒,以言为镜
汇集和解读属于肿瘤学者的2020
第14期

北京大学血液研究所 黄晓军教授
2020年度白血病治疗进展
特邀专家

盘点2020年度白血病治疗进展
白血病是严重危害人民健康的重大疾病,死亡率高,治疗难度大。治疗手段主要包括:化疗、造血干细胞移植(HSCT)与细胞治疗、靶向治疗等,2020年白血病的治疗获得了显著进步。
1 初治急性髓性白血病(AML)进展
1. 靶向药物的应用,使初治尤其是老年AML疗效显著提高:
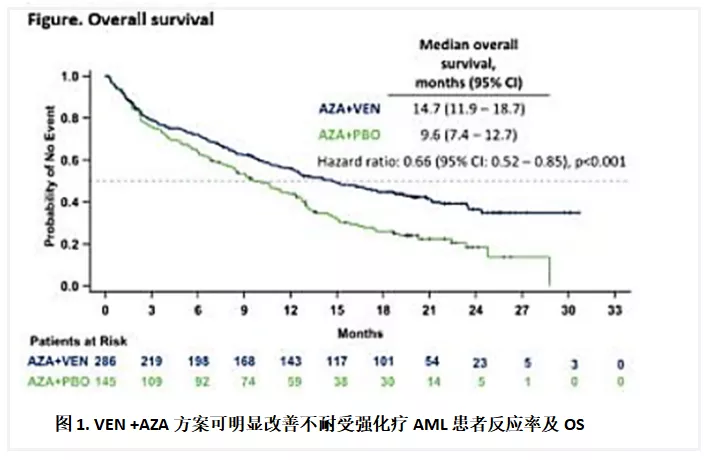
(1) AML患者中位诊断年龄68岁,老年患者居多,既往因不能耐受强化疗和HSCT而预后较差,Je-Hwan L等总结22个国家真实世界研究提示该群患者中位总生存期(OS)仅7.0个月,完全缓解(CR)+血细胞计数未完全恢复的CR(CRi)仅23%,亟需创新诊疗方案[1]。靶向药物为代表的创新诊疗方案显著改善该群患者预后。BCL-2抑制剂(Venetoclax,VEN)是一种具有广泛抗肿瘤活性药物,联合去甲基化药物如阿扎胞苷(AZA)日渐成为AML治疗重要方案之一:DiNardo C 等[2]报道了一项随机、双盲、多中心、安慰剂对照的Ⅲ期临床,431例初治且不耐强化疗的AML患者, VEN+AZA组中位OS 显著延长:14.7月 vs. 5.1月,总缓解率显著提高:66.4% vs. 28.3%(图1)。
基于近年研究结果,2020年8月美国血液病学会发布了初治老年AML治疗指南[3],对于新诊断的老年AML患者给出了具体建议,根据患者耐受情况,给出了能治疗尽量治疗、能强化疗尽量强化疗、低强度治疗缓解后尽量无限期继续治疗等建议。
(2) 直接靶向AML突变,如IDH1、FLT3等进一步丰富初治AML治疗:IDH2抑制剂(Enasidenib,ENA):Courtney DiNardo等[4]报道了IDH2突变的101名新诊断AML患者, ENA+AZA组显著优于对照AZA单药组: ORR 71% vs 42%,CR 53% vs 12%,中位DOR为24.1 vs 12.1月。IDH1抑制剂(Ivosidenib,IVO):DiNardo C 等报道[5]一项评价IVO+VEN±AZA治疗IDH1突变AML Ib/II期临床试验,耐受性好,疗效显著,可使患者获得90%的ORR率及50%微小残留病(MRD)阴性率, AZA+IVO+VEN队列比IVO+VEN队列达到更高的MRD阴性率。FIT3-ITD抑制剂索拉非尼:Andrew H Wei等报道[6,7]FIT3-ITD+初治AML随机、双盲对照II期临床,比较强化疗联合索拉非尼或安慰剂疗效:2组ORR均大于90%,但在FIT3-ITD高表达组,索拉非尼组获益更多,能提高CR患者的RFS,复发后索拉非尼组2年OS有延长趋势(37% VS.12%)。
2. 免疫治疗用于初治急性白血病:
(1) CD47单抗(Magrolimab):可阻断关键巨噬细胞检查点,David A. Sallman等[8]报道Ib期研究结果,52例不耐强化疗的初治AML接受Magrolimab+AZA治疗,中位年龄73岁,耐受性良好,在TP53突变型AML中,CR达71%,中位OS 12.9个月。
(2) CD22单抗(inotuzumab ozogamicin,InO):Matthias Stelljes等[10]报道德国多中心ALL研究组(GMALL)的开放标签II期研究,31例新诊断>55岁的B-ALL,中位年龄64(56-80)岁,InO联合地塞米松诱导治疗,17/23例在诱导后MRD转阴,1年OS为82.4%。(3) CD3-CD19双特异性抗体(贝林妥欧单抗,Blinatumomab,Blina):一项II期临床结果显示[11],Blina+达沙替尼用于成人Ph+ALL的巩固,第2周期治疗结束时,分子学CR高达60%,在随后治疗周期中进一步升至81%。18个月OS和DFS高达95%和88%,提示无化疗ALL治疗新时代的可能。另一项多中心单臂研究结果[12]显示Blina治疗MRD阳性ALL,分子学CR率达67%,68%可进行移植。
2 复发/难治急性白血病(R/R AL)的治疗进展
1. 复发难治AML
(1) 维奈托克+去甲基化药物:A. Maiti等报道[13]在R/R AML中,比较10天地西他滨(DAC)+ VEN和密集化疗的对比分析:DAC+VEN具有更高的 ORR,更长的 EFS 和更好的耐受性。另一项单中心、回顾性研究结果显示,34例R/RAML患者HMA+VEN治疗可达到较高CR率,且为移植提供可能,移植后的患者mOS长达285d。
(2) FLT3抑制剂吉瑞替尼(gilteritinib):一项随机、开放、多中心Ⅲ期临床研究结果[14]:与挽救性化疗相比,吉瑞替尼可使患者获得更长的OS(9.3 VS. 5.6月);无论既往有无TKI治疗,相比于化疗,吉瑞替尼能有效提高CRc率,延长OS。在强预处理过的FLT3突变患者中(65%之前曾暴露于FLT3 抑制剂),吉瑞替尼联合VEN可带来极高CR率(83.8%)。
(3) 其他:一项DAC+PLK1抑制剂(Onvansertib)前瞻性Ib/II期研究、一项抗TIM3抗体(MBG453)+HMA Ib期研究分别显示了在R/R AML中的初步疗效和安全性,CAR-T等新药治疗在R/R AML疗效及安全性还有待进一步验证。
2. 复发难治ALL
(1) CAR-T细胞治疗:
2020年,尤其是我国张曦、周剑锋、黄河、赵明峰等团队在CAR-T治疗R/R ALL报道了一系列进展:如CD7 CAR-T治疗R/R T-ALL、CD19/CD22-CAR-T治疗R/R B-ALL,供者CD19 CAR-T治疗R/R B-ALL,CD19-STAR-T治疗CD19+ R/R B-ALL等均显示出极具前景的疗效和安全性[15-21]。
(2) CD3-CD19双特异性抗体:
一项Ⅰb/Ⅱ期研究报道[22]评估Blina在26名Ph-R/R ALL患者中的疗效,CR/CRh率44.4%,CR/CRh患者中MRD反应为75%,MRDCR为60%;中位OS 11.9月,中位EFS 8.9月。复发难治Ph-B-ALL患者使用Blina是2020年NCCN指南1级推荐。
3 慢性粒细胞白血病(CML)治疗进展
1. T315I突变CML进展:针对T315I突变,中国自主研发三代TKI新药HQP1351(olverembatinib,奥瑞巴替尼)II期临床数据由江倩教授在今年ASH上报告[23]:HQP1351在伴有T315I突变的TKI耐药的慢性期和加速期CML患者中均具有良好的疗效及耐受性。2. 新型TKI进展:目前已上市的TKI,是通过与BCR-ABL1蛋白的ATP结合位点结合,新药asciminib是作用于该激酶的另一部分,即ABL肉豆蔻酰口袋(STAMP)发挥作用,可能有助于解决CML后期治疗中的TKI耐药性并可能解决脱靶活性,从而改善患者的预后。III期ASCEMBL研究提示,对至少2种TKI耐药或不耐受的CML,asciminib主要分子学反应率(MMR)几乎较博舒替尼提高一倍(25.5% vs 13.2%)[24]。4 造血干细胞移植(HSCT)治疗白血病进展
造血干细胞移植仍是根治白血病最重要的手段,单倍型“北京方案”使白血病治疗“人人都有供者”的新时代。移植与靶向治疗、细胞治疗等组合,形成了更为强大的创新治疗体系,达到了1+1>2 的疗效。
1. 单倍型造血细胞移植作为急性白血病一线治疗再添新证据:
对年轻成人(18-39岁)标准危险费城染色体阴性ALL(标危ALL),既往被认为是成人ALL中化疗预后最佳群体,全国III期前瞻研究揭示:单倍型移植治疗标危ALL无病生存优于化疗(80.9%vs. 51.1%),支持单倍型移植作为标危ALL巩固一线治疗[25]。
2. 单倍型造血干细胞移植较同胞相合移植发挥更强抗白血病作用:
单倍型移植能否超越同胞相合移植,成为造血干细胞移植首选方式?北大血研所进行遗传学生物随机对照研究,证实单倍型移植较同胞相合移植复发率更低(23% vs. 47%;p=0.006),无病生存(65% vs. 43%,p=0.023)和总生存(68% vs. 46%; p=0.039)更优[26];动物和体外机制试验提示单倍型T细胞和NK细胞均具有更强的抗白血病作用,AML临床队列证明单倍型移植较HLA相合移植更快降低白血病残留,复发率降低[27]。
3. 预防中老年患者急性移植物抗宿主病新方法:
急性移植物抗宿主病(GVHD)是异基因造血干细胞移植后主要并发症之一,尤其是年龄>=40岁中老年患者。全国23家中心随机对照临床试验,提示4.5mg抗胸腺球蛋白(ATG)有效降低移植后II-IV度aGVHD发生率(13.7% vs. 27%),同时改善无GVHD-无复发生存(38.7% vs.24.5%),不增加累积复发率、非复发死亡及感染风险[28]。欧洲骨髓移植学会(EBMT)现任主席Nicolaus Kröger 教授 在JCO撰文专评:本项设计良好的随机对照试验,为造血干细胞移植的理想境界--降低抗宿主病且不影响抗白血病作用提供了良好证据;无复发、无抗宿主病生存对患者意义非凡。
4. 预防急性髓系白血病移植后复发新方法:
FLT3-ITD+ AML预后不良,全国7家血液病中心完成III期随机对照临床试验证明,索拉菲尼维持治疗研究组降低2年复发率分别7.0% vs.24.5%(p=0.0010);改善2年无病生存率78.9% vs. 56.6% 和总生存率82.1% vs. 68.0%[29]。EBMT前主席、白血病研究组现任主席Mohamad Mohty教授Lancet Oncol专评:本研究首次聚焦移植后索拉菲尼预防而非围移植期应用,证实移植后预防可以改善FLT3-ITD+ AML预后而不增加毒性。针对高危AML的全国多中心临床试验提示,粒细胞集落刺激因子联合地西他滨预防可以有效降低2年复发率 15.0% vs. 38.3%,而不增加移植物抗宿主病[30]。综上,2020年白血病的靶向治疗、造血干细胞移植与细胞治疗等均取得了长足进步。未来探索治疗新靶点, 开展新药临床实验, 优化干细胞移植是新时代白血病医生的使命和方向。
参考文献:
1.Je-Hwan L,et al.EHA 2020.Abstract: EP631.
2.DiNardo C,et al.EHA 2020.Abstract: LB2601.
3.Mikkael A. Sekeres, et al. Blood Adv. 2020 Aug 11; 4(15):3528-3549.
4.Courtney DiNardo, et al. 2020 EHA Abstract: S139.
5.DiNardo C,et al.EHA 2020.Abstract: S143.
6.Andrew H Wei, et al. ASH 2020. Abstract 591.
7.Natasha S, et al. ASH 2020. Abstract 272.
8.David A. Sallman, et al. 2020 ASH Annual Meeting, Abstract #330.
9.Matthias Stelljes,et al. 2020 ASH, Abstract #267.
10.Foà R, et al. N Engl J Med 2020;383:1613-23.
11.Nicola Gökbuget, et al. ASH 2020. Abstract 2795.
12.A. Maiti, et al. ASH 2020. Abstract 637.
13.Perl AE et al. 2020ASH: Oral 213. Oral 334. Oral 262. Oral 333.
14.Baruche lA, et al. EHA 2020, Abstract S118.
15.Wang N,Blood. 2020 Jan 2;135(1):17-27.
16.J Hematol Oncol. 2020 May 4;13(1):42.
17.Jing X,Leukemia. 2020 Mar;34(3):909-913.
18.Tan Y, et al. EHA 2020; Abstract EP405.
19.Wang XX, et al. EHA 2020; Abstract S115.
20.Zhang X, et al. ASH 2020; Abstract 270.
21.Hu YX, et al. ASH 2020, Abstract 499.
22.Yukio Kobayashi, et al. EHA 2020; Abstract: EP415.
23.Jiang Q, Huang XJ*, et al. ASH 2020, Abstract #651.
24.Andreas Hochhaus,Blood (2020) 136 (Supplement_2): LBA-4..
25.Lv M,J Hematol Oncol. 2020;13(1):52
26.Chang YJ,J Hematol Oncol. 2020;13(1):27)
27.Guo H, Cell Mol Immunol. 2021 Jan 6.
28.Chang YJ. J Clin Oncol. 2020;38(29):3367-3376.
29.Xuan L,Lancet Oncol. 2020;21(9):1201-1212.
30.Gao L,J Clin Oncol. 2020 Dec 20;38(36):4249-4259.