中国抗癌协会
立即下载App盘点2020 | 马骏教授:2020年度鼻咽癌临床研究进展

一个年度的盘点,也是下一个年度的起点
酸甜交错的2020离我们远去
充满期盼的2021向我们走来
【医悦汇】保持传统
诚邀肿瘤领域大咖
推出新年特辑【年度盘点】
总结盘点2020年度肿瘤学科进展
以字为媒,以言为镜
汇集和解读属于肿瘤学者的2020
第12期

中山大学肿瘤防治中心 马骏教授
2020年度鼻咽癌临床研究进展
特邀专家


盘点2020年度鼻咽癌临床研究进展
中国的鼻咽癌发病率居世界之冠,据世界卫生组织统计,全球近一半的鼻咽癌发生在中国,严重危害我国人民生命健康[1]。放射治疗是初诊非转移鼻咽癌患者的主要治疗方法-早期鼻咽癌患者可接受单纯放射治疗,而局部晚期鼻咽癌患者需在放射治疗基础上联合化疗。对于复发/转移鼻咽癌来说,化疗则是主要的治疗方法。2020年,鼻咽癌在综合治疗方案的优化及个体化随访策略的制定上取得了突破性进展。
1 局部晚期鼻咽癌:精准诱导化疗
同期放化疗为局部晚期鼻咽癌治疗的基石。如何进一步提高疗效一直是研究的焦点。2019年在新英格兰医学杂志上发表的一项大型多中心III期临床试验显示,在同期放化疗基础上联合吉西他滨+顺铂诱导化疗,相较同期放化疗,能有效提高局部晚期鼻咽癌患者3年无进展生存率(85.3% vs. 76.5%, P=0.001)及总生存率(94.6% vs. 90.3%)[2]。另外亦有两项前瞻性随机对照临床研究同年发表远期随访结果,证实诱导化疗可在同期放化疗基础上提高局部晚期鼻咽癌患者的生存[3-4]。基于上述研究成果,目前“诱导化疗联合同期放化疗”这一方案已经被美国NCCN指南采纳,成为局部晚期鼻咽癌的治疗标准。然而,对于诱导化疗无效病人,诱导化疗不仅不能带来生存获益,反而延长治疗时间、徒增化疗毒性。因此,亟需有效指标以筛选诱导化疗无效患者,从而避免无效的治疗。2020年,一项临床试验的后续分析通过构建一套基因标签,成功鉴别出诱导化疗获益组及无获益组。该研究通过对比诱导化疗敏感及抵抗患者的基因表达谱,发现了43个与化疗敏感性相关的基因,构建的基因标签可准确地预测肿瘤对诱导化疗的敏感性(曲线下面积= 0.87,灵敏度= 87.5%,特异性= 75.6%);不敏感患者无法从诱导化疗中获益[5]。这一基因标签的效能亦在独立队列中得到验证。这一基因标签的建立预示着分子指标指导个体化治疗时代的到来。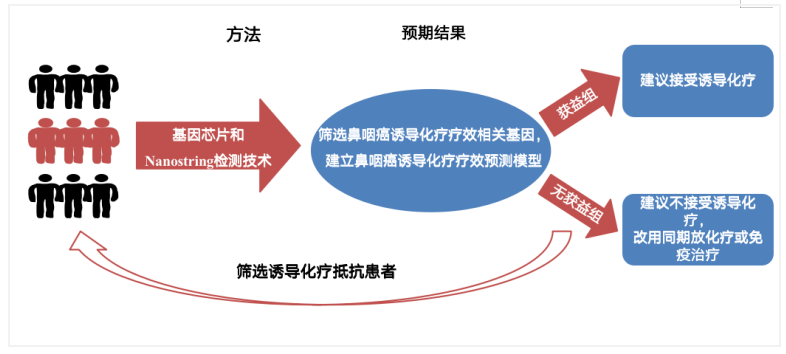
Figure 1.构建的基因标签能够筛选诱导化疗抵抗患者、避免无效治疗。
2 肿瘤患者随访策略的优化
肿瘤患者治疗后如何进行严密随访是早期监测肿瘤复发、提高挽救治疗效果的关键。然而随着随访次数的增加,患者和社会的经济负担也同样加重。因此,最佳的肿瘤随访策略需兼顾随访效果与随访成本,即制定适合患者的随访方案,既能及时监测肿瘤复发,又不盲目增加随访频率从而节约医疗资源。然而,目前肿瘤随访的最佳策略尚未确立,现行的随访方案缺乏必要的循证医学基础。2020年,来自中山大学肿瘤防治中心的一项研究,基于7043例鼻咽癌患者的真实世界大数据,描绘了鼻咽癌治疗后复发风险的动态变化规律,建立了一套可平衡随访效果与时间成本的随访策略,为肿瘤个体化随访的开展提供了依据[6]。该研究首先采用随机生存森林模型,模拟出不同疾病分期患者治疗后的疾病风险动态变化,发现鼻咽癌局部复发的高峰出现在18~24个月,治疗后4~5年亦有相当数量的复发;而远处转移的高峰期在治疗后的12~15个月,3年后出现的迟发性远处转移少见。随后,基于该疾病复发风险规律制定随访频率,即在疾病复发高风险时相应地增加随访次数,而风险降低时减少随访次数。该随访策略建议,鼻咽癌I、II、III和iv期患者在治疗后分别需进行10、11、13和14次随访(图x)。这一研究改变了目前所有患者均采用“格式化”随访方案的现状,个体化随访策略不仅对疾病复发的监测能力优于目前美国NCCN指南或RTOG指南推荐的随访策略;且大大减少了患者随访次数,降低了医疗成本、提高了患者生活质量。虽然这一随访策略是基于鼻咽癌复发风险模型建立,该研究为其它疾病随访方案的建立提供了新思路和新方法,有助于为癌症患者制定效率高、成本低的个体化随访策略。
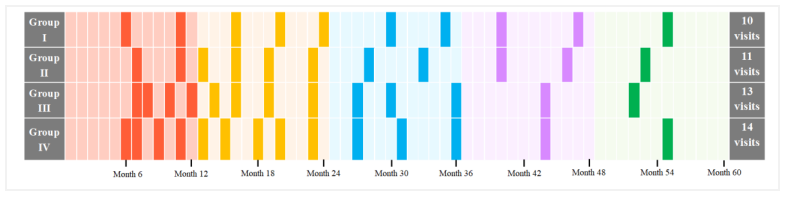
Figure 2. 对不同分期鼻咽癌患者个体化随访策略进行基于风险的监测安排。对于I组患者,基于风险的监测安排为5年内共10次就诊(1-5年分别为2次、3次、2次、1次)。对于II组患者,有11次就诊(1-5年分别为2次、4次、2次、2次和1次)。我们建议III组患者进行13次就诊(分别为4次、4次、3次、1次和1次就诊),而IV组患者则推荐了14次就诊(分别为4次、5次、3次、1次和1次就诊)。
3 免疫治疗获益-构建微环境
鼻咽癌的发病从病因上与EB病毒(EBV)感染高度相关,并且病理学特征表现肿瘤病变周围和内部的免疫细胞高度浸润,该特殊的微环境特征表明免疫治疗在鼻咽癌中具有极好的应用潜力。事实上,以免疫检查点抑制剂为代表的免疫治疗已在鼻咽癌患者中取得了不错的临床受益。然而,鼻咽癌患者对于抗PD-1疗法的反应率只有20%–30%,因此我们需进一步研究鼻咽癌肿瘤微环境,以探索更多的有效靶点。2020年Nature Medicine发布了一项研究成果,从单细胞水平上系统全面地构建了包含肿瘤细胞和免疫细胞在内的全面的鼻咽癌肿瘤微环境图谱[7]。该研究首先通过单细胞转录组测序技术获得了48,584个单细胞数据,定义了鼻咽癌肿瘤细胞内5个普遍的瘤内异质性特征基因集,其中Epi-differ 2基因集与EBV感染正相关,并富集TMPRSS2等介导病毒进入宿主细胞的基因,这表明Epi-differ 2基因集可能与EB病毒感染鼻咽上皮细胞的进程密切相关,有望成为干预靶点。同时鉴定出23种不同的免疫细胞亚群及影响免疫细胞多样性的关键转录因子,并揭示出NR1H3和TFEC等调控因子可能在鼻咽癌抗肿瘤中发挥作用。与此同时,研究人员发现鼻咽癌的功能失调性T细胞呈现一种“激活依赖性的功能失调”状态,即当T细胞的细胞杀伤能力增强时,免疫检查点分子的表达也随之增高;并发现LAG3和HAVCR2在鼻咽癌中或可作为比PDCD1更为有效的免疫治疗靶点。因此,这项研究首次在单细胞水平构建了鼻咽癌的肿瘤微环境图谱,并对鼻咽癌肿瘤细胞的异质性和免疫细胞的多样性进行了深入分析,为鼻咽癌的精准治疗奠定了新的基础。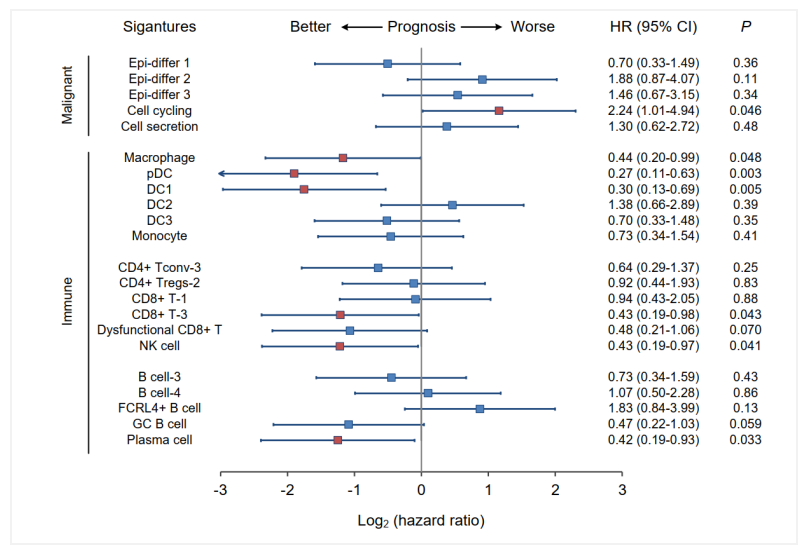
Figure 3. 国际上首次系统绘制了鼻咽癌的肿瘤微环境单细胞图谱,揭示了新的治疗靶点并建立了基于微环境成分的分子预后标签
4 初诊转移鼻咽癌:化疗敏感者联合放疗可提高生存
对于初诊转移性鼻咽癌患者,化疗的基础上是否需联合原发灶及颈部淋巴结放疗,尚无定论。针对这一问题,2020年于jama oncology发表的一项随机对照临床试验显示,对于化疗敏感型初诊转移性鼻咽癌患者,在全身治疗的基础上联合原发灶放疗可进一步提高生存[8]。该研究纳入126例初诊转移性鼻咽癌患者,这些患者3程顺铂+氟尿嘧啶方案化疗后肿瘤完全或部分消退。患者入组后随机进入单纯化疗组和化疗联合放疗组,在化疗基础上进行鼻咽原发灶及颈部淋巴结的放疗。经过26.7个月的中位随访,结果显示,化疗基础上联合放疗可明显提高2年总生存率(76.4% vs 54.5%,p = 0.004);另外,放化疗组的急性及远期毒性均可耐受。同期评述评论该研究:“The study by You et al provides level I evidence supporting the role of locoregional radiotherapy directed at the primary and neck disease in de novo metastatic NPC that is responsive to PF based chemotherapy(这一研究为局部区域放疗在转移性鼻咽癌重的价值提供了一级证据)。”

Figure4. 化疗基础上联合放疗可提高初诊转移且化疗敏感鼻咽癌患者的生存。
参考文献
[1] Bray F, Ferlay J, Soerjomataram I, et al. Global cancer statistics 2018: GLOBOCAN estimates of incidence and mortality worldwide for 36 cancers in 185 countries. CA Cancer J Clin. 2018;68(6):394-424.
[2] Zhang Y, Chen L, Hu GQ, et al. Gemcitabine and Cisplatin Induction Chemotherapy in Nasopharyngeal Carcinoma. N Engl J Med. 2019;381(12):1124-1135.
[3] Li WF, Chen NY, Zhang N, et al. Concurrent chemoradiotherapy with/without induction chemotherapy in locoregionally advanced nasopharyngeal carcinoma: Long-term results of phase 3 randomized controlled trial. Int J Cancer. 2019; 45: 295–305.
[4] Yang Q, Cao SM, Guo L, et al. nduction chemotherapy followed by concurrent chemoradiotherapy versus concurrent chemoradiotherapy alone in locoregionally advanced nasopharyngeal carcinoma: long-term results of a phase III multicentre randomised controlled trial. Eur J Cancer. 2019;119:87-96.
[5] Lei Y, Li YQ, Jiang W, et al. A Gene-Expression Predictor for Efficacy of Induction Chemotherapy in Locoregionally Advanced Nasopharyngeal Carcinoma. J Natl Cancer Inst. 2020 Jul 16;djaa100. doi: 10.1093/jnci/djaa100.
[6] Chen YP, Yin JH, Li WF, et al. Single-cell transcriptomics reveals regulators underlying immune cell diversity and immune subtypes associated with prognosis in nasopharyngeal carcinoma. Cell Res. 2020 Nov;30(11):1024-1042.
[7] Zhou GQ, Wu CF, Deng B, et al. An optimal posttreatment surveillance strategy for cancer survivors based on an individualized risk-based approach. Nat Commun. 2020 Aug 3;11(1):3872.
[8] You R, Liu YP, Huang PY, et al. Efficacy and Safety of Locoregional Radiotherapy With Chemotherapy vs Chemotherapy Alone in De Novo Metastatic Nasopharyngeal Carcinoma: A Multicenter Phase 3 Randomized Clinical Trial. Jama Oncol. 2020 Sep 1;6(9):1345-1352.