中国抗癌协会
立即下载App盘点2020 | 黄慧强教授:2020年度淋巴瘤诊疗领域关键进展

一个年度的盘点,也是下一个年度的起点
酸甜交错的2020离我们远去
充满期盼的2021向我们走来
【医悦汇】保持传统
诚邀肿瘤领域大咖
推出新年特辑【年度盘点】
总结盘点2020年度肿瘤学科进展
以字为媒,以言为镜
汇集和解读属于肿瘤学者的2020
第18期

中山大学肿瘤医院淋巴瘤中心 黄慧强教授
2020年度淋巴瘤诊疗领域关键进展
特邀专家


盘点2020年度淋巴瘤诊疗领域关键进展
2020年,新型冠状病毒很大程度的影响了我们的生活,但并未影响淋巴瘤领域的蓬勃发展,今年仍有多项研究显示出令人可喜的结果。较为瞩目的进展除了免疫靶向精准治疗及细胞免疫治疗等继续带来新的治疗希望外,新兴的生物检测技术ctDNA在淋巴瘤临床的逐渐深入开展,亦成为动态检测病情变化的重要手段。
1 分子靶向药物联合方案
维奈托克作为bcl-2抑制剂,venetoclax与化疗或其他药物联合使用,分别在DLBCL一线治疗及复发难治性患者中获得瞩目的表现。II期临床研究表明,维奈托克联合R-CHOP一线治疗的206例患者中,CRR为69%,并有提高PFS的趋势。今年ASH会议报道了维奈托克、伊布替尼、泼尼松、澳滨由妥珠单抗、联合来那度胺(Vipor ) 治疗R/R DLBCL的安全性及有效性的临床研究结果:该方案起效迅速,在首个疗程后,约90%患者有不同程度的肿瘤缩小;44例结束治疗的患者中,ORR 70%,CRR 49%;另有10例既往CAR-T失败的患者,经过Vipor方案治疗后仍有40%的ORR和30%的CRR。
塞利尼索Selinexor是一种口服的小分子核输出蛋白XPO1的抑制剂。一项IIb期临床试验表明,在接受过二线以上五线以下方案的复发/难治性DLBCL患者中单药Selinexor治疗ORR可达到29%,GCB亚型患者具有更高的ORR,为34%。作为一种全新机制的非细胞毒药物,该药于2020年6月由FDA批准用于二线以上R/R DLBCL的治疗,成功填补了GCB亚型DLBCL有效靶向药物的空白。此外,今年ASH会议上还报道了Selinexor联合化疗的两项I期研究结果:Selinexor联合R-CHOP一线治疗伴高危因素的DLBCL:ORR100%,CRR90%,毒性尚可耐受;而Selinexor联合RICE方案治疗R/R DLBCL,ORR78%,CRR41%,虽初步疗效喜人,但随之而来的较高发生率的血液学毒性、中枢神经毒性以及干细胞损伤值得关注。
2 细胞免疫治疗
CAR-T(NK)以CD19为靶点的CAR-T(NK)细胞输注是治疗R/R DLBCL的突破性进展,在约40%的R/R DLBCL患者中,抗CD19 CAR T细胞可诱导持久的完全缓解,但会产生一系列的毒性且制作过程复杂。CAR NK细胞的出现,正好可以很好的克服这些局限性。一项I/II期临床试验表明11例复发/难治性CD19+ B细胞淋巴瘤(包括非霍奇金淋巴瘤和慢性淋巴细胞白血病),经输注CD19特异的CAR NK细胞后,8名(73%)出现治疗有效,其中7 人完全缓解,1人出现Richter’s转化,并且均未出现严重的毒性反应。
CD19/CD20双靶CART既往多以CD19作为靶点的的CART治疗针对的是CD19+的患者,对于CD19-的患者,CD19和CD20双靶点的CAR T细胞输注治疗应运而生。一项I期临床研究结果表明,输注双靶点的CART细胞后,B-NHL和CLL患者在输注后的第28天有18例(82%)的客观缓解率,其中14例(64%)的患者CR,另有4例(18%)的患者PR,且所有受试者的安全性良好,表明双靶点的CART治疗具有高效低毒的应用前景。
自体干细胞移植(ASCT)后序贯CAR-T治疗自体干细胞移植是一直以来都是R/R DLBCL患者的标准二线治疗,但仍有一半左右的患者在ASCT后复发。而单用CAR-T治疗R/RDLBCL的有效率也只有35%左右。为此,华中科技大学同济医院周剑锋教授团队开展了一项ASCT后序贯输注CD19 CAR-T和CD22 CAR-T细胞的研究,入组的42例R/R DLBCL患者中,ORR为90.5%,CRR81%,1年PFS率85.7%;其有效性非常可喜,并且治疗相关毒性可耐受,严重的细胞因子释放综合征(CRS)发生率为仅5%。
快速生产CD19/CD22双靶CAR-T采用常规工艺生产制备CD19/CD22双CAR-T (GC022C)细胞,通常需要9-14天;而采用新型FasTCARTM平台生产的CD19/CD22双CAR-T (GC022F)细胞,耗时仅需24小时,且表型更年轻、耗竭更少。今年ASH会议上陆道培医院的陆佩华教授团队分享的一项I期临床数据表明,GC022F在治疗CD19 +/ CD22 +的B细胞性急淋白血病(B-ALL)方面是安全有效的:8/10例患者在输注后第28天检测MRD为阴性,其中5例完全缓解的患者成功进行了Allo-ASCT,输注GC022F的10例患者中无一例出现严重的CRS。CAR-T首次一线治疗高危DLBCL高危DLBCL患者预后差,对传统化疗应答低,OS较短,经一线R-CHOP治疗后早期难治性患者死亡风险增高。ZUMA-12研究中,共32例高危DLBCL患者接受Axi-Cel输注。单次输注Axi-Cel后,27例疗效可评估患者的ORR达85%,CR达74%,中位随访期9.3个月时中位缓解持续时间(DOR)、中位总生存期(OS)、中位无进展生存期(PFS)尚未达到。32例安全性可评估患者中,常见3级及以上不良反应(AE)为脑病(16%)、ALT升高(9%)、中性粒细胞减少(9%)。发生3级及以上细胞因子风暴(CRS)和神经毒性事件(NE)分别为9%和25%,无4级或5级CRS发生。ZUMA-12为CAR-T细胞疗法在高危LBCL中探索起了积极引领作用,相信在未来会为这部分患者带来更多临床受益。
3 免疫治疗(CD20/CD3双特异性抗体大放异彩)
Mosunetuzumab该全人源化的IgG1双特异性CD20/CD3抗体,通过与T细胞上的CD3和B细胞上的CD20结合,重定向内源性T细胞杀伤恶性B细胞。 今年ASH会议上一项I/II期的临床研究表明Mosunetuzumab用于老年或健康状况欠佳的DLBCL患者, ORR达58%(11/19),CRR达42%(8/19),为老年或体能状况欠佳的患者提供一种无化疗的新方案。而Mosunetuzumab治疗R/R滤泡性淋巴瘤(FL)I/Ib期临床研究中,亦有51.6%(32/62)的患者获得CR。CRS是该药发生率较高的不良事件,但大多较轻,为1~2级。
Glofitamab与Mosunetuzumab含有两个Fab区(一个靶向CD20,另一个靶向CD3)的结构不同,Glofitamab具有“2:1”的新颖结构,即含2个靶向CD20的Fab区和一个靶向CD3的Fab区。今年的 EHA 年会上,一项剂量递增的I 期研究结果显示在中位接受过三线治疗的B- NHL 患者中,Glofitamab 显示出强大的临床疗效: ≥0.6mg 剂量组中,侵袭性B- NHL 患者的 CRR 为 30.9%,ORR为 45.5%;惰性B- NHL 患者的 CRR 为 52.2%,ORR 为 65.2%。在 ≥10mg 组中,侵袭性 B-NHL 患者的 CRR为 34.1%,ORR 为 49.4%;惰性B- NHL 患者的 CRR为 50.0%,ORR 为 66.7%。获得 CR 患者,中位随访 10.2 个月,仍有72.7% 的侵袭性 NHL 和81.8% 的惰性 NHL 患者维持着 CR状态。最常见的不良反应是1~2级的CRS,使用人源化CD20单抗Obinutuzumab预治疗,可有效降低Glofitamab的CRS风险。
Epcoritamab与前述两种静脉注射的双特异性抗体不同,Epcoritamab是皮下注射的双特异性CD20/CD3抗体。今年ASH会议上报道了67例B-NHL(既往治疗3线以上)患者皮下注Epcoritamab的研究结果:剂量≥12 mg的18例DLBCL患者中,总缓解率(ORR)为66.7%, 6例患者达到完全缓解(CR)。剂量≥48 mg的7例患者中,所有患者均达到缓解,包括2例 (28.6%) CR。4例既往接受过CAR-T治疗的DLBCL患者均达到缓解,2例CR,2例PR。剂量≥0.76 mg的8例FL患者中ORR为100%,2例患者CR,6例PR。4例MCL患者中, 2例母细胞样变的MCL患者中观察到缓解(1例CR;1例PR)。这种新的皮下注射型双抗同样具有安全性良好,神经毒性低、CRS风险低的优点。(见图1表格)。
双特异单抗临床研究的结果的密集曝光,将给恶性淋巴瘤现代免疫治疗带来深远的影响!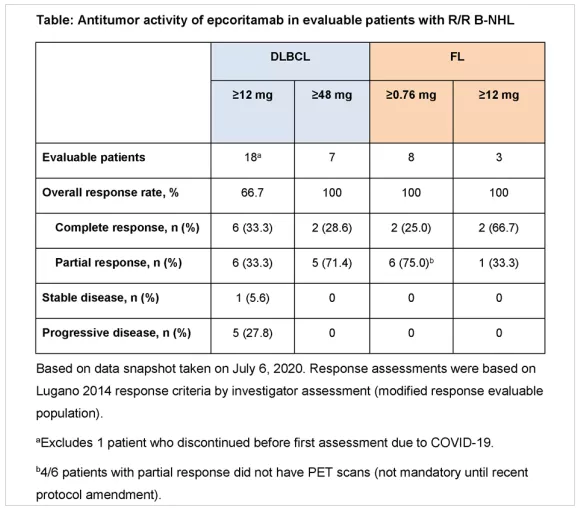
图1、Epcoritamab在R/R B-NHL中的抗肿瘤活性
Sintilimab+ Chidamide(信迪利单抗联合西达苯胺)中山大学肿瘤医院黄慧强教授团队在2020ASH年会上,在国内外首次证明PD-1单抗联合表观遗传调节剂治疗难治性NKT淋巴瘤可产生强烈有效的协同作用,36例常规治疗无效的难治性NKT淋巴瘤中,ORR 58.3%,CRR高达 44.4%,并且治疗有效维持时间长达9.5+月,1年OS 79.1%,目前仍继续随访中,所有患者的安全性好。作为里程碑式的研究结果,为PD-1单抗联合表观遗传调节剂在其他肿瘤的深入探讨奠定了坚实的理论和临床基础,值得关注。(图2 )
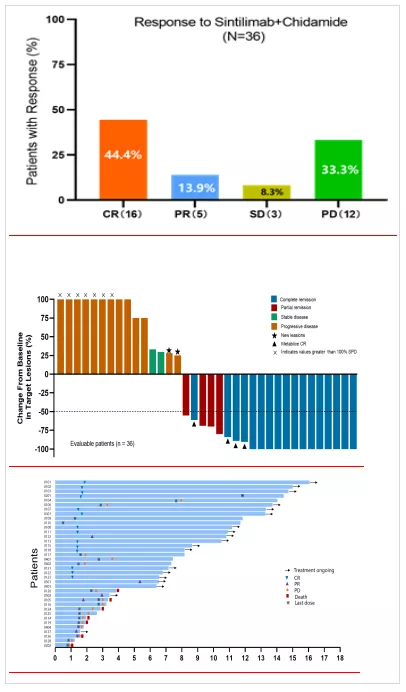
图2、PD-1单抗联合西达本胺的近期和远期疗效
4
循环肿瘤DNA(ctDNA)有望成为用于判断淋巴瘤预后的优势检测手段
相对于影像学和组织样本检测,ctDNA最大的优势就是可以在早期通过常规手段无法检测到的情况下识别出是否有细胞癌变的可能。同时,ctDNA无创、无损,可以多次获取,还可实时监测,从而提供比组织样品检测更多的信息。基于上述优点,被称为“液体活检”的ctDNA技术今年来发展迅速。2020年ASH会议,Reid W Merryman教授报道了ctDNA在141名DLBCL患者ASCT前和移植后血浆样本中的预后价值。研究显示ASC ctDNA对进展或死亡的敏感性和特异性分别为36%和95%。ASCT ctDNA检测相较ASCT前PET/CT检查能更有效地预测ASCT后的复发。ASCT ctDNA阳性患者的PFS非常短,对于这类患者强烈推荐替代治疗策略,如CAR-T细胞治疗。此外,在ASCT后的血浆样本中如检测ctDNA阳性,亦预示着早期复发,有助于应对措施的及时调整。ASC ctDNA阳性患者PFS及OS均显著劣于ctDNA阴性患者。见图3。

图3、ctDNA预测DLBCL ASCT 后的PFS及OS
总结
总之,分子靶向治疗和免疫治疗仍然是2020年淋巴瘤领域的关键词。随着对淋巴瘤发生机制的深入了解,越来越多的新型药物及免疫治疗方法将被研发出来,为临床治疗提供更多更优化的选择,改善患者预后的同时,实现了真正意义上的精准治疗。与此同时,新兴的更为精确的生物检测手段如ctDNA检测,也将影响着具体治疗策略的实施。参考文献:
1.Morschhauser F, Feugier P, Flinn IW, et al. A phase II study of venetoclax plus R-CHOP as first-line treatment for patients with diffuse large B-cell lymphoma. Blood 2020.
2.Melani C, Lakhotia R, Pittaluga S, et al. Phase Ib study of Vipor(Venetoclax,Ibrutinib,Prednisone,Obinutuzumab,and Lenalidomide)in Relapsed/Refractory B-Cell Lymphoma: Safety,Efficacy and Molecular Analysis.ASH 2020
3. Selinexor in Combination with R-CHOP for Frontline Treatment of Non-Hodgkin Lymphoma: Results of a Phase 1b Study. November 2020 Blood 136(Supplement 1):11-12.
4.Interim Analysis of ZUMA-12—The first study evaluating CAR-T cell therapy as1st-line therapy in high‐risk LBCL.ASH2020 #626