中国抗癌协会
立即下载App盘点2020 | 樊青霞教授:2020年度食管癌靶向治疗领域进展

一个年度的盘点,也是下一个年度的起点
酸甜交错的2020离我们远去
充满期盼的2021向我们走来
【医悦汇】保持传统
诚邀肿瘤领域大咖
推出新年特辑【年度盘点】
总结盘点2020年度肿瘤学科进展
以字为媒,以言为镜
汇集和解读属于肿瘤学者的2020
第7期

郑州大学第一附属医院 樊青霞教授
2020年度食管癌靶向治疗领域进展
特邀专家



盘点2020年度食管癌靶向治疗领域进展
我国食管癌高发,总病例数约占全球的一半,且在流行病学、组织学类型等方面与欧美国家存在明显差异。中国患者90%以上为鳞癌;而作为低发的欧美国家主要以腺癌为主。随着靶向治疗与免疫治疗药物的研发与进展,食管癌患者的生存期逐渐延长,目前食管癌靶向治疗的研究主要集中在EGFR、HER2、VEGF、VEGFR、MET等多个靶点,靶向药物的布局也从晚期到局部晚期,后线到一线。下面我们就回顾一下2020年食管癌靶向药物的治疗进展。
1
晚期食管癌治疗进展
靶向HER2治疗ToGA试验证实了曲妥珠单抗在HER2阳性晚期食管胃结合部癌的一线治疗地位,但一线治疗进展之后的尚无有效的抗HER2药物。RC48、DS-8201是由抗HER2抗体、连接子和细胞毒药物组成的抗体偶联药物(antibody drug conjugate,ADC)。RC48是我国率先进入人体临床试验的ADC药物。“RC48治疗HER2过表达的局部晚期或转移性胃癌Ⅱ期临床研究”率先在2020年美国临床肿瘤学会(American Society of Clinical Oncology,ASCO)年会公布结果,在三线及以上HER2过表达局部晚期或转移性胃癌中,RC48的客观缓解率(objective response rate,ORR)达到23.6%[1]。在DESTINY-Gastric01研究主要队列中,187例HER2阳性的胃/胃食管结合部癌患者接受了6.4 mg/kg T-DXd的治疗,对比接受标准化疗的对照组,DS-8201可显著改善患者的ORR(51%∶14%,P<0.001)和OS时间(12.5个月∶8.4个月,P=0.01)[2]。基于此,DS-8201已被美国食品和药品监督管理局授予突破性疗法,国内的桥接研究也即将开始。RC48和DS-8201两项研究都纳入了HER2低表达(RC48:免疫组化2+/荧光原位杂交-;DS-8201:IHC 2+/ISH-,IHC 1+)的患者,为抗HER2的ADC药物在经治HER2低表达的G/GEJ腺癌患者有临床活性提供了初步的证据。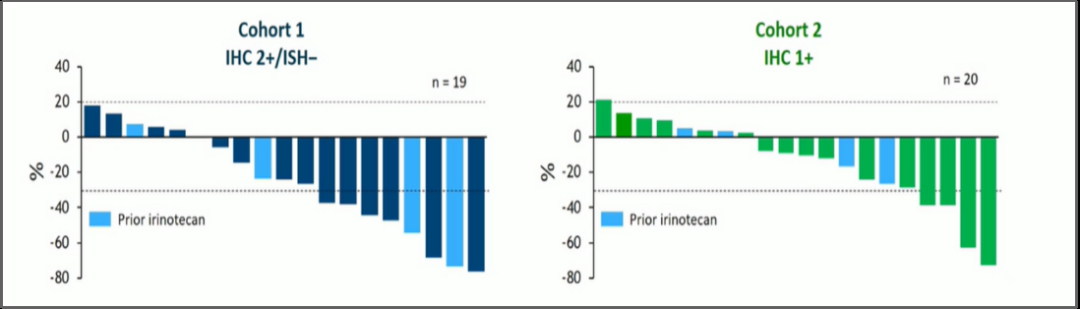
DESTINY-Gastric01研究中肿瘤大小相对于基线的最佳百分比变化
基于免疫治疗和抗HER2治疗的协同作用机制,免疫联合抗HER2治疗也是可行的治疗HER2阳性胃癌的治疗方案。2020年ASCO年会上公布了PANTHERA研究结果,该研究探索了帕博利珠单抗+曲妥珠单抗+化疗一线治疗HER2阳性晚期食管癌、食管胃结合部癌及胃癌患者的安全性和疗效。结果显示,ORR达76.7%,其中7例为完全缓解(CR),26例为部分缓解(PR),95.3%病灶发生缩小,PD-L1的表达与肿瘤缩小无相关性。mOS为19.3个月(95% CI 16.5-NA),mPFS为8.6个月(95% CI 7.2-16.4),mDOR为10.8个月(95% CI 7.17-NA)[3]。该研究与MSKCC研究结果类似,基于该研究的方案,Ⅲ期KEYNOTE-811研究正在进行中。免疫联合抗HER2治疗有望成为HER2阳性食管癌、食管胃结合部癌及胃癌一线治疗。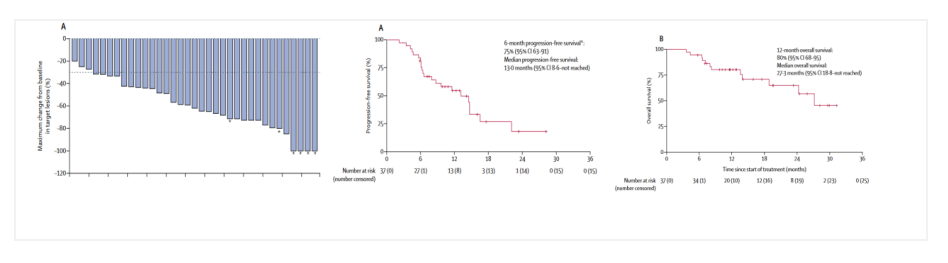
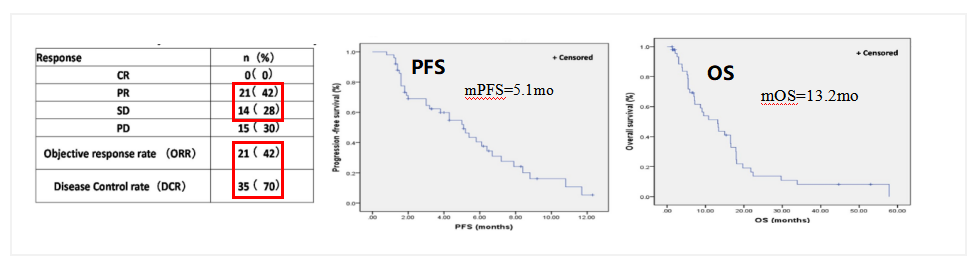
抗血管生成治疗晚期食管癌一线化疗有效率仅有40-50%,在2020 ASCO报道了一项单臂的II期研究中,血管生成抑制剂恩度(Rh-endostatin )联合紫杉醇和奈达铂治疗复发或转移性ESCC患者显示出较好的疗效及安全性,在入组的53名患者,ORR为42%,DCR为70%,mPFS和mOS分别为5.1mo和13.2mo,且不良反应可控,抗血管生成药物在晚期ESCC一线治疗中的地位还需随机试验进一步验证。
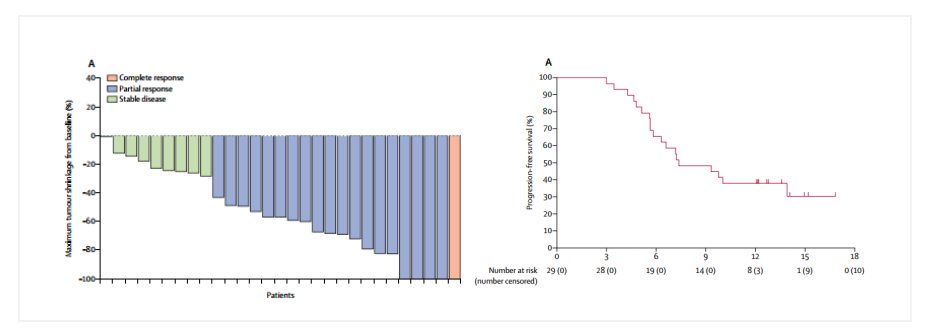
根据RAINBOW研究,紫杉醇联合ramucirumab是目前NCCN推荐的标准二线方案,目前,多西他赛越来越多的在围手术期及晚期一线治疗中应用,AIO II期RAMIRIS研究探索了FOLFIRI联合ramucirumab对比紫杉醇联合ramucirumab二线治疗经或未经多西他赛治疗的晚期或转移性胃食管腺癌。结果显示:既往接受多西他赛治疗的患者可从FOLFIRI+RAM治疗中明显获益—ORR达25%, mPFS达4.3mo[4],这为目前正在进行的III期试验提供了依据。抗血管生成药物联合PD-1/PD-L1单抗是近年来临床研究的热点。抗血管生成药物可以改善肿瘤微环境,抑制肿瘤中的免疫抑制细胞,从而协助免疫检查点抑制剂发挥作用。EPOC1706是一项关于仑伐替尼联合帕博利珠单抗一、二线治疗晚期胃癌的单壁Ⅱ期研究,研究的初步数据,在今年的ASCO胃肠道肿瘤研讨会(ASCO GI)上公布,近期于《柳叶刀·肿瘤学》以论文形式正式发表。研究共纳入29例接受仑伐替尼联合帕博利珠单抗作为一、二线治疗的患者,ORR达69%,明显高于帕博利珠单抗单药治疗晚期胃癌11%~16%,;排除微卫星高度不稳定(MSI-High)患者,ORR可达70%,且患者的PFS达到7.1个月[5]。期待后续的大型的Ⅲ期研究进一步证实其结果。
抗EGFR治疗EGFR一直是食管癌靶向治疗领域探索的重要靶点,先后有西妥昔单抗、吉非替尼等靶向EGFR药物在食管癌中进行了临床试验,但是疗效欠佳。尼妥珠单抗联合紫杉醇和顺铂一线治疗转移性食管鳞癌III期临床研究正在进行中,目前尚未入组结束。一项发表在《CANCER》杂志上的一项II期研究探索了不可逆泛erbb激酶抑制剂阿法替尼(afatinib)在复发和/或转移性食管鳞癌(R/M-ESCC)患者中的临床活性、安全性和预测生物标志物。结果显示,49例患者ORR为14.3%,DCR为73.3%。中位随访6.6个月,中位PFS和OS分别为3.4个月和6.3个月。TP53突变和EGFR扩增可预测阿法替尼的疗效[6]。
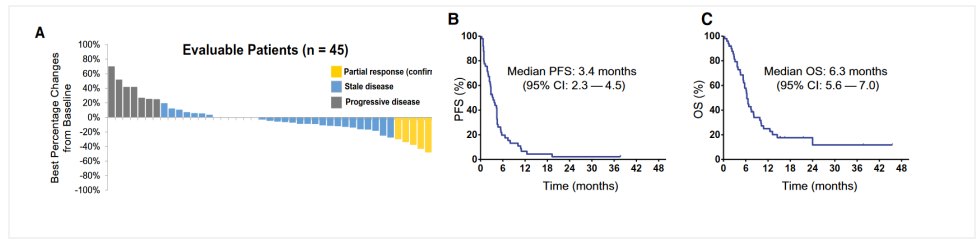
其他靶向药物CDK4/6抑制剂帕博西尼(palbociclib)改善了转移性乳腺癌的整体生存期,并在多种肿瘤中显示出临床前活性。发表在《Oncologist》杂志上的一项II期研究探索了帕博西尼在食管癌后线治疗的疗效和安全性。入组的21例患者中,胃腺癌5例,食管胃交界腺癌3例,食管腺癌8例,食管鳞癌5例。未观察到客观反应。中位PFS为1.8个月,中位OS为3.0个月[7]。说明对于不加选择的食管癌人群,帕博西尼疗效有限。由于这项研究样本量较少,CDK4/6抑制剂在食管癌中前景还需临床与基础研究的努力。
2
围手术期食管癌治疗进展
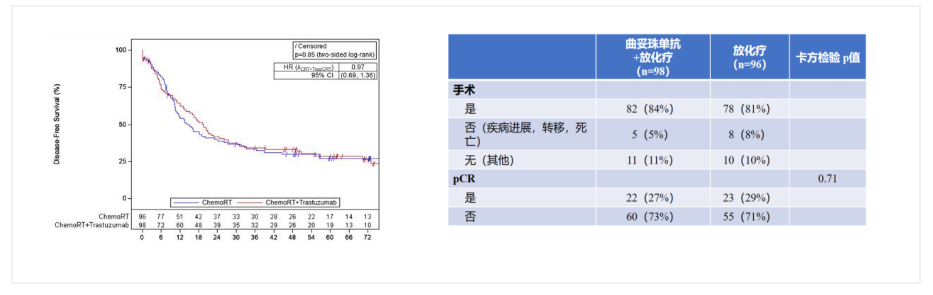
靶向HER2治疗RTOG 1010是一项开放性、随机Ⅲ期试验,旨在确定曲妥珠单抗联合三联疗法是否能提高HER2过表达食管腺癌患者的DFS。结果显示:CXRT+曲妥珠单抗组的中位DFS为19.6个月,CXRT组为14.2个月(HR=0.97)。CXRT+曲妥珠单抗组的中位OS为38.5个月,CXRT组为38.9个月(HR=1.01)[8]。三联疗法增加曲妥珠单抗未能改善DFS,也未能增加pCR率及改善总生存。
PETRARCA是一项前瞻性、多中心、随机、研究者发起的试验,计划为Ⅱ/Ⅲ期研究,旨在评估在FLOT治疗中加入曲妥珠单抗(tras)和帕妥珠单抗(per)治疗HER2阳性可切除的食管胃腺癌(EGA)患者的疗效。结果显示:tras/per可显著提高pCR率(A组12%;B组35%;P=0.02)和病理淋巴结阴性率(A组39%;B组68%),两组的R0切除率(A组90%;B组93%)和手术并发症(A组43%;B组44%)相近。中位无病生存期(DFS)和OS分别为26个月和尚未达到(HR=0.58,P=0.14)。在22个月的中位随访时间后,中位OS仍未达到。该研究由于JACOB研究的阴性结果提早终止,没有得出生存数据。但tras/per显著提高了pCR率,初步的DFS和OS令人期待[9]。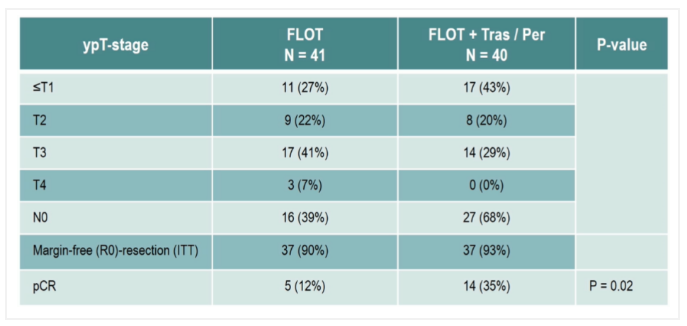
抗血管生成治疗针对HER2阴性的食管腺癌患者,多中心随机I/II 期的RAMSES/FLOT7研究探索围手术期在FLOT方案基础上联合雷莫芦单抗(RAM)的有效性和安全性。研究结果显示,围术期联用雷莫芦单抗成功提高了R0切除率(B组∶A组:97%∶83%,P=0.0049),尤其是在T4(100%∶25%)和弥漫型胃癌(95%∶77%)中优势更为明显,反映出VEGFR抑制剂在巨块肿瘤中的作用。但遗憾的是,未观察到主要终点pCR率的提高(27%∶30%)[10]。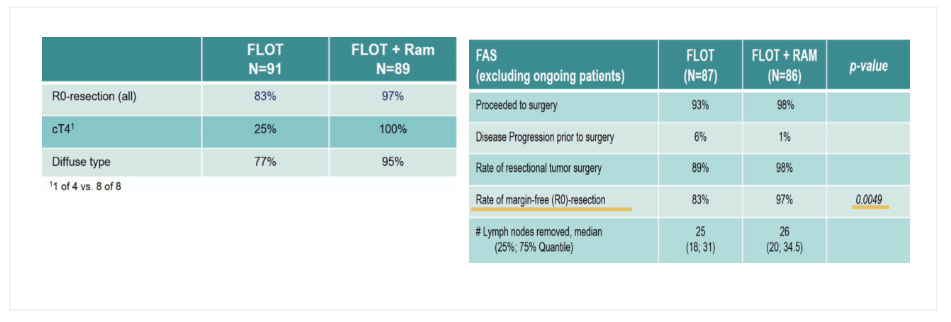
总结
综上,尽管2020年食管癌靶向治疗领域进展主要还是在食管胃交界部癌和食管腺癌,尤其在靶向HER2治疗方面,食管鳞癌未见突破性进展。中西方食管癌研究关注的科学问题、研究思路和临床需求明显不同,因此,食管癌未来的研究应改变以往偏重发现癌变新基因的思路,利用我国尤其是我省食管癌病例资源优势,以解决临床重大科学问题为主题,采用多维组学整合并与临床表型大数据关联等技术,获得肿瘤组学特征谱,进行多中心规模化验证,开展多中心的转化与临床研究,为食管癌的精准治疗提供重要的技术支撑,诊疗水平的提高找到突破的方向。参考文献
1. PENG Z, LIU T, WEI J, et al. A phase Ⅱ study of efficacy and safety of RC48-ADC in patients with locally advanced or metastatic HER2-overexpressing gastric or gastroesophageal junction cancers[J]. J Clin Oncol, 2020, 38(15_suppl):4560.
2. SHITARA K, BANG Y-J, IWASA S, et al. Trastuzumab Deruxtecan in Previously Treated HER2-Positive Gastric Cancer[J]. N Engl J Med, 2020, 382(25):2419-2430.
3. Yelena Y Janjigian,Steven B Maron,et al.First-line Pembrolizumab and Trastuzumab in HER2-positive Oesophageal, Gastric, or Gastro-Oesophageal Junction Cancer: An Open-Label, Single-Arm, Phase 2 Trial.Lancet Oncol 2020 Jun;21(6):821-831.
4. 2020 ASCO Abstract4522
5. Kawazoe A, Fukuoka S, Nakamura Y, et al. Lenvatinib plus pembrolizumab in patients with advanced gastric cancer in the first-line or second-line setting (EPOC1706): an open-label, single-arm, phase 2 trial. Lancet Oncol 2020 Jun 23.
6. Min Hee Hong,Seong Gu Heo,et al.Phase 2 study of afatinib among patients with recurrent and/or metastatic esophageal squamous cell carcinoma.Cancer. 2020 Oct 15;126(20):4521-4531.
7. Thomas Benjamin Karasic,Mark H O'Hara, et al.Phase II Trial of Palbociclib in Patients with Advanced Esophageal or Gastric Cancer.Oncologist. 2020 Jul 21.
8. Moniek Verstegen, et al. ASCO 2020. Abstract 4509.
9. AL-BATRAN S E, HAAG G M, ETTRICH T J, et al. 1421MO Final results and subgroup analysis of the PETRARCA randomized phase Ⅱ AIO trial: Perioperative trastuzumab and pertuzumab in combination with FLOT versus FLOT alone for HER2 positive resectable esophagogastric adenocarcinoma[J]. Ann Oncol, 2020, 31:S899.
10. AL-BATRAN S-E, HOFHEINZ RD, SCHMALENBERG H, et al. Perioperative ramucirumab in combination with FLOT versus FLOT alone for resectable esophagogastric adenocarcinoma (RAMSES/FLOT7): Results of the phase Ⅱ-portion—A multicenter, randomized phase Ⅱ/Ⅲ trial of the German AIO and Italian GOIM[J]. J Clin Oncol, 2020, 38:abstr 4501.
更多【盘点2020】,敬请期待!