中国抗癌协会
立即下载App盘点2020 | 沈洪兵院士:2020年肿瘤流行病学领域重要进展

一个年度的盘点,也是下一个年度的起点
酸甜交错的2020离我们远去
充满期盼的2021向我们走来
【医悦汇】保持传统
诚邀肿瘤领域大咖
推出新年特辑【年度盘点】
总结盘点2020年度肿瘤学科进展
以字为媒,以言为镜
汇集和解读属于肿瘤学者的2020
第6期

中国工程院 沈洪兵院士
2020年肿瘤流行病学领域重要进展
特邀专家

盘点2020年肿瘤流行病学领域重要进展
近年来,高通量组学检测、人工智能、互联网与信息化等技术的迅猛发展以及大数据时代的悄然来临,大大拓展了肿瘤流行病学研究的范畴,也为肿瘤的精准化防治提供了重要机遇。2020年度,肿瘤流行病学在多基因风险评分应用于肿瘤个体化风险评估、大数据和人工智能推进肿瘤防治、液态活检与肿瘤筛查,以及新冠疫情对肿瘤流行趋势的影响等多个方面取得了一系列研究进展,简要阐述。
1
多基因遗传风险评分(PRS)应用于肿瘤个体化风险评估
阐明恶性肿瘤发生的危险因素,建立切实有效的防制措施,对于预防肿瘤发生和降低肿瘤死亡具有十分重要的意义。其中,一个关键的需求是评估个体疾病发生风险,确定特定疾病的高危人群,以便提高筛查或预防性治疗的效果。在过去20年间,大规模基因组流行病学研究已经鉴定了基因组范围内数万个影响生物学表型(如身高、BMI等)以及肿瘤等疾病的遗传变异,如何使用这些遗传变异预测肿瘤的发生风险,指导肿瘤的精准化防制已经成为基因组流行病学研究领域的热点问题。2019年本课题组首次证实肺癌多基因遗传风险评分PRS-19可前瞻性识别肺癌高危人群[1],其后PRS与肿瘤个体化风险评估的研究日益增多。2020年,本课题组基于全球最大的胃癌全基因组关联研究(GWAS)数据库(10254例胃癌病例和10914例对照),构建了包含112个位点的中国人群胃癌多基因遗传风险评分;在中国慢性病前瞻性研究队列(CKB)中,该评分可稳定识别胃癌高危人群,与遗传风险最低的20%人群相比,遗传风险评分最高的20%人群发病风险增加了1.08倍(图1)[2]。此外,还发现采取健康生活方式(戒烟、限酒、限制腌制蔬菜、多吃新鲜水果蔬菜)可部分抵消胃癌高遗传风险[2]。在欧美人群中,研究者们也基于英国研究队列UK Biobank,先后证明不同肿瘤GWAS研究结果构建的遗传风险评分可前瞻性预测乳腺癌、结直肠癌、甲状腺癌、睾丸癌、前列腺癌、白血病、胰腺癌、黑色素瘤、膀胱癌、宫颈癌、子宫内膜癌、卵巢癌、非霍奇金病淋巴瘤、肾癌、口腔癌等多种肿瘤的发生风险[3-7];肿瘤遗传风险评分与可改变的生活方式共同构建风险预测模型时,可显著提高模型的预测效果[5]。一项芬兰的人群队列也证实,与一般人群相比,乳腺癌遗传评分前2.5%的人群终生发病风险从13.3%增加到33.9% ,而前列腺癌从16.3% 增加到 50.0% ,且平均发病年龄显著提前,乳腺癌提前了4.89岁,前列腺癌提前了5.53岁[8]。尽管不同人群存在种族异质性,欧美人群的乳腺癌遗传风险评分方案在亚洲女性中也呈现出了较好的预测效果[9],这为PRS的跨种族应用提供了可能。值得关注的是,以乳腺癌为代表的肿瘤PRS个体化筛查方案,目前已经开始在欧美人群中进行临床试验研究(如MyPeBS,https://clinicaltrials.gov/ct2/show/NCT03672331)。
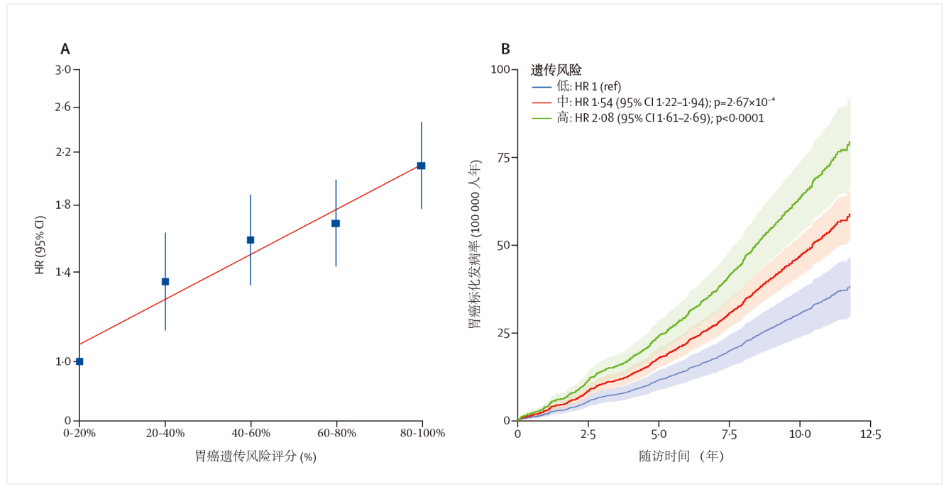
图1. 中国胃癌多基因遗传风险评分PRS-112与胃癌发生风险
2
大数据和人工智能推进肿瘤防治
近年来,以物联网、互联网、移动智能、云计算、大数据为代表的信息技术广泛运用于医疗领域,医疗信息化得到全面、快速发展,由此形成了海量的健康医疗大数据。这些健康医疗大数据的应用前景取决于如何进行多层次的挖掘和全方位的整合,以增进对人类健康或疾病的理解。以深度学习为代表的人工智能技术在大数据分析中的应用正呈现爆发式增长,有望为恶性肿瘤的“早筛查、早预防”做出贡献(图2)。2020年,基于深度学习的AI肿瘤筛查模型取得了突破性的进展。Google Health的研究人员基于英美的两个大型筛查队列的乳房X光影像数据,成功应用深度学习开发了一套乳腺癌早期识别模型[10]。对该模型进行评估发现,与影像科医生的人工判读相比,该模型的假阳性率降低1.2%-5.7%,假阴性率减少2.7%-9.4%。在6位影像科医生的独立验证中,该模型的表现优于所有读片人,曲线下面积(area under the receiver operating characteristic curve,AUC-ROC)增加了11.5%。此外,该模型可减少88%的阅片核查工作量,极大提升了工作效率。除乳腺癌外,AI系统在Barrett食管患者的肿瘤检测[11]和肺结节的风险分层[12]等方面均取得了优异的表现,有望显著提升肿瘤筛查的准确性和效率。在肿瘤诊断方面,利用病理图像训练的诊断模型效能也得到了进一步提高。除了传统的表征外,现有模型还可以快速进行肿瘤分级[13,14]和分子分型[15,16],甚至可在术中实现快速诊断。例如,纽约大学朗格尼医学中心的研究人员利用AI系统联合光学成像可在150秒内快速进行脑部肿瘤的诊断,准确率高达94.6%,优于病理医生(93.9%)[17]。此外,研究者还尝试将AI应用于肿瘤患者的治疗和预后评价。有研究者首次利用AI建立了基于全切片数字图像的结直肠癌患者生存风险预测模型[18]。结果表明,该模型对结直肠癌患者的生存风险分层优于已知的分子和形态学预后标记物,为实现个体化治疗提供了新思路,具有潜在的应用价值。上述研究表明,应用深度学习等人工智能算法,可对大量医疗数据进行深入挖掘,揭示肿瘤的生物学行为,从而更准确地对肿瘤早期特征、临床表现及治疗疗效等进行判断,有望在未来快速推动肿瘤的精准防诊治,成为肿瘤个体化医疗体系的新助力。
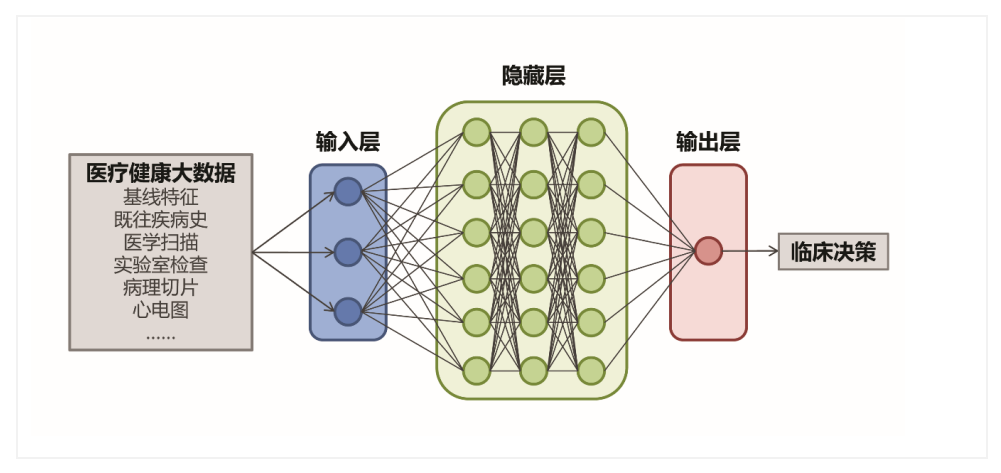
图2. 简化的人工智能模型运行框架
3
液态活检助力肿瘤筛查
早筛早诊是降低恶性肿瘤死亡的最有效途径。基于新一代基因测序技术的液体活检对极微量肿瘤来源的核酸等标志物具有高敏感性,可从血液、尿液等体液中捕捉和鉴别自由游走的极少量癌细胞或癌DNA,进而有可能成为癌症早筛早诊的突破口(图3)。
2020年,循环游离基因组图谱研究协作组(The Circulating Cell-free Genome Atlas Consortium)在6689名受试者(2482名肿瘤和4207名非肿瘤)中评估了循环游离DNA(cfDNA)靶向甲基化检测方法对于不同类型和不同分期肿瘤的筛查能力。结果表明,该方法可鉴别50多种肿瘤,特异性>99%,假阳性率<1%;随着肿瘤分期升高(I-IV),灵敏度可从39%增加至92%[19]。斯坦福大学研究团队也利用深度测序的癌症个体化分析方法(CAPP-Seq)确立了cfDNA用于肺癌筛查的潜力,并强调基于cfDNA的筛查研究中选择风险匹配的病例和对照的重要性[20]。另一项来自约翰·霍普金斯大学的研究则在近万名65-75岁的老年人中通过液体活检技术结合PET-CT等影像学检查,筛查出传统手段未能发现的10种癌症[21],进一步体现了液态活检用于肿瘤筛查的潜在价值。
与此同时,我国科学家在液体活检用于肿瘤筛查研究方向也有新的进展。中山大学肿瘤中心研究团队应用机器学习算法,开发了基于游离DNA甲基化的结直肠癌诊断和预后模型,显示了游离DNA甲基化标记物在结直肠癌的诊断、监测和预后中的价值[22]。海军军医大学团队开发了一种基于尿液的液体活检方法UroCAD,该方法鉴定尿路上皮癌的敏感性为80.4%,特异性为94.9%[23]。四川大学华西医院与复旦大学附属肿瘤医院合作,开发了基于游离DNA甲基化的Luna分析方法,并发现游离DNA特异性甲基化对于早诊肺腺癌具有较高的敏感性和特异性[24]。2020年国家重点研发计划“恶性肿瘤筛查早诊的液体活检技术研发及评价研究”项目正式启动,将重点突破恶性肿瘤筛查及早诊早治液体活检关键技术,构建高灵敏度、高特异性、高效经济的恶性肿瘤液体活检早诊技术体系,并在大规模多中心的前瞻性队列中验证液体活检技术用于筛查的有效性和可行性。
因此,液体活检有望显著提高肿瘤早期筛查技术的灵敏度和特异性,同时做到操作简便、无创、流程标准化,成为肿瘤早期筛查的关键技术。
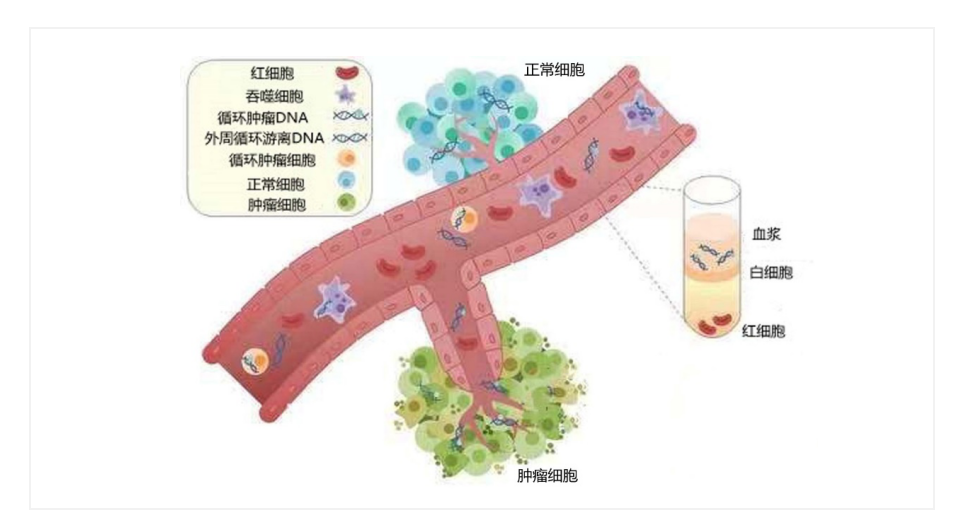
图3 液体活检的原理示意图
4
新冠疫情对肿瘤流行趋势的影响
2020年,一场新冠疫情席卷全国,波及全球。新冠疫情波及范围广泛、感染人口众多,使得肿瘤的管理和治疗被迫发生改变,进而对肿瘤流行趋势、肿瘤防控等都将造成较大影响。
权威医学期刊《Lancet Oncology》于2020年4月1日发表社论“COVID-19: global consequences for oncology”(《新冠病毒:对肿瘤学的全球影响》),认为新冠病毒的大流行会导致各国医疗系统被迫重新分配资源,而这对于肿瘤学的现状和未来都会造成深远的影响[25]。《Lancet Oncology》另一篇5月1日发表的论文“Cancer guidelines during the COVID-19 pandemic”(新冠病毒大流行时期的癌症指南),也详细介绍了各国医疗系统面临的挑战以及据此制定的特殊时期肿瘤治疗策略[26]。
已有一些研究表明,肿瘤患者免疫力低下,是新冠病毒的易感人群,其感染新冠病毒后,极易发展成为重症,入住ICU、有创通气的比例均高于非肿瘤患者[27]。因此,合并新冠感染的肿瘤患者死亡率正受到关注。湖北地区一项基于205例肿瘤病人的回顾性队列研究结果显示,相较于无新冠感染的肿瘤患者,合并新冠感染的肿瘤患者有更高的死亡率;其中,男性以及既往4周内接收化疗的肿瘤患者预后更差[28]。加拿大一项基于552例肿瘤患者的回顾性数据同样显示,合并新冠感染的肿瘤病人有更高的死亡率[29]。西班牙一项基于1069例新冠病人的回顾性队列研究结果表明,合并新冠病毒感染的肿瘤患者死亡率是其他人群的四倍[30]。然而,也有研究发现合并/不合并新冠感染的肿瘤患者死亡率并不存在明显的差异[31]。
综上所述,尽管不同人群间存在种族异质性,大多数研究均发现合并新冠感染肿瘤患者死亡率较高这一现象,因此新冠疫情对于肿瘤患者死亡率的影响不容忽视。这也提醒我们,在疫情大环境下,需要一手抓疫情防控,一手抓医疗服务,在科学防控的基础上,确定肿瘤防控的新策略,满足肿瘤患者的就医需求。【参考文献】
1. Dai, J., et al., Identification of risk loci and a polygenic risk score for lung cancer: a large-scale prospective cohort study in Chinese populations. Lancet Respir Med, 2019. 7(10): p. 881-891.
2. Jin, G., et al., Genetic risk, incident gastric cancer, and healthy lifestyle: a meta-analysis of genome-wide association studies and prospective cohort study. Lancet Oncol, 2020. 21(10): 1378-1386.
3. Carr, P.R., et al., Estimation of Absolute Risk of Colorectal Cancer Based on Healthy Lifestyle, Genetic Risk, and Colonoscopy Status in a Population-Based Study. Gastroenterology, 2020. 159(1): 129-138 e9.
4. Arthur, R.S., et al., Genetic Factors, Adherence to Healthy Lifestyle Behavior, and Risk of Invasive Breast Cancer Among Women in the UK Biobank. J Natl Cancer Inst, 2020. 112(9): p. 893-901.
5. Kachuri, L., et al., Pan-cancer analysis demonstrates that integrating polygenic risk scores with modifiable risk factors improves risk prediction. Nat Commun, 2020. 11(1): 6084.
6. Zhang, Y.D., et al., Assessment of polygenic architecture and risk prediction based on common variants across fourteen cancers. Nat Commun, 2020. 11(1): 3353.
7. Liyanarachchi, S., et al., Assessing thyroid cancer risk using polygenic risk scores. Proc Natl Acad Sci U S A, 2020. 117(11): 5997-6002.
8. Mars, N., et al., Polygenic and clinical risk scores and their impact on age at onset and prediction of cardiometabolic diseases and common cancers. Nat Med, 2020. 26(4): 549-557.
9. Ho, W.K., et al., European polygenic risk score for prediction of breast cancer shows similar performance in Asian women. Nat Commun, 2020. 11(1): 3833.
10. McKinney, S.M., et al., International evaluation of an AI system for breast cancer screening (vol 577, pg 89, 2020). Nature, 2020. 586(7829): E19-E19.
11. de Groof, A.J., et al., Deep-Learning System Detects Neoplasia in Patients With Barrett's Esophagus With Higher Accuracy Than Endoscopists in a Multistep Training and Validation Study With Benchmarking. Gastroenterology, 2020. 158(4): 915-929.
12. Massion, P.P., et al., Assessing the Accuracy of a Deep Learning Method to Risk Stratify Indeterminate Pulmonary Nodules. American Journal of Respiratory and Critical Care Medicine, 2020. 202(2): 241-249.
13. Bulten, W., et al., Automated deep-learning system for Gleason grading of prostate cancer using biopsies: a diagnostic study. Lancet Oncology, 2020. 21(2): 233-241.
14. Strom, P., et al., Artificial intelligence for diagnosis and grading of prostate cancer in biopsies: a population-based, diagnostic study. Lancet Oncology, 2020. 21(2): 222-232.
15. Naik, N., et al., Deep learning-enabled breast cancer hormonal receptor status determination from base-level H&E stains. Nature Communications, 2020. 11(1).
16. Schmauch, B., et al., A deep learning model to predict RNA-Seq expression of tumours from whole slide images. Nature Communications, 2020. 11(1).
17. Hollon, T.C., et al., Near real-time intraoperative brain tumor diagnosis using stimulated Raman histology and deep neural networks. Nature Medicine, 2020. 26(1): 52-58.
18. Skrede, O.J., et al., Deep learning for prediction of colorectal cancer outcome: a discovery and validation study. Lancet, 2020. 395(10221): 350-360.
19. Liu MC, Oxnard GR, Klein EA, Swanton C, Berry DA. Sensitive and specific multi-cancer detection and localization using methylation signatures in cell-free DNA. Annals of Oncology. 2020;31(6):745-759.
20. Chabon JJ, Hamilton EG, Kurtz DM, Esfahani MS, Diehn M. Integrating genomic features for non-invasive early lung cancer detection. Nature. 2020;580(7802):245-251.
21. Lennon AM, Buchanan AH, Kinde I, Warren A, Papadopoulos N. Feasibility of blood testing combined with PET-CT to screen for cancer and guide intervention. Science. 2020;369(6499):eabb9601.
22. Luo H, Zhao Q, Wei W, Zheng L, Xu RH. Circulating tumor DNA methylation profiles enable early diagnosis, prognosis prediction, and screening for colorectal cancer. Science translational medicine. 2020;12(524):7533.
23. Zeng Z, Ziliang Q, Ying Y, Wang B, Xu X. Non-invasive detection of urothelial carcinoma by cost-effective low-coverage whole genome sequencing from urine exfoliated cells DNA. European Urology Open Science. 2020;19:e1004.
24. Wang Z, He Q, Liu R, Li W. Identification and validation of circulating tumour DNA methylation markers for lung nodule stratification. Annals of Oncology.31. Sharpless, N.E., COVID-19 and cancer. Science, 2020. 368(6497): 1290-1290.
25. The Lancet Oncology. COVID-19: global consequences for oncology. Lancet Oncol. 2020 Apr;21(4):467.
26. Burki TK. Cancer guidelines during the COVID-19 pandemic. Lancet Oncol. 2020 May;21(5):629-630.
27. Liang, W., et al., Cancer patients in SARS-CoV-2 infection: a nationwide analysis in China. The Lancet Oncology, 2020. 21(3): 335-337.
28. Yang, K., et al., Clinical characteristics, outcomes, and risk factors for mortality in patients with cancer and COVID-19 in Hubei, China: a multicentre, retrospective, cohort study. The Lancet Oncology, 2020. 21(7): 904-913.
29. Elkrief, A., et al., High mortality among hospital-acquired COVID-19 infection in patients with cancer: A multicentre observational cohort study. European Journal of Cancer, 2020. 139: 181-187.
30. Lara Álvarez, M.Á., et al., Mortalidad por COVID-19 en pacientes con cáncer en un hospital de Madrid durante las primeras 3 semanas de epidemia. Medicina Clínica, 2020. 155(5): p. 202-204.
31. Assaad, S., et al., High mortality rate in cancer patients with symptoms of COVID-19 with or without detectable SARS-COV-2 on RT-PCR. European Journal of Cancer, 2020. 135: 251-259.