中国抗癌协会
立即下载App盘点2020 | 于金明院士:2020年度肺癌放射治疗领域研究进展

一个年度的盘点,也是下一个年度的起点
酸甜交错的2020离我们远去
充满期盼的2021向我们走来
【医悦汇】保持传统
诚邀肿瘤领域大咖
推出新年特辑【年度盘点】
总结盘点2020年度肿瘤学科进展
以字为媒,以言为镜
汇集和解读属于肿瘤学者的2020
第2期

山东省肿瘤医院 于金明院士
2020年度肺癌放射治疗领域研究进展
特邀专家


2020年度肺癌放射治疗领域研究进展
肺癌死亡率具恶性肿瘤首位,放疗作为肺癌主要的治疗方式之一,在肺癌全程管理中均发挥重要作用[1]。2020年肺癌放疗领域依然成就斐然:局部晚期非小细胞肺癌(NSCLC)是主要阵地,放疗免疫联合治疗是研究热点,EGFR突变患者靶向联合放疗策略、放射剂量选择及放射增敏和防护备受关注。我们现对肺癌放疗领域的重要研究进行归纳总结。
1
不可手术的早期NSCLC
I-SABR耐受良好,初见成效。立体定向消融放疗(SABR)是早期不可手术NSCLC患者的最佳治疗选择,然而,仍有20-30%发生远处转移。2020年美国临床肿瘤学会(ASCO)年会中报道了两项针对不可手术的早期NSCLC的I-SABR初步探索,其中一项是评估Atezolizumab联合SABR治疗不可手术早期NSCLC的耐受性和疗效的I期临床研究[2]。患者接受6周期Atezolizumab治疗,在第3周期时同步进行SABR(50Gy/4-5次),3/17例部分缓解,1/17例肿瘤轻微缩小,没有患者疾病进展,其中3/5例(60%)PD-L1阳性患者肿瘤有缓解,而仅1/8例(12.5%)PD-L1阴性患者肿瘤有缓解。Atezolizumab联合SABR治疗无法手术的早期非小细胞肺癌初探有效,安全可行。该方案将在III期临床研究SWOG/NRG S1914中进行验证。另一项是评估Nivolizumab联合SABR的疗效和毒性的II期临床研究[3],I-SABR组接受50GY/4F或70GY/10F放疗联合Nivolizumab治疗,SABR组患者只接受同等剂量的放疗。在I-SABR组,没有患者因不良反应中断治疗。Nivolizumab联合SABR治疗早期不可手术NSCLC耐受性良好。而正在进行的III期临床Pacific-4研究,旨在探索SBRT同步Durvalizumab+Durvalizumab 巩固治疗对早期不可手术NSCLC疗效和安全性。另外一项随机III期KEYNOTE-867研究正在入组中,旨在对比SBRT联合Pembrolizumab与SBRT对不可手术NSCLC疗效及安全性。这些研究的开展将为早期不可切除NSCLC患者SBRT与免疫的疗效、安全性及联合模式等提供新的证据,我们期待研究的最新数据公布,进而推动I-SABR临床应用的进程。2
可手术的早期NSCLC
CRT与免疫治疗具协同作用,但毒性反应不容忽视。对于可切除NSCLC,新辅助治疗有效但颇具争议。新辅助放化疗并不优于单独化疗,且毒性发生率更高,免疫疗法为早期肺癌的围手术期治疗带来新突破的希望。2020年ASCO大会报道了一项针对IIIA期NSCLC患者,评估CRT中同步加入新辅助Pembrolizumab的安全性和可行性的研究[4]。研究发现,在可切除的III期患者中,新辅助Pembrolizumab联合放化疗后手术pCR率高,但毒副作用严重。因此,仍旧需要探索更合理的新辅助治疗策略。
PORT是否作为R0切除III期N2肺癌标准治疗?关于III期N2非小细胞肺癌R0术后是否接受辅助放疗(PORT),一直以来都是热点争议问题。近期,《Clinical Lung Cancer》杂志发表的一项研究[5],研究纳入1989年-2016年来自SEER数据库登记的患者,结果分析发现,PORT与对照组之间的OS并无差异(HR=0.99, P=0.76)。但亚组分析发现,阳性淋巴结个数占采样淋巴结总数50%及以上的患者,接受放疗可以给患者带来获益。2020年欧洲肿瘤内科学会(ESMO)上公布了Lung ART研究结果,这是欧洲首项评估PORT治疗N2 NSCLC患者R0切除的III期随机临床研究[6]。研究发现,PORT与对照组患者的中位DFS分别为30.5个月和22.8个月;3年的DFS率分别为47.1%和43.8%,PORT虽然降低纵隔复发率至25%,但同时将死亡率从5.3%提升至14.6%。也就是说,更高的局控率并没能转化为DFS及OS获益,而且PORT带来了更多与放疗直接或者间接相关的死亡率、3-4级毒副反应及更高的概率诱发第二原发肺癌,这可能与89%患者采用落后的三维适形放疗有关。因此,未来对于pN2 NSCLC患者,进行人群分层,并采用先进精准PORT可能会为局部复发高危患者带来获益。
3
不可切除的局部晚期NSCLC
同步放化疗后免疫巩固治疗研究结果更新和探索。PACIFIC研究在2020年《Journal of Thoracic Oncology》上结果更新,Durvalizumab组和安慰剂组中位PFS分别为17.2个月和5.6个月(HR=0.51;0.41~0.63)[7];在今年ESMO上,PACIFIC研究在万众期待下终于更新了OS数据,中位OS为47.5个月,几乎达到了4年之久,相比安慰剂组的29.1个月,延长了18.4个月,并降低了29%的死亡风险(HR=0.71;0.57~0.88)[8]。亚组分析显示,Durvalizumab巩固治疗可为EGFR野生型和PD-L1≥25%或1%的NSCLC患者带来OS获益,而EGFR突变型和PD-L1<25%的亚组患者不获益。安全性分析显示,Durvalizumab组和安慰剂组在总不良反应(AE)和3/4级AE发生率上略有增加,但在可耐受范围之内。2018年ASCO年会上首次亮相的LUN14-179研究证实了同步放化疗后Pembrolizumab巩固治疗不可切除III期NSCLC患者的疗效和安全性,2020年Cancer杂志更新了结果[9],中位TMDD为30.7个月;中位PFS为18.7个月;中位OS为35.8个月(24.2个月~未达到);预估的1年、2年和3年OS率分别为81.2%、62%和48.5%,3~5级肺炎的发生率与单独放化疗的报道相似。BTCRC LUN 16-081是一项正在进行的II期临床研究,旨在探讨Nivolizumab联合Ipilizumab在局部晚期不可切除NSCLC中的疗效和安全性[10]。从2020 ASCO年会报道的初步安全性结果看,Nivolizumab巩固维持安全性尚可,但Nivolizumab联合Ipilizumab的巩固方案3级以上肺炎发生率偏高(达20%),因此如何在PACIFIC模式上做加法,又要兼顾安全性,将是未来探索的重点。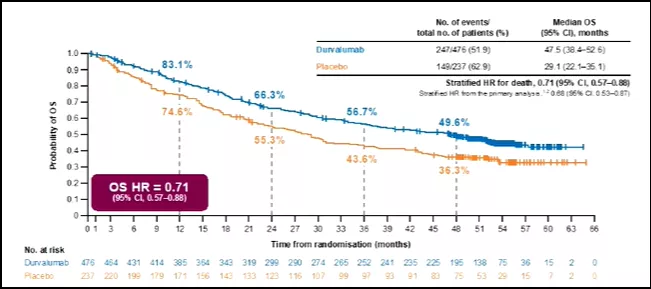
图1. 2020 ESMO大会更新PACIFIC研究4年生存数据
免疫治疗前移策略初步抗肿瘤活性良好,安全可耐受。2020年ASCO年会报道了正在进行的KEYNOTE-799 II期临床研究[11]和II期AFT-16研究[12]。KEYNOTE-799旨在探讨pembrolizumab联合同步放化疗治疗局部晚期不可切除NSCLC的疗效和安全性[11]。患者第一周期进行免疫联合化疗(A组:n=112, NSCLC, 紫杉醇联合铂类化疗;B组,n=53,非鳞NSCLC,培美曲塞联合铂类化疗),在第2-3周期开始免疫同步放化疗,后行免疫巩固。初步结果证实,Pembrolizumab +CCRT在不可切除的局部晚期III期NSCLC的患者中显示出良好的抗肿瘤活性(两组ORR分别为为67%和56.6%,6个月PFS率分别为81.4%和85.2%,6个月OS率分别为87.2%和94.8%),且安全可耐受。AFT-16研究探索了根治性放化疗前后给予Atezolizumab治疗不可切除III期NSCLC的疗效[12],研究纳入64例患者,12周DCR率为77.7%,PR率30.7%,SD率为46.8%,患者耐受性良好。这一崭新的免疫前移的联合治疗策略,拓宽了免疫治疗思路,期待在III期研究中继续验证其疗效和安全性。RT+TKI改善局部晚期EGFR突变NSCLC生存。2020年ASCO年会中来自医科院肿瘤医院的一项真实世界研究,旨在探讨局部晚期EGFR突变NSCLC的最佳治疗策略[13]。该研究探讨了3种治疗模式:RT+TKI、单纯CRT、upfront TKI(局部进展后再行RT)。367名患者纳入分析,中位随访40.8个月。相比于upfront TKI组,RT+TKI组PFS(HR=0.57; 0.41 to 0.78 )和OS(HR=0.61; 0.39 to 0.97) 显著提升;而相对于CRT组而言,RT+TKI组PFS (HR=0.38; 0.27 to 0.54 )显著提升,而 OS (HR=0.66; 0.40 to 1.11)未明显获益。2020年在《Int J Radiat Oncol Biol Phys》发表了对比TKI同步放疗与同步放化疗疗效的国内多中心随机对照RECEL研究,结果显示,与同步放化疗组相比,厄罗替尼+放疗组中位PFS显著延长(中位PFS:24.5个月 vs. 9.0个月;HR=0.104,P<0.001),两组毒性反应发生率相似[14]。另一项探索放化疗+奥希替尼巩固治疗的LAURA研究正在进行中,期待未来该研究结果会给EGFR突变阳性、III期、不可切除NSCLC患者提供更多的治疗方案证据。局部晚期EGFR突变NSCLC最佳治疗模式尚未确定,放疗联合TKI值得进一步探索,未来可期。
放疗剂量及放疗技术对局晚NSCLC生存影响。2015年在《Lancet Oncology》报道了令人震惊和遗憾的RTOG 0617初期结果[15],和标准剂量60Gy组相比,高剂量74Gy组的生存反而更差,不良反应更多,同步放化疗(CRT)基础上联合西妥昔单抗未带来额外生存获益。近期,RTOG 0617研究的长期随访数据在JCO上发表[16],60Gy组的生存显著优于74Gy组(5 year OS,32.1% vs. 23%;中位OS,28.7月 vs. 20.3月,P=0.007),联合西妥昔单抗在增加毒性的同时未见生存改善。安全性上,60Gy组≥3级吞咽困难/食管炎和5级治疗相关不良反应发生率显著低于74Gy组。2020年ASCO报道的CRTOG1601研究[17],探索了PET/CT引导的个体化自适应放疗剂量分割模式(放疗前半程:GTV 2.2-2.4Gy/f,PTV 2.0Gy/f;放疗后半程:GTV 2.2-3.8Gy/f,PTV 2.0Gy/f)对比标准剂量分割模式(60Gy/2Gy/30f)的疗效和安全性。共入组226例拟行根治性放化疗的局部晚期NSCLC患者,中位PFS分别为15.1个月和11.6个月(P=0.001);中位OS分别为44.6个月和28个月(P=0.001),个体化自适应放疗有望成为个体化增量放疗的有效方法。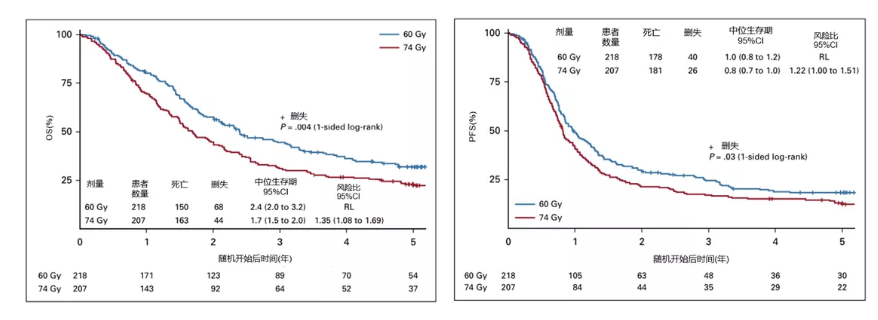
图2. RTOG 0617研究中60Gy组的生存显著优于74Gy组
4
晚期NSCLC
放疗助力免疫治疗,为晚期NSCLC带来获益。来自荷兰的PEMBRO-RT[18]和美国MDACC的两个小样本研究中,均发现放疗联合免疫治疗(pembrolizumab)较单纯免疫治疗为晚期NSCLC带来潜在获益,但是差异并不显著,2020年《Lancet Resp Med》杂志发表了基于两项随机研究的汇总分析[19]。研究包括148例患者,中位随访时间33个月。结果发现,pembrolizumab组和pembrolizumab联合放疗组中位PFS分别为4.4个月和 9.0个月(HR=0.67,p=0.045);中位OS分别为8.7个月和19.2个月(HR=0.67,p=0.0004),且联合治疗组未发现新的安全毒性事件。2020年ASCO大会报道一项探索同步或序贯nivolizumab、ipilimumab联合SBRT治疗IV期NSCLC的I期临床研究(COSINR)[20],研究入组35名晚期NSCLC患者,中位随访为15月,SBRT(1-4个病灶)同步双免疫组与SBRT(1-4个病灶)后双免疫维持组的中位PFS分别为6.2月和5.9月。因此对于晚期NSCLC,I-SBRT治疗结果值得肯定。

图3. 放疗联合免疫治疗改善晚期NSCLC生存的汇总分析
TKI联合放疗改善EGFR突变寡转移NSCLC患者生存。对于敏感基因突变的寡转移NSCLC患者的治疗,既往II期研究及回顾性研究提示积极的局部处理具有重要意义。2020年ASCO年会汇报了来自中国的III期SINDAS研究中期结果[21],探讨了一线TKI联合放疗对比单纯TKI治疗的疗效和安全性。结果显示,单纯TKI组与联合治疗组的中位PFS分别为12.5个月和20.2个月(HR 0.6188;P<0.001)。中位OS分别为17.4个月和25.5个月(HR 0.6824;P<0.001),因此,TKI联合放疗显著改善了EGFR突变阳性寡转移肺腺癌患者的PFS和OS,成为潜在治疗方案。5
SCLC
CCRT联合双免疫巩固治疗未能为LD SCLC带来获益。对于LD SCLC患者,同步放化疗是患者的标准治疗。2020年ESMO年会报道了一项随机、II期的ETOP/IFCT 4-12 STIMULI试验[22],旨在探索CCRT未进展患者,接受Ipilimumab+Nivolumab巩固治疗的疗效及安全性。研究纳入153例患者,双免巩固与观察组中位PFS分别为10.7个月和14.5个月(HR=1.02),中位OS分别为未达到和31.6个月(HR=1.06,P=0.83),≥3度不良反应发生率分别为62%和25%。因此,对于LD SCLC,接受CCRT后未进展患者,双免疫巩固治疗未能获益。高剂量TRT疗效显著,LD-SCLC延长中位OS近一倍。同步放化疗中45 Gy/30 f BID是目前最受推荐的胸腔放疗(TRT)方案。高剂量TRT可能会延长生存期,但迄今尚未在随机试验中证实。2020年ASCO大会中报道了一项旨在探索每日两次高剂量TRT(60 Gy/40 f)的可行性和疗效的研究[23]。研究共入组176名LD SCLC的患者,给予4个疗程的铂类/依托泊苷治疗,并随机分配接受60 Gy或45 Gy TRT BID。结果表明,60 Gy BID组的2年生存率显著高于45 Gy BID组(73% vs. 46%, p=0.001),且中位OS期更长(42月vs. 23 月, HR=0.63, p=0.031)。而且与标准剂量相比,较高的TRT剂量未带来更大的毒性。该研究为后期开展Ⅲ期研究提供了依据。6
放射防护和放射增敏
来自2020年ASTRO会议上的一项Ib/2a期临床研究,探讨了放射防护剂-纳米染料木素(BIO 300)在21名II、III及寡转移的NSCLC同步放化疗中的安全性和有效性[24],中位随访时间15.9个月。研究结果显示,标准同步放化疗联合BIO 300治疗患者的耐受性良好,≥2级的血液学、肺、食管毒性均低于历史数据,减少治疗中断;中位PFS为15.6个月,远期生存可期,可进一步开展随机对照研究。同样来自2020年ASTRO年会中,针对局部晚期NSCLC的II期随机对照研究显示,同步放化疗联合二甲双胍降低患者生存,且增加治疗相关不良反应[25]。放射防护和放射增敏研究仍有较大的探索空间。总结
放疗联合免疫治疗仍是热点:早期NSCLC I-SBRT模式安全可行,期待后续报道;新辅助免疫治疗同步放化疗虽然提高pCR率,但是毒副反应严重,仍需慎重考虑;针对不可手术局晚期NSCLC,PACIFIC研究和LUN14-179研究结果更新,进一步奠定放化疗后免疫巩固标准治疗地位,但双免疫巩固治疗中断率高,模式仍需探索;根治性放化疗中免疫治疗前移在局部晚期NSCLC中初步效果显现,期待更新的追踪报道;SBRT助力免疫治疗逆转耐药,为晚期NSCLC患者带来获益。对于LD SCLC,CCRT联合双免疫巩固治疗未改善患者生存。 R0切除的III期N2 NSCLC的PORT仍需新的证据支持;对于EGFR突变的局部晚期及寡转移NSCLC患者,放疗联合靶向治疗带来显著生存获益;强化放疗剂量非但尚未改善局晚NSCLC患者生存,还带来毒性反应增加;个体化自适应放疗有望成为个体化增量放疗的有效方法;高剂量胸部放疗使LD SCLC患者生存显著延长。期待更多放射防护和放射增敏相关研究报道。
参考文献
[1] Gao S, Li N, Wang S, et al. Lung cancer in people’s republic of China[J]. J Thorac Oncol, 2020, 15(10):1567-1576.
[2] Atezolizumab plus stereotactic ablative therapy for medically inoperable patients with early-stage non-small cell lung cancer. 2020 ASCO Abstract 9011.
[3] Joe Y. Chang, et al. I-SABR phase II randomized study of nivolizumab immunotherapy and stereotatic ablative radiotherapy in early stage NSCLC: Interim analysis adverse effects. 2020 ASCO Abstract 9035.
[4] A phase I safety and feasibility study of neoadjuvant chemoradiation plus pembrolizumab followed by consolidation pembrolizumab in resectable stage IIIA non-small cell lung cancer. 2020 ASCO Abstract 9009.
[5] Role of postoperative radiotherapy in pathologic stage IIIA (N2) non-small cell lung cancer in a prospective nationwide oncology outcomes database. Alex H, JTO Vol. 12 No.2:302-313.
[6] C. LePe Choux, et al. An international randomized trial, comparing post-operative conformal radiotherapy (PORT) to no PORT, in patients with completely resected non-small cell lung cancer (NSCLC) and mediastinal N2 involvement: Primary end-point analysis of Lung ART. 2020 ESMO Abstract LBA3_PR
[7] Gray JE, Villegas A, Daniel D, et al. Three-Year Overall Survival with Durvalumab after Chemoradiotherapy in Stage III NSCLC-Update from PACIFIC. J Thorac Oncol. 2020 Feb;15(2):288-293.
[8] Corinne Faivre Finn, et al. LBA49-Durvalumab after chemoradiotherapy in stage III NSCLC: 4-year survival update from the phase III PACIFIC trial. 2020 ESMO Abstract LBA49.
[9] Durm GA, Jabbour SK, Althouse SK, et al. A phase 2 trial of consolidation pembrolizumab following concurrent chemoradiation for patients with unresectable stage III non-small cell lung cancer: Hoosier Cancer Research Network LUN 14-179. Cancer. 2020 Oct 1;126(19):4353-4361.
[10] Consolidation nivolumab /ipilimumab versus nivolumab following concurrent chemotherapy in patients with unresectable stage III NSCLC: A planned interim safety analysis from the BTCRC LUN 16-081 trial. 2020 ASCO Abstract 9010.
[11] Jabbour SK,et al. Phase Ⅱ study of pembrolizumab (pembro) plus platinum doublet chemo- therapy and radiotherapy as first-line therapy for unresectable,locally advanced stage Ⅲ NSCLC:KEYNOTE-799.2020 ASCO Abstract 9008.
[12] AFT-16: Phase II trial of atezolizumab before and after definitive chemotherapy (CRT) for unresectable stage III non-small cell lung cancer (NSCLC). 2020 ASCO Abstract 9045.
[13] Real-word treatment patterns and clinical outcomes in EGFR-mutant unresectable locally advanced NSCLC (LA-NSCLC): A retrospective multicenter study of 367 patients. 2020 ASCO Abstract 9047.
[14]Xing L, Wu G, Wang L,et al. Erlotinib Versus Etoposide/Cisplatin With Radiation Therapy in Unresectable Stage III Epidermal Growth Factor Receptor Mutation-Positive Non-Small Cell Lung Cancer: A Multicenter, Randomized, Open-Label, Phase 2 Trial. Int J Radiat Oncol Biol Phys. 2020 Nov 19:S0360-3016(20)34548-X.
[15] Bradley JD, Paulus R, Komaki R, et al. Standard-dose versus high-dose conformal radiotherapy with concurrent and consolidation carboplatin plus paclitaxel with or without cetuximab for patients with stage IIIA or IIIB non-small-cell lung cancer (RTOG 0617): a randomised, two-by-two factorial phase 3 study. Lancet Oncol. 2015 Feb;16(2):187-99.
[16] Bradley JD, Hu C, Komaki RR, et al. Long-Term Results of NRG Oncology RTOG 0617: Standard- Versus High-Dose Chemoradiotherapy With or Without Cetuximab for Unresectable Stage III Non-Small-Cell Lung Cancer. J Clin Oncol. 2020 Mar 1;38(7):706-714.
[17] Qingxi Yu, et al. Individual adaptive radiotherapy versus standard radiotherapy with chemotherapy for patients with locally advanced non-small cell lung cancer: A multicenter randomized phase III clinical trail CRTOG 1601. 2020 ASTRO S105.
[18] Theelen WSME, Peulen HMU, Lalezari F, et al. Effect of Pembrolizumab After Stereotactic Body Radiotherapy vs Pembrolizumab Alone on Tumor Response in Patients With Advanced Non-Small Cell Lung Cancer: Results of the PEMBRO-RT Phase 2 Randomized Clinical Trial. JAMA Oncol. 2019 Jul 11;5(9):1276–82.
[19] Theelen WSME, Chen D, Verma V, et al. Pembrolizumab with or without radiotherapy for metastatic non-small-cell lung cancer: a pooled analysis of two randomised trials. Lancet Respir Med. 2020 Oct 20:S2213-2600(20)30391-X.
[20] A randomized phase I trial to evaluate concurrent or sequential ipilimumab, nivolumab, and stereotactic body radiotherapy in patients with stage IV non-small cell lung cancer (COSINR Study), 2020ASTRO S72.
[21] First-line tyrosine kinase inhibitor with or without aggressive upfront local radiation therapy in patients with EGFR ilogometastatic ono-small cell lung cancer:Interim results of a randomized phase III, open-label clinical trial (SINDAS)(NCT02893332). 2020 ASCO Abstract 9508.
[22] Consolidation nivolumab and ipilimumab vs. observation in limited stage SCLC after chemo-radiotherapy-Result from the randomized phase II ETOP/IFCT 4-12 STIMULI trial. 2020 EMSO Abstract LBA84.
[23] Randomized phase II trial comparing the efficacy of standard-dose with high-dose twice-daily thoracic radiotherapy (TRT) in limited disease small cell ling cancer (LD SCLC). 2020 ASCO Abstract 9007.
[24] C.B. Simone II, et al. A phase 1b/2a study evaluating the pharmacokinetic, safety, and efficacy of nanogenistein in combination with chemoradiotherapy for non-small cell lung cancer. 2020 ASTRO S103.
[25] T. Tsakiridis, eRandomized phase II trial of metformin in combination with chemoradiotherapy (CRT)in locally advanced non-small cell lung cancer (LA-NSCLC): OCOG-ALMERA trial (NCT02115464),2020ASTRO S104.
更多【盘点2020】,敬请期待!