中国抗癌协会
立即下载App纳米肿瘤学前沿进展篇——《中国恶性肿瘤学科发展报告(2024)》

1. 概述
癌症是严重威胁人类健康的重大疾病。世界卫生组织国际癌症研究机构(IARC)与国家癌症中心最新数据显示:我国癌症发病率和死亡率在近年来持续攀升,2022年,中国新增恶性肿瘤病例约482.5万例,占全球总发病数的24.2%。癌症死亡病例257万例,占全球病例的26.5%。其中,肺癌、结直肠癌、甲状腺癌、肝癌和胃癌是中国最常见的五种恶性肿瘤,合计占中国全部恶性肿瘤新发病例的57.4%。肺癌、肝癌、胃癌、结直肠癌和食管癌,是中国人群死亡率前5位的疾病,合计死亡数量占全部癌症死亡总数的67.5%。癌症防治形势依然严峻。中国抗癌协会提出“肿瘤防治,赢在整合”的理念,积极推动与肿瘤研究相关的学者进行学科交叉以及优势资源整合,以此共同提升我国肿瘤防治的水平,为实现“健康中国 2030”的战略目标提供服务。
自本世纪初起,纳米科学与肿瘤学均实现了迅猛发展。鉴于纳米颗粒所独具的尺度效应优势,以及临床上对于肿瘤分子影像和精准药物递送的要求不断提高,这两个学科之间的交融日益紧密,进而催生出一批基于纳米技术的分子影像造影剂和治疗药物。在纳米肿瘤诊疗技术持续进行“从实验台到病床”的大量尝试过程中,人们对纳米诊疗制剂临床优势的生物学基础以及优势应用场景的认识也在不断深化,并且持续推动着纳米诊疗新技术和制剂的发展。本报告将主要聚焦于纳米材料在肿瘤治疗领域的最新进展。

5. 2024年中国纳米肿瘤学学科十大前沿进展(新成果、新技术、大事记) (1)小分子自堆叠的纳米探针用于活体高灵敏拉曼成像 上海交通大学肖泽宇教授团队的研究揭示了一类特定结构的小分子,通过自身的有序堆叠 (据此构建DSPE-PEG的胶束纳米探针),实现了活体无创的对微小血管、淋巴回流的高灵敏拉曼成像,这是传统依赖金银等基底材料的表面增强拉曼散射(SERS)探针技术无法实现的。该纳米探针不依赖金、银等基底材料,可以经肝脏代谢,粪便消除,提升了安全性。并提出一种新的拉曼散射增强机理-“堆叠诱导电荷转移增强拉曼散射(SICTERS)”。该研究为设计生物安全的高灵敏拉曼影像探针,并推进拉曼影像分析技术的活体生物医学应用提供了新思路。相关研究成果以Self-stacked small molecules for ultrasensitive, substrate-free Raman imaging in vivo为题,发表在Nature Biotechnology杂志上[8] 。
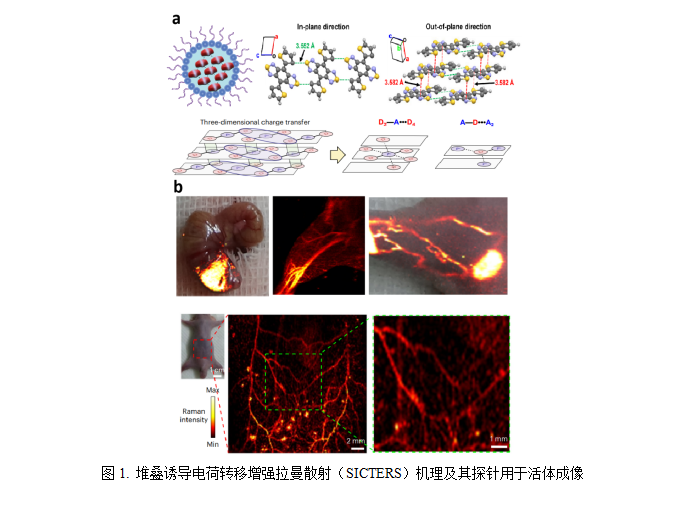
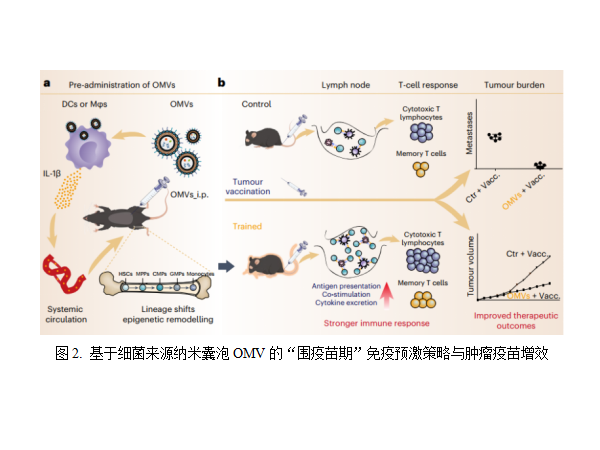
(2)基于细菌来源纳米囊泡的免疫预激与肿瘤疫苗增效
肿瘤疫苗是目前肿瘤免疫治疗领域的热点,它是利用鉴定出的肿瘤抗原刺激免疫系统,从而产生针对肿瘤细胞的特异性免疫反应,实现肿瘤细胞杀伤和预防复发转移。国家纳米科学中心聂广军研究员和赵潇研究员团队提出了一种利用细菌来源的纳米囊泡对机体免疫系统进行功能强化,从而增强后续肿瘤疫苗免疫治疗效果的“围疫苗期”免疫预激策略,相关研究成果以Bacteria-derived nanovesicles enhance tumour vaccination by trained immunity为题,发表在Nature Nanotechnology杂志上。该工作提出,肿瘤疫苗研究不应只局限于疫苗本身的设计优化,而忽略机体本身的免疫系统功能对肿瘤疫苗效果的影响;要以人为本,肿瘤疫苗是“标”和“臣”,患者的身体是“本”和“君”,只有标本兼治和君臣佐使同时发挥作用,才能够有效地对抗肿瘤[9] 。
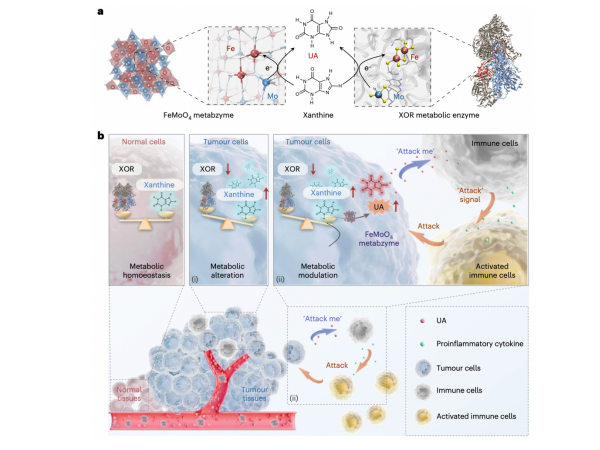
3)人工代谢酶实现肿瘤特异性代谢治疗
代谢异常是肿瘤发生和发展的普遍且关键特征。目前,一些抗肿瘤代谢药物通过调控肿瘤异常代谢通路,能够一定程度抑制肿瘤生长。然而,现有代谢治疗药物存在体内半衰期短、脱靶效应明显和容易干扰正常细胞代谢等问题。上海交通大学变革性分子前沿科学中心凌代舜教授团队和上海交通大学医学院李方园教授团队首次聚焦肿瘤广谱代谢标志物作为代谢免疫检查点,提出全新的肿瘤代谢激活免疫治疗策略。相关研究成果以An artificial metabzyme for tumour-cell-specific metabolic therapy为题,发表在Nature Nanotechnology杂志上。研究团队创新合成了一种模拟黄嘌呤氧化酶(xanthine oxidoreductase,XOR)中铁和四面体钼原子构象的的FeMoO4生命体系催化剂,称为“人工代谢酶”。该人工代谢酶能够催化肿瘤细胞内黄嘌呤转化为尿酸;尿酸分子作为新的“定位和激活信号”,实现激活免疫系统的功能,诱导其附近的巨噬细胞向M1表型极化,使其特异性识别并吞噬肿瘤细胞,从而精准地实现肿瘤特异性的代谢激活免疫治疗[10] 。
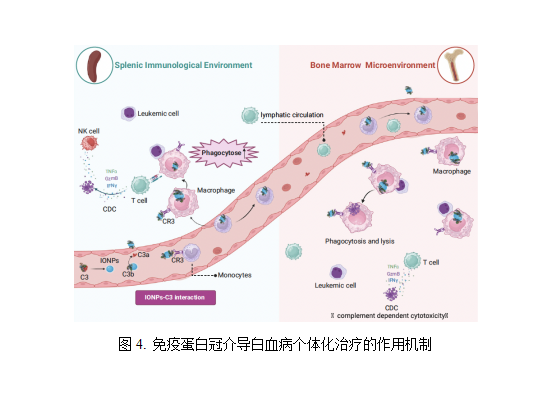
4)免疫蛋白冠介导白血病个体化治疗
“蛋白冠”改变医用材料原有理化性质,疾病的个体化病理环境使得纳米材料的体内命运更加复杂。吉林大学陈芳芳教授研究团队尝试在充分理解纳米材料本征性质对免疫蛋白冠装载及其介导的免疫应答效应的基础上,针对髓系白血病的免疫病理特征,制定白血病个性化、精准治疗策略。解析多种官能团对铁纳米材料补体活化、蛋白冠装载、免疫应答的影响及机制,发展了抗白血病免疫治疗新方案,建立了蛋白冠介导白血病“双重”靶向递药新策略。IRON-COOH通过替代途径激活补体并形成补体蛋白冠,补体蛋白冠介导纳米材料级联活化固有免疫及适应性免疫,发挥抗白血病作用。另外,还可以通过补体蛋白冠、转铁蛋白冠与髓系白血病细胞膜上的补体受体、转铁蛋白受体结合,靶向递送化疗药物诱导白血病细胞凋亡,通过双重机制对高表达补体受体及转铁蛋白受体的髓系白血病实现个体化精准治疗。相关研究成果发表在Nature Communication和Nano Letters杂志上[11-12]。
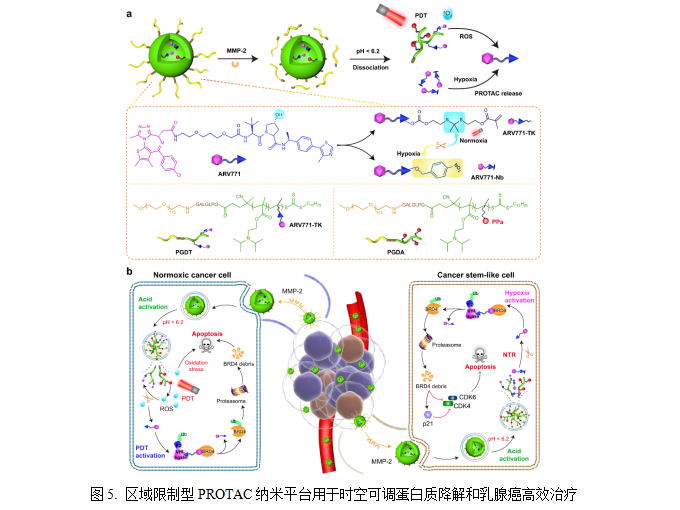
5)区域限制型PROTAC纳米平台用于时空可调蛋白质降解和乳腺癌高效治疗
肿瘤干样细胞(CSCs)具有自我更新和转移特性,在肿瘤发生和发展中起着关键作用,其通常对常规化疗和放疗具有抵抗性,严重制约肿瘤治疗效果。因此,全面清除肿瘤细胞和肿瘤干样细胞对抑制肿瘤生长并防止复发十分重要。基于此,中国科学院上海药物研究所于海军研究员联合华东师范大学徐志爱教授等团队,创新性报道了一种区域限制型蛋白质降解靶向嵌合体(Proteolysis-Targeting Chimeras , PROTAC)纳米平台,用于时空可调蛋白质降解和增强癌症治疗,适用于不同的肿瘤模型,具有良好的抗肿瘤效应。相关研究以A region-confined PROTAC nanoplatform for spatiotemporally tunable protein degradation and enhanced cancer therapy为题发表在Nature Communication。该PROTAC纳米平台集成了活性氧(ROS)激活和乏氧响应的PROTAC前药,用于精准调控肿瘤细胞内BRD4的表达以高效抗肿瘤。这些PROTAC纳米颗粒通过对肿瘤组织过表达MMP-2酶的响应性实现肿瘤组织的蓄积和深部渗透,并在光照作用下常氧区域产生大量ROS,激活ROS响应的PROTAC前药以实现靶蛋白降解。同时,乏氧激活型PROTAC前药在缺氧区域被还原为PROTAC分子而实现靶蛋白降解以清除肿瘤细胞,高效抑制肿瘤生长并防止复发[13]。
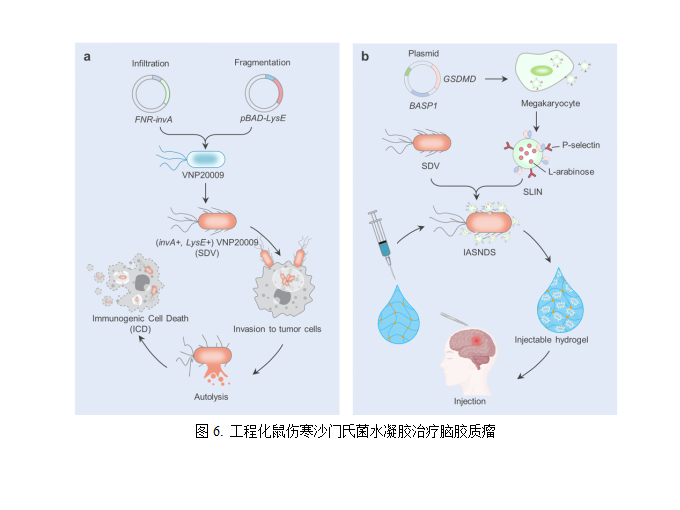
(6)工程化鼠伤寒沙门氏菌水凝胶治疗脑胶质瘤
多形性胶质母细胞瘤(GBM)是神经外科最常见的颅内恶性肿瘤,其强侵袭性使得传统手术治疗难以彻底切除肿瘤组织,抑制性免疫微环境导致肿瘤极易局部复发。因此,开发新型的抗肿瘤免疫策略来追踪和根除术后残留的肿瘤细胞,对预防GBM术后复发至关重要。先天性免疫和适应性免疫的协同作用可以增强机体对肿瘤的免疫应答,可用于对抗肿瘤细胞的增殖和扩散,提高治疗效果。研究发现特定细菌可以在肿瘤细胞内定植、增殖,经编辑后可释放药物,从而对肿瘤细胞产生直接或间接的杀伤作用。同时细菌表面或分泌的多种抗原可与机体的固有或适应性免疫相关受体结合,刺激机体免疫记忆的形成,抑制肿瘤复发。因此,山东大学姜新义教授团队提出,通过联合应用自裂解沙门氏菌载体和可注射的ATP响应水凝胶,有效募集免疫细胞到达肿瘤局部,逆转肿瘤局部的免疫抑制微环境,形成免疫记忆,最大程度抑制GBM术后复发。相关研究以Stimulation of tumoricidal immunity via bacteriotherapy inhibits glioblastoma relapse为题发表在Nature Communication。该研究利用减毒鼠伤寒沙门氏菌(VNP20009)背包携带功能化外泌体开发了一种沙门氏菌自裂解体系(IASNDS),进入细胞后可响应性启动细菌裂解,释放细菌组分,引起抗肿瘤免疫反应,同时规避细菌感染风险。此外,该研究利用ATP响应性水凝胶在GBM术后空腔内共递送免疫佐剂和IASNDS,IASNDS可激活先天性免疫反应,协同GBM细胞焦亡释放的细菌成分和炎性因子重塑GBM免疫微环境,增强抗原递呈,持续激活适应性免疫反应,用于治疗GBM术后复发。该细菌-凝胶递送系统为抑制GBM术后复发的临床难题提供一种可行的方案,未来可广泛适用于其他易复发且免疫浸润不良的恶性肿瘤[14]。
(7)可逆光开关蛋白组装体用于肿瘤体内光声成像
光声(PA)成像结合光学与超声成像优势,但内源性生物分子吸收强光产生背景噪声影响其灵敏度。为消除此噪声,深圳大学黄鹏教授团队利用AlphaFold开发可逆光开关蛋白组装体探针(DrBphP-CBD),由光敏模块DrBphP与胶原结合域CBD融合而成,该组装体探针的尺寸在100纳米左右,对胶原有高亲和力及显著光开关对比度。小鼠肿瘤模型实验显示,该探针静脉注射后肿瘤靶向性强、滞留时间长,通过背景抑制技术显著降低噪声,提升PA成像对比度。DrBphP-CBD作为高特异性光声对比剂,有望提高临床光声成像诊断精度,促进癌症早期检测与治疗监测发展。相关研究成果以Reversibly photoswitchable protein assemblies with collagen affinity for in vivo photoacoustic imaging of tumors为题,发表在Science Advances杂志上[15]。

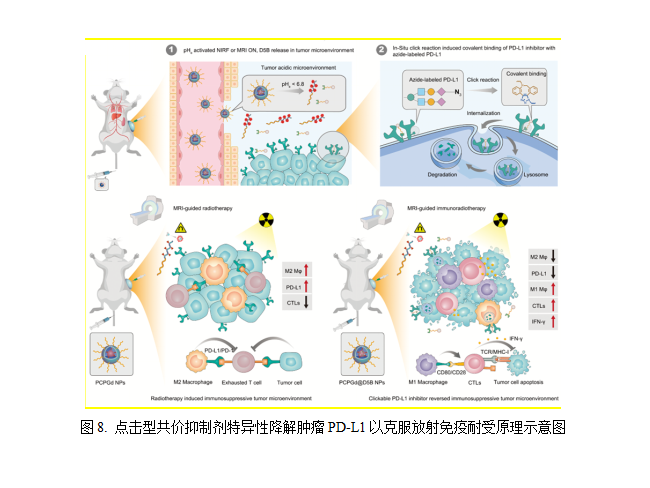
(8)点击型PD-L1抑制剂克服肿瘤免疫耐受
如何开发肿瘤特异性的小分子PD-L1抑制剂,是改善抗肿瘤免疫疗效、避免免疫相关毒副作用的关键挑战。为此,华东师范大学的徐志爱团队在Science Advances发表了题为“Tumor-Specific Delivery of Clickable Inhibitor for PD-L1 Degradation and Mitigating Resistance of Radioimmunotherapy”的研究论文,该研究成果利用糖代谢策略实现代谢活跃的肿瘤细胞和肿瘤相关巨噬细胞的叠氮标记,通过点击化学反应实现了PD-L1抑制剂在肿瘤组织的局部富集,进而特异性降解肿瘤细胞和肿瘤相关巨噬细胞膜表面PD-L1,有效地逆转了放疗诱导的免疫抑制肿瘤微环境,克服放疗免疫耐受,从而抑制肿瘤生长。该成果为肿瘤组织的空间选择性PD-L1降解提供了一种新的策略,并为开发肿瘤膜蛋白共价抑制剂提供了新思路[16]。
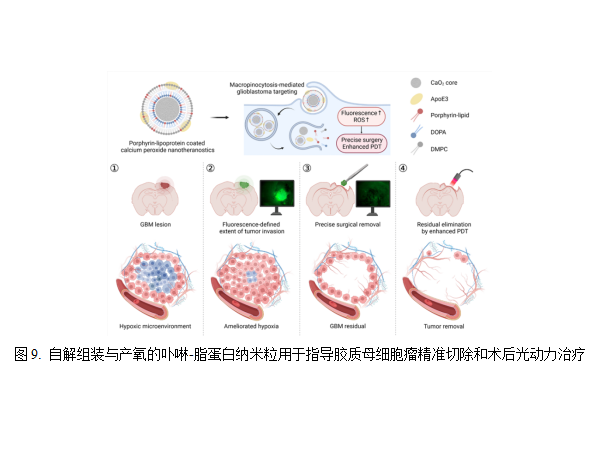
(9)自解组装与产氧的卟啉-脂蛋白纳米粒用于胶质母细胞瘤一体化诊疗平台 上海交通大学高小玲教授研究团队开发了一种包裹过氧化钙的自解聚型卟啉脂蛋白,利用过氧化钙内核减少卟啉脂质的荧光自淬灭,并通过巨胞饮途径快速“点亮”胶质瘤组织,实现荧光引导下胶质瘤手术切除。过氧化钙内核可缓解肿瘤缺氧,实现低剂量光强下对术后残余灶追加光动力治疗。该研究作为一种一体化诊疗平台,可用于指导胶质瘤精准切除和术后光动力治疗,为胶质瘤的综合治疗提供新策略。相关研究成果以Self-Disassembling and Oxygen-Generating Porphyrin-Lipoprotein Nanoparticle for Targeted Glioblastoma Resection and Enhanced Photodynamic Therapy为题,发表在Advanced Materials杂志上[17]。
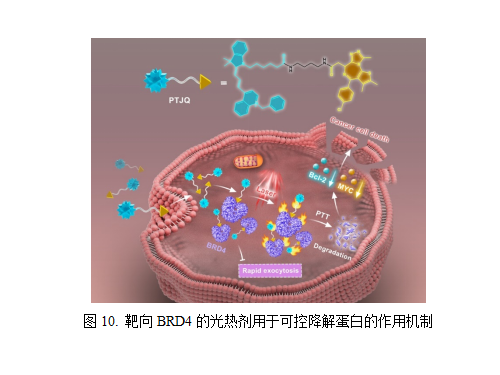
(10)一种靶向BRD4的光热剂用于可控降解蛋白 BET家族蛋白作为表观遗传调控蛋白和转录调控蛋白,在细胞生长和细胞周期的正常进程中起着至关重要的作用。其中,BRD4蛋白是家族中最重要的蛋白,研究最为广泛。目前开发的BRD4蛋白抑制剂存在抗肿瘤活性低、耐药性等挑战,因此,开发新颖的蛋白靶向降解策略具有重要意义。2024年,山东师范大学李娜教授研究团队设计合成了一种靶向BRD4蛋白的光热剂用于可控降解蛋白,旨在增强低温光热治疗(PTT)在癌症治疗中的应用。通过将BRD4蛋白抑制剂(JQ-1)结合到光热剂分子上,光热剂可特异性结合BRD4的溴结构域。在低功率密度激光照射下,该光热剂产生的热量可诱导蛋白质降解,直接破坏BRD4结构并抑制其转录调控功能。这种策略不仅延长了光热剂在癌细胞中的滞留时间,而且将蛋白靶向降解过程限制在肿瘤组织中,通过外源信号的帮助,最大限度地减少了对正常组织的副作用。该工作为今后PTT药物的开发提供了一个简单可行的平台。相关研究成果以A BRD4-Targeting Photothermal Agent for Controlled Protein Degradation为题,发表在Angewandte Chemie International Edition杂志上[18]。
【主编】
聂广军 国家纳米科学中心
【副主编】
李亚平 中国科学院上海药物研究所
吴爱国 中国科学院宁波材料技术与工程研究所
陈华兵 苏州大学
赵 征 陕西省肿瘤医院
于海军 中国科学院上海药物研究所
李 娜 山东师范大学
黄 鹏 深圳大学
赵 颖 国家纳米科学中心
陈芳芳 吉林大学
★
参考文献(向上滑动阅览)
[1] Zhang, F., Hu, Q., Li, B., Huang, Y., Wang, M., Shao, S., Tang, H., Yao, Z., Ping, Y.;,Liang, T., A Biomimetic Nanodrug for Eenhanced Chemotherapy of Pancreatic tumors. Journal of Controlled Release 2023, 354, 835-850.
[2] Tan W., Chen S., Xu Y., Chen M., Liao H., Niu C., Temperature-Sensitive Nanocarbon Hydrogel for Photothermal Therapy of Tumors. Int J Nanomedicine. 2023;18:6137-6151
[3] Xie, Y., Sun, Y., Sun, J., Wang, Y., Yu, S., Zhou, B., Xue, B., Zheng, X., Liu, H., Dong, B., Upconversion Fluorescence-based PDT Nanocomposites with Self-oxygenation for Malignant Tumor Therapy. Inorganic Chemistry Frontiers 2023, 10 (1), 93-107.
[4] Wang, Y., Wang, D., Zhang, Y., Xu, H., Shen, L., Cheng, J., Xu, X., Tan, H., Chen, X., Li, J., Tumor Microenvironment-Adaptive Nanoplatform Synergistically Enhances Cascaded Chemodynamic Therapy. Bioactive Materials 2023, 22, 239-253.
[5] Hao, K., Guo, Z., Lin, L., Sun, P., Li, Y., Tian, H., Chen, X., Covalent Organic Framework Nanoparticles for Anti-tumor Gene Therapy. Science China Chemistry 2021, 64 (7), 1235-1241.
[6] Li, Y., Wu, W., Liu, Q., Wu, Q., Ren, P., Xi, X., Liu, H., Zhao, J., Zhang, W., Wang, Z., lv, Y., Tian, B., Sun, S., Cui, J., Zhao, Y., Wu, J., Gao, M., Chen, F., Specific Surface-modified Iron Oxide Nanoparticles Trigger Complement-dependent Innate and Adaptive Antileukaemia Immunity. Nature Communications 2024, 15 (1), 10400.
[7] Huang, H., Chen, Y., Li, L., Zheng, L., A DNAzyme-Based Nanohybrid for Ultrasound and Enzyme Dual-Controlled mRNA Regulation and Combined Tumor Treatment. Advanced Materials 2024, 36, 240903.
[8] https://www.nature.com/articles/s41587-024-02342-9..
[9] https://www.nature.com/articles/s41565-023-01553-6.
[10] https://www.nature.com/articles/s41565-024-01733-y.
[11] https://www.nature.com/articles/s41467-024-54810-0.
[12] https://pubs.acs.org/doi/10.1021/acs.nanolett.4c04429.
[13] https://www.nature.com/articles/s41467-024-50735-w.
[14] https://www.nature.com/articles/s41467-024-48606-5.
[15] https://www.science.org/doi/10.1126/sciadv.adn8274.
[16] https://www.science.org/doi/10.1126/sciadv.adq3940.
[17] https://onlinelibrary.wiley.com/doi/10.1002/adma.202307454.
[18] https://onlinelibrary.wiley.com/doi/10.1002/anie.202403258.