中国抗癌协会
立即下载App胃肠道肿瘤手术安全与质量控制研究进展篇——《中国恶性肿瘤学科发展报告(2024)》

1. 概述
胃肠肿瘤是全球性的健康挑战[1-4],手术干预是治疗胃肠肿瘤的基石[3, 5, 6],但各国的手术安全、质量、经济支出各不相同。长久以来,外科医生和研究人员一直尝试比较不同国家和地区之间的手术安全与质量。既往文献中常使用的衡量指标包括术后并发症、死亡率、非计划二次手术率等[7-14]。然而,由于在手术实践、并发症定义、医疗系统和其他因素方面存在显著差异和变化,对手术安全进行跨地区比较一直难以实现[15-18]。尽管如此,国内外的外科医生和研究人员一直努力应对这一挑战。传统上,常常使用Clavien-Dindo分级系统(Clavien Dindo Classification,CDC)分级系统[19, 20]和并发症综合指数(Comprehensive Complication Index,CCI)[21]对术后并发症的严重程度进行衡量。最近,一些新兴的工具为不同外科实践的质量评估提供了新的思路,例如,国际上多个地区已经采用救援失败(failure to rescue,FTR)[22]、教科书结果(textbook outcome,TO)、benchmark[23]等指标来比较不同中心之间的手术质量[24-26]。此外,关于胃肠手术中最重要的并发症“吻合口漏”的国际共识已经建立[27-29],以协助医疗专业人员在全球范围内进行标准化实践。 近些年,中国在胃肠道肿瘤手术安全与质量控制方面也取得了显著进展。20年前我国胃癌根治手术率<20%,而近年全国多中心数据显示,根治手术率已经提升到95%以上。然而,中国的胃肠肿瘤手术安全与质量控制与国际水平之间的关系尚不明朗。PACAGE(Prevalence of Abdominal Complications After Gastroenterological Surgery)数据库作为国内并发症登记的首次大规模尝试,可以提供中国胃肠肿瘤手术安全与质量控制的一瞥。本行业发展报告将对国内外胃肠肿瘤手术安全与手术质量进行综述,以《手术质量安全提升行动方案(2023-2025年)》为背景,旨在了解我国胃肠外科手术安全的真实水平,比较我国胃肠肿瘤外科手术与国际水平的相似性和差异性,为卫生医疗政策的制定给予最为详实的数据支撑[30-40]。

2. 我国胃肠道手术安全与质量控制研究进展
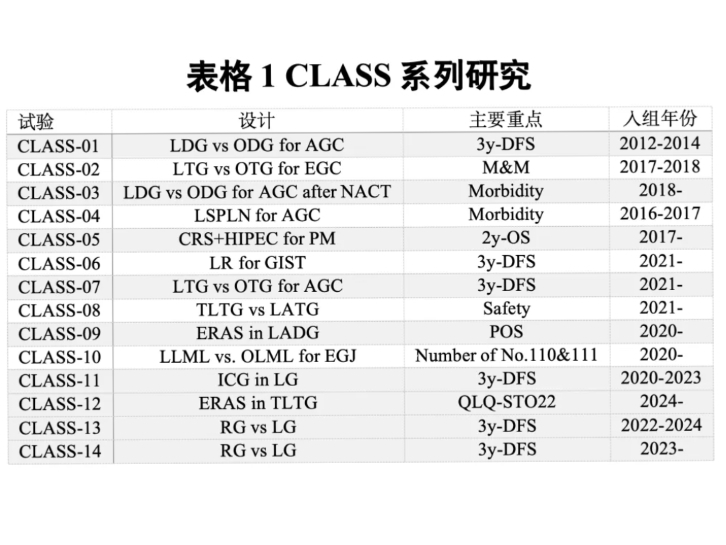
2.1 本学科研究新进展 本文为首次对我国胃肠道手术安全与质量控制行业发展进行报告。纵观近几十年来中国胃肠道肿瘤手术,可以用三个词来概括:起步晚、发展快、成效好。模块化的手术规范加围术期综合治疗,使得中国的胃肠肿瘤预后从上世纪末较低的水平,得到了明显的提高。 初期手术探索与实践:在20世纪末期,中国胃肠道肿瘤手术逐步开展,但由于技术和设备的限制,手术安全和质量面临诸多挑战。彼时,医疗机构缺乏统一的手术规范和标准,手术效果和安全性难以保证。医生们主要依靠个人经验进行手术,术后并发症和死亡率较高。1994年,海军军医大学第一附属医院完成了国内首例腹腔镜辅助远端胃癌根治术。但由于技术的限制,彼时,我国腹腔镜胃癌手术主要集中于较大的临床中心,腹腔镜手术技术缺乏相应的规范化培训,手术入路和流程也大多借鉴开放手术的经验[41]。 标准化和规范化手术:随着医疗技术的进步和医疗设备的更新,从21世纪以来,中国胃肠道肿瘤手术逐渐进入标准化和规范化阶段。国家和各地卫生部门开始制定和推广手术操作规范和指南,以提高手术的安全性和质量。从2004年开始,通过全国范围内的巡讲,季加孚教授等专家使D2根治性切除术成为国内胃癌手术的标准,并于2011年被纳入卫生部诊疗规范和首部中国版胃癌临床实践指南[42];根据胃肠联盟的全国调查数据,目前中国主要中心D2手术的死亡率已降至0.24%,达到了国际一流水平。2007年由中华医学会外科学分会腹腔镜与内镜外科学组制定了国内首部《腹腔镜胃恶性肿瘤手术操作指南(2007版)》,该指南对腹腔镜胃癌手术的适应证和禁忌证、手术原则、手术操作步骤等内容进行了细致阐述,指南的发表也加速了胃癌手术微创化的进程。 手术质量控制体系的建立:随着医疗质量管理理念的引入,中国逐步建立了系统的手术质量控制体系。2009年,卫生部印发了《医院手术部(室)管理规范(试行)》的通知[43],明确了手术安全管理的具体要求。同年,卫生部印发了《医疗质量控制中心管理办法(试行)》[44],对全国省级以上医疗质量控制中心的规划、设置、考核、管理等作出了明确规定。各地按照《医疗质量控制中心管理办法(试行)》[45]有关要求,结合当地实际情况,积极推进医疗质量控制中心建设和管理工作,在规范诊疗行为,提高诊疗水平,保障医疗质量和医疗安全等方面发挥了积极作用。2013年,国家癌症中心在卫生健康委的直接领导下成立了国家肿瘤质控中心,极力推行肿瘤单病种质量控制以及各种癌症的规范化诊疗行为,强化三级质量控制体系;提升专业水平,规范医疗行为;促进诊疗同质化,从指南到诊疗过程进行严格的规范化要求,开展单病种质量控制[46]。据此,省级和有条件的地市级卫生计生行政部门组建相应级别、专业的质控组织,开展医疗质量管理与控制工作。 2.2 国内相关重大计划和研究项目 从2009年至今,中国专家团队陆续开展了11项CLASS研究(表格1)。其中,CLASS-01研究,是全球第一个对比进展期胃癌采用腔镜手术和开放手术的研究,证实了微创手术的疼痛轻、恢复快,治疗的效果和开腹手术类似,获得了国际同行的认可[47, 48]。自2015年成立以来,中国胃肠肿瘤外科联盟已收集了超过40万名患者的数据。尽管目前的数据上报以中心为单位,尚未实现如日韩那样以单个患者为单位的数据登记,但由于数据库的庞大规模,以及自2015年以来每年的持续汇报,该数据库逐渐成为反映我国胃肠道诊疗现状的重要工具。自2017年起,中国结直肠癌手术病例登记(Chinese Colorectal Cancer Surgery Database, CCCD)数据库开始了更为个体化的尝试,通过建立CCCD数据库,初步实现了以患者个人为单位的数据登记。这一转变标志着数据收集的精细化和精准化,为进一步提升手术质量和安全性提供了坚实的数据基础。2018年,中国胃肠肿瘤外科联盟发布了首个中国专家共识,《中国胃肠肿瘤外科术后并发症诊断登记规范专家共识(2018版)》[49],这为中国各地区胃肠肿瘤手术并发症的标准化诊断和登记奠定了基础。基于此基础,我们前期启动了前瞻性登记的PACAGE研究,获得了胃肠肿瘤手术安全与质量的全国范围数据[50]。
通过以上几个阶段的发展,中国胃肠道肿瘤手术的安全与质量控制体系日趋完善,为提高手术成功率、减少术后并发症和提升患者预后奠定了坚实的基础。2018年,全球癌症生存分析工作组(CONCORD)在Lancet杂志上发表了全球癌症生存监测的最新分析结果[51],其中特别提到,在中国过去近二十年间,胃癌5年净生存率(five-year net survival)从30.2%至35.9%,提升了18.9%;结肠癌的5年净生存率从51.4%至57.6%,提升了12.1%;直肠癌从49.5%至56.9%,提升了14.9%。这些数据表明,在过去二十年间,中国胃肠肿瘤手术安全与质量控制得到了显著的进步。
2.3 国内重要研究平台与研究团队
1. 中国胃肠肿瘤外科联盟:中国胃肠肿瘤外科联盟由北京大学肿瘤医院、复旦大学附属中山医院等顶尖单位牵头,覆盖全国100余家医院,超40万名胃肠道手术患者,承担着全国范围内胃肠肿瘤手术数据的整合与分析任务。该联盟通过多中心合作,构建了庞大的临床数据库,为我国胃肠肿瘤手术质量与安全控制的宏观把控提供了坚实的数据支撑。联盟成员不仅在制定诊疗规范、推动标准化手术流程方面发挥重要作用,还在国际顶级期刊上发表了多篇高水平论文,极大地提升了国内外对我国胃肠外科水平的认可度。其研究成果对推动手术技术进步、完善围术期管理及降低并发症发生率具有深远的影响,已成为国内外同行共同借鉴的重要平台。
2. CLASS研究组:CLASS(Chinese Laparoscopic Gastrointestinal Surgery Study)研究组是我国率先开展腹腔镜胃肠肿瘤手术随机对照试验的重要团队之一。该团队围绕腹腔镜与开放手术在胃癌等疾病中的疗效进行了系统性研究,其代表性成果(如CLASS-01、CLASS-02等试验)在国际权威期刊上发表,为微创手术在肿瘤治疗中的应用提供了坚实的循证依据。通过严谨的试验设计与多中心数据整合,CLASS研究组不仅推动了腹腔镜手术技术在国内的普及,同时也对国际微创外科的实践产生了积极影响,其成果对改善患者预后和降低手术风险具有示范效应。
3. CCCD研究组:中国结直肠癌手术病例登记(CCCD)研究组致力于通过以患者为单位的数据采集,实现对结直肠癌手术质量的精准评估。该团队依托多中心协作,建立了覆盖全国范围的病例登记系统,确保数据采集的标准化和完整性,为后续进行风险因素分析、疗效评价和长期随访提供了坚实基础。通过对大量病例数据的深入挖掘,CCCD研究组在提高术后并发症预警和改进手术策略方面取得了诸多突破,其研究成果在国内外会议和学术期刊上广泛传播,对推动结直肠癌诊疗指南的制定和更新起到了重要作用。
4. 国家癌症中心:利用全国癌症登记和监测随访体系,构建了一个覆盖31个省、市、自治区的癌症防控信息管理平台。该平台汇聚了海量临床数据,通过实时监测和数据分析,及时掌握各地区手术安全指标、并发症发生率及手术质量动态。借助这一信息化平台,各级医院能够在数据反馈的指导下进行自我改进和风险预警,实现手术质量的精准控制和持续改进。此外,平台的建设还促进了全国范围内不同医疗机构之间的质量对标和经验交流,为优化手术管理流程提供了科学依据,有效推动了我国手术安全和质量控制水平的整体提升。
3. 国内外研究进展比较
3.1 国际手术安全与质量控制学科发展现状
尽管针对胃结直肠癌的治疗手段日渐进步及多样化,外科手术仍然是治愈胃癌和结直肠癌的关键,根治性手术切除仍然是当前多学科诊疗模式中的重要环节。而术后并发症作为衡量手术安全性的关键指标及作为临床研究的终点被越来越多地关注和比较。例如,根据中国胃肠肿瘤外科联盟数据报告(2014-2016),平均并发症发生率为10.24%,而各中心汇报手术并发症发生率差异较大,从0%~33.1%;手术安全性方面,Clavien-Dindo Ⅲb级以上并发症发生率为2.59%,术后30天内病死率0.58%;所有病人术后平均住院日为10.04天,平均住院花费55,362.94元。根据CCCD数据库2022年度报告[52],结直肠癌术后并发症的发生率为10.1%,其中发生率较高的并发症依次为切口部位感染(1.7%)、吻合口漏(1.6%)、其他并发症(1.0%)及肺部感染(1.0%)。从目前其他国家的文献报道来看,胃肠癌术后并发症的发生率在9%-57%之间,大多集中在20%-40%之间[53-60],根据我们之前基于PACAGE数据库的手术质量及安全的相关研究,中国胃肠手术的术后并发症发生率整体与东亚国家相近,这一发现提示中国在胃肠手术质量与安全性方面与国际标准保持一致。
与日韩等东亚国家术后并发症发生率的一致性可能源于以下几点:首先,亚洲人群内部体质指数(Body Mass Index,BMI)整体结构类似,对于亚洲人口的超重和肥胖,国际肥胖工作组(International Obesity Task Force)提出了较低的BMI临界值[61]。根据WHO《2014年全球非传染性疾病现状报告》,亚洲人群的肥胖率也整体接近,显著低于欧美国家[62]。
相比欧美,中日韩在生活方式和饮食习惯上也存在一定的共性,如饮食习惯中膳食纤维的摄入比例更高。膳食纤维是指在胃肠道中不易被人体酶降解的低聚糖和多糖[63]。膳食纤维的细菌发酵主要发生在结肠,并产生代谢物,如短链脂肪酸,供宿主使用[64]。除这些代谢物外,粪便膨胀、对转运时间的影响以及其他尚待证实的机制均表明了膳食纤维对健康的积极影响有关[64, 65]。研究表明,习惯性术前膳食纤维摄入与结直肠癌手术后并发症的风险降低有关[66]。早期在模式动物中的研究也提出:膳食纤维摄入不足会导致粘膜屏障受损,病原体易感性增强[67, 68]。这两种现象都被认为与胃肠手术术后并发症的发病机制有关[69, 70]。
此外,在手术方式选择方面,中日韩也具有更多的相似性。以淋巴结清扫范围为例。在胃癌根治术中,切除肿瘤的同时进行胃周淋巴结清扫已成为公认的手术方式,但对于淋巴结清扫的范围究竟应该多大,在欧美和东亚国家存在很大的差异。在东亚国家如日本,推崇D2淋巴结清扫,2004年,季加孚教授在中国推广的标准术式也是D2手术。而西方国家则更多采用D1淋巴结清扫,认为D1手术和D2手术患者的5年生存率和复发风险差异无统计学意义,且D2术的术后并发症和围手术期死亡率明显升高,因此,在2010年前,西方国家更多采用D1手术[71, 72]。直到2010年,荷兰D1D2研究的15年随访结果发布,发现D2手术可以显著降低胃癌相关死亡率、远期局部复发率和区域复发率,从而奠定了D2淋巴结清扫在西方胃癌根治术中的标准地位[73]。
虽然术后并发症整体和日韩类似,但需要指出的是,依据PACAGE数据库,中国胃肠手术的术后并发症发生率、术后死亡率低于欧美国家。这些差异可能与地区间的医疗实践、患者特征、治疗策略以及并发症的定义和诊断标准的差异有关。
首先,东西方外科医生对术后并发症的诊断标准不同。如术后肠梗阻(postoperative ileus),《中国胃肠肿瘤外科术后并发症诊断登记规范专家共识(2018版)》[49]认为“术后肠道蠕动恢复减慢,以恶心、腹胀、术后恢复排气排便时间延长、无法耐受经口进食为主要表现;须鉴别排除机械性梗阻;无法与胃排空延迟鉴别时可诊断为术后胃肠道功能恢复障碍”。相比之下,西方外科医生认为“术后第4天无排气或排便,无法耐受经口进食” [74]或“需要鼻胃管”[75],这一定义使得西方国家对于术后肠梗阻的报告率显著高于PACAGE数据库。其实,即便是同一国家,不同中心之间登记的术后并发症发生率也存在差异。不同医院、不同医生对于术后并发症的认识以及临床工作中采用的检查及诊断手段都会有所差异,诊断和干预措施的不统一,难免造成各中心记录上报的并发症率存在巨大差异。例如,根据我国胃肠联盟2014-2016的数据报告,胃肠癌术后平均并发症发生率为10.24%,但各中心汇报的术后并发症率差异较大,从0%-33.1%不等[76]。
其次,鉴于国内外胃肠癌发病率的不同、疾病负担不同、手术量的不同等客观差异的存在,不可避免地会出现纳入对象分布不均、时间跨度较大等问题,进而造成并发症报告率的差异。在疾病负担方面,根据WHO国际癌症研究机构的数据,结直肠癌主要聚焦于欧美国家,亚洲国家整体患病率较低[3];而胃癌主要聚焦于中国和其他东亚国家,根据global cancer statistics 2020,大约一半的新发胃癌病例和死亡病例来源于中国[2]。这与我们之前的研究结果一致,即PACAGE数据库报道的并发症发生率与亚洲国家整体类似,而与欧美国家存在较大差异。在风险因素方面,由于东西方接受胃肠肿瘤手术的人群在高龄、肥胖、心血管疾病、贫血等基础疾病上的发病率存在差异,患者术后发生并发症的危险因素也将有所不同,术后发生并发症的比率或也存在实质性的差别[77, 78]。例如,在欧美国家,接受胃肠肿瘤手术的患者中,高龄和肥胖的比例显著高于中国[79-81],而肥胖、高龄以及心血管疾病已被证实将显著增加手术风险[81-88]。这也导致中国相比欧美国家,严重并发症的发生比例较低。未来,通过使用教科书结果(TO)、benchmark可能有助于减少不同地区之间患者基线特征差异的影响。在肿瘤位置方面,欧美国家远端结肠癌发病率较高[89, 90],而亚洲国家近端结肠癌发病率更高[91-94]。而在我们之前的研究中,从右半结肠切除术到横结肠切除术,到左半结肠、乙状结肠切除术,到直肠低位前切除术,吻合口漏的发生率整体呈现递增趋势(图2);即远端结肠术后并发症发生率高于近端结肠的术后并发症,这与欧美国家术后并发症发生率高于亚洲国家的结果保持一致。即便对于同一解剖位置的肿瘤,外科操作也在不同国家和地区之间存在差异,例如保护性造口的利用。在中国,特别是在直肠癌患者中,新辅助治疗后实施保护性造口是一种很普遍的操作[95-97]。在PACAGE数据库中,接受直肠低位前切除术的患者有27.03%实施保护性造口;而对于接受新辅助治疗的患者,保护性造口的比例可以达到43.85%。这是因为中国外科医生更强调术后并发症的预防,而保护性造口可以降低吻合口漏的风险[98-100]。相比之下,欧美国家在是否实施保护性造口则更为保守和谨慎,这种选择主要是源于对术后生活质量的重视[101, 102];虽然不实施保护性造口在某些情况下会增加症状性吻合口漏的风险,但欧美国家的外科医生更重视肠道连续性的保持和远期并发症的降低[103]。即,保护性造口的比例较低,反映出西方实践更强调以患者为中心的医疗,通过减少对额外手术的需求而提高整体手术效果和患者满意度[104, 105]。
3.2 国际重大研究计划和重大研究项目
3.2.1 国际重大研究项目
1. 荷兰DICA(Dutch Institute for Clinical Auditing)
荷兰DICA是一项全国性、覆盖多种侵袭性肿瘤的质量审计项目。DICA涵盖了包括胃癌、结直肠癌、胰腺癌、肝癌等在内的多种癌症类型。通过对患者基本信息、手术过程、并发症及长期预后等数据的系统收集与风险调整,DICA为各医疗机构提供了详尽的质量反馈和对标数据。DICA的持续监测和数据分析一方面产出了大量学术研究,另外也有效促进了手术流程的优化,降低了术后并发症发生率,并为制定国际化手术质量控制标准提供了坚实的证据支持。
以DUCA为例,该数据库为荷兰全国性上消化道癌症审计数据库,目前已实现了患者级的数据登记。建立该数据库旨在对全国的上消化道癌症的手术质量进行审计与监测。 DUCA由前荷兰食管癌小组和胃癌小组发起,并由荷兰外科肿瘤学家协会和荷兰胃肠外科医师协会授权[106, 107]。 2012年后,所有进行上消化道癌症手术的医疗机构均被强制要求参与DUCA的数据登记[107]。DUCA目前包含了超过300个患者变量,主要包括以下3个方面:(1)治疗前的患者和肿瘤特征;(2)患者诊断和治疗相关变量,如病理活检日期、新辅助治疗开始日期、新辅助治疗类型、手术日期、和切除类型等;(3)手术后的临床和病理结果,但由于DUCA聚焦于手术的安全性,因此长期生存目前不在登记范围内[108]。DUCA的并发症登记包括了3个级别的135个变量,其中一级变量是总并发症;二级变量是对相似的并发症进行汇总登记,包括肺部、心脏、胃肠道、泌尿系统、神经或精神相关并发症,以及血栓栓塞、感染、手术切口和乳糜漏;三级变量是具体的并发症,且每个并发症都伴随有一个变量来记录其Clavien–Dindo分级[108]。为了实现机构间数据具有高水平的可比性,DUCA采取了多种措施来保证机构间变量定义的一致性及数据登记的准确性。DUCA 数据库中的数据主要有三种用途:第一,DUCA 的指导委员会和科学委员会负责每年向社会提交DUCA数据库的年度审计结果,并为接下来的一年制定医疗质量改进目标,卫生保健监察局和荷兰外科医生协会同样通过 DUCA 数据库中的数据监测所有参与医院的外科医疗质量,并在必要时对表现不佳的医院进行干预;第二,参与医院可以通过 DUCA 数据库每周更新的统计结果回顾其近期的医疗水平和全国的平均医疗水平;第三,DUCA 数据库中的数据还被用于了科学研究[108]。
2. 日本NCD(National Clinical Database of Japan)
日本国家临床数据库(NCD)覆盖了全国范围内的外科手术病例,记录了几乎所有主要手术的数据。NCD不仅在手术风险评估、并发症监测方面发挥了关键作用,还为制定针对性临床路径和质量改进措施提供了大量实证依据。通过对不同手术类型和患者人群的多层次分析,日本NCD推动了手术质量的持续改进,其模式和经验已在国际上得到广泛认可。
3. 美国NSQIP(National Surgical Quality Improvement Program)
美国国家手术质量改进计划(NSQIP)由美国外科医师学会发起,致力于通过标准化数据采集和风险调整来提升外科手术的整体质量。NSQIP涵盖了详细的患者基本情况、手术细节及术后并发症信息,并定期向参与机构反馈改进建议。该项目的实施显著降低了术后并发症率,缩短了住院时间,并优化了资源配置,其方法论和数据模型也被全球众多国家借鉴,为国际外科质量提升树立了标杆。
4. GlobalSurg Collaborative
GlobalSurg Collaborative是一个跨国多中心合作项目,旨在通过前瞻性队列研究评估全球范围内外科手术的安全性和疗效。该合作网络汇集了来自高、中、低收入国家的临床数据,揭示了不同地区在手术风险、并发症和患者预后等方面的显著差异。通过大规模、多中心数据分析,GlobalSurg不仅为低资源环境下的手术安全改进提供了策略,也为制定全球统一的外科质量控制标准贡献了重要数据,其研究成果多次发表于国际顶级期刊,具有较高学术影响力。
3.3 我国研究现存优势与不足
3.3.1 存在的优势
一方面,我国拥有庞大的手术量和成熟的标准化管理体系。通过推广D2根治术和普及腹腔镜微创技术,我国在胃肠肿瘤等手术中已形成统一、规范的操作流程,显著降低了术后并发症发生率和死亡率。依托PACAGE、CCCD等多中心数据登记系统,我国实现了以患者为单位的精细化数据管理,为风险评估和质量改进提供了坚实的证据支持,使得手术安全水平与日韩等国际先进国家保持一致。另一方面,多中心协同研究和学术平台的建设也为手术安全提供了坚实支撑。中国胃肠肿瘤外科联盟、CLASS研究组等平台,通过大规模临床试验和多中心数据整合,不断推动微创手术技术和围术期管理的创新,形成了循证医学成果。这些研究不仅提升了手术成功率和改善了患者预后,还为国际同行提供了宝贵经验,促进了国内外学术交流与合作。
3.3.2 存在的不足
a) 术后并发症可能被低估
2021年,GlobalSurg Collaborative and National Institute for Health Research Global Health Research Unit on Global Surgery在Lancet上,基于82个国家的前瞻性队列,发表了癌症术后并发症和死亡率的全球变化,中低收入国家患者肿瘤分期更晚,术后并发症发生风险更高,30天内死亡率更高[109]。
PACAGE数据库作为国内并发症登记的首次大规模尝试,虽然遵守《中国胃肠肿瘤外科术后并发症诊断登记规范专家共识(2018版)》[49],胃癌术后并发症发生率为18.14%,结直肠癌术后并发症发生率为14.80%,但仍存在术后并发症发生率被低估的风险。
首先,PACAGE数据库主要采用各中心自我报告的形式进行并发症登记和录入,将不可避免地影响并发症的报告率,特别是那些分级较低的并发症病例。
出院后并发症问题同样值得重视。PACAGE数据库中的术后并发症主要是由管床医生在患者出院前进行前瞻性登记。而既往研究已经证实了出院后并发症的高发生率。杜明梅等[110]利用院内感染监测系统(RT-NISS)开展了一项包含26家中国三甲医院的多中心研究,发现接受直肠癌根治性切除术的患者,出院后发生切口感染的平均时间为6天。类似的,Smith等人[111]在弗吉尼亚大学的单中心研究发现,发生切口感染的的患者有49%是在出院后被诊断的。对于出院后门诊随诊的患者,就诊记录可显示部分患者出院后有多次换药记录,但是对于这部分患者只能从门诊医嘱信息发现问题,无法判断是常规换药、还是有切口感染的发生。此外,对于门诊带药口服抗生素的患者,回顾分析就诊信息,无法判断其是否发生感染以及明确感染来源。这凸显了以住院患者为基础的监测系统的严重不足,对于出院后的患者,术后并发症的发生问题仍需重视。
这其中,外地患者的出院后并发症尤其被严重低估。出院后通常进行电话随访,随访中患者常对出院后的并发症症状、出现时间无法准确回顾描述。尽管目前中国胃肠手术质量有很大提高,预后有很大改善,但在我们之前的研究中,胃肠手术术后吻合口漏的发生率仍与欧美、其他东亚国家持平(图1),仍是影响患者生命安全及影响胃肠手术质量效果的重要因素[14, 33, 34, 36-40, 112, 113]。有研究显示,33%的吻合口漏在术后30天后被诊断出,12个月后47.2%的吻合口漏最终发展成慢性窦道[114]。因此,对于出院后胃肠肿瘤术后患者的吻合口漏发生问题,仍然需要高度重视。在对出院后患者电话随访过程中发现,部分患者出院后出现肛门排黏液或脓性分泌物问题。对于预防性造口后的患者,肠道内排出脓性或恶臭性分泌物常是吻合口漏的唯一症状或主要表现[115],但是部分患者未予重视,未于当地医院行CT等影像学检查。另外,患者对于出院后出现的轻度身体不适,常未行有效诊治,这对远期并发症资料的收集及诊断分类造成困难。
b) 术后并发症登记不同中心差异较大
根据中国胃肠肿瘤外科联盟数据报告(2014-2016),不同中心胃肠联盟数据里面所面临的问题:大中心登记多,小中心登记少但围术期死亡率高。
例如,根据我国胃肠联盟2014-2016的数据报告,胃肠癌术后平均并发症发生率为10.24%,但各中心汇报的术后并发症率差异较大,从0%-33.1%不等;总体而言,体量大的中心并发症登记相对较多,而体量较小的中心则登记较少[76]。类似的,PACAGE数据库也存在着类似的问题。
c) 术后并发症不可避免
术后并发症是胃肠肿瘤术前谈话中不可回避的话题,因为即使手术非常成功,也无法完全避免术后并发症的发生。这也是我国乃至全世界外科临床实践中存在的永恒问题。
首先,手术本身就是一种伤害。PACAGE数据库报道的术后死亡率为胃癌0.7%,结直肠癌0.18%,其他研究报道的胃肠肿瘤手术后30天内病死率在0%~4.3%[116, 117]。这其中,因紧急手术尽管死亡率相对较高,但手术在控制疾病症状和延长生命方面的价值毋庸置疑。不过,这也凸显了手术应激反应可能造成的伤害[118]。这种应激反应由神经体液和炎症免疫因素组成,在很大程度上取决于手术损伤的程度,也受到年龄[119]、术前免疫状况[120]和麻醉[121]等因素的影响。炎症对于限制有害细胞碎片和病原体的暴露以及促进愈合至关重要。先天性免疫系统和适应性免疫系统中的促炎和抗炎过程从根本上平衡了炎症[122, 123]。这种反应的失衡导致炎症亢进和免疫能力改变,可能会增加术后并发症和器官功能障碍(所谓的继发性损伤)的风险,从而增加死亡或持续残疾的风险[118, 124]。人们早已认识到创伤后高炎症反应和全身炎症反应综合征(systemic inflammatory response syndrome,SIRS)的重要性[125]。在全基因组免疫细胞基因表达的分析中,Xiao等人提出,并发症患者免疫细胞基因表达的显著改变代表了一种免疫失调状态,其特点是长期的高炎症和免疫抑制[126]。
其次,胃肠肿瘤手术本身的复杂性是导致术后并发症不可避免的重要原因之一。胃肠肿瘤手术通常需要广泛切除肿瘤及其周围组织,有时为了达到R0切除还需联合切除其他脏器[127],如PACAGE数据库中,胃癌手术联合其他脏器切除的比例是5.37%、结直肠癌手术是5.20%,这极大程度上增加了手术的复杂性和风险性。此外,胃肠肿瘤手术作为四级手术,手术时间较长,如PACAGE数据库中胃癌手术的中位时间是200分钟,结直肠癌手术的中位时间是170分钟。研究表明,超过140分钟的手术与切口感染发病率增加50%有关[128],这可能是由于创口长期暴露、水肿、低体温等原因,切口污染的机会增加,从而增加感染可能,导致术后患者病情加重。类似的,手术持续时间越长,麻醉药物特别是肌松药的使用增加,导致术后肌松药残留引起的残留性神经肌肉阻滞风险增加,以及麻醉机械通气时间增加,上呼吸道防御屏障消失,纤毛输送气道分泌物功能降低;同时肺功能残气量降低,导致肺膨胀不全,肺顺应性降低,破坏下呼吸道防御屏障功能,机械通气相关性肺损伤发生率增加,均会影响患者术后肺功能,使患者无法进行有效的呼吸及咳痰,导致肺不张等肺部感染的发生[129, 130]。
患者术前合并症是另外一个不可忽视的因素。胃肠肿瘤好发年龄较大,患病率在55~80岁年龄段达到最高[2, 131, 132]。由于机体的衰老和并存内科基础疾病,高龄患者的手术风险显著增加,具有更高的呼吸相关并发症和心血管相关并发症发生率[133-135]。此外,胃肠肿瘤患者常常存在营养不良问题,营养不良会导致免疫功能丧失,从而对感染的生理反应产生不利影响;皮肤变薄、易碎,更容易形成伤口,从而易受感染;压力点皮下脂肪减少,增加了压力伤口形成的可能性;能量储备不足,增加了活动不便性;减少了愈合所必需的胶原蛋白合成[136, 137]。
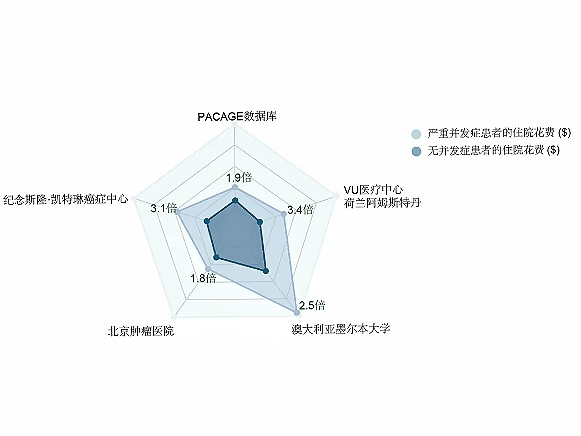
综上所述,胃肠肿瘤术后并发症的不可避免性主要是由于术后创伤应激反应、手术的复杂性、患者的个体差异、医疗条件的局限性和术后管理的多重挑战等综合因素共同作用的结果。尽管如此,加强围术期管理可以最大程度上降低术后并发症带来的消极影响。在之前基于PACAGE数据库的分析中,我们发现,相比欧美国家,中国对于术后并发症的处理是更为经济高效的,严重并发症患者的住院花费只是无并发症患者住院花费的1.9倍(图3)。此外,相比欧美国家,PACAGE数据库中严重并发症的发生比例也较低,这一方面是源于我国手术患者发生术后并发症的风险因素较低,一方面也是因为《中国胃肠肿瘤外科术后并发症诊断登记规范专家共识(2018版)》[49]对分级较低的并发症(CD分级Ⅰ~Ⅱ级)进行了进一步的明确,鼓励临床医生对早期并发症的诊断进行登记。例如,对于没有特殊干预的吻合口周围影像学异常或引流液性质异常,前期中西方对比研究发现国内大多数医生并不将之视为吻合口漏等并发症。在《中国胃肠肿瘤外科术后并发症诊断登记规范专家共识(2018版)》[49]中对于此类情况也推荐诊断为CD分级Ⅰ级吻合口漏。通过这样做,可以尽早发现可能存在异常的高危病人,提早干预、实现并发症的早诊早治,从而最大程度上减轻并发症带来的不良影响。
【主编】
李子禹 北京大学肿瘤医院
季加孚 北京大学肿瘤医院
徐泽宽 南京医科大学第一附属医院(江苏省人民医院)
胡建昆 四川大学华西医院
【副主编】
余 江 南方医科大学南方医院
臧 潞 上海交通大学医学院附属瑞金医院
张万广 华中科技大学同济医学院附属同济医院
郑朝辉 福建医科大学附属协和医院
胡文庆 长治市人民医院
赵 岩 辽宁省肿瘤医院
赵 群 河北省肿瘤医院
陕 飞 北京大学肿瘤医院
吴舟桥 北京大学肿瘤医院
【编委】(按姓氏拼音排序)
顾庭菲 北京大学肿瘤医院
王敬普 郑州大学第一附属医院
★
参考文献(向上滑动阅览)
1. Qi, J., et al., National and subnational trends in cancer burden in China, 2005-20: an analysis of national mortality surveillance data. The Lancet. Public Health, 2023. 8(12): p. e943-e955.
2. Sung, H., et al., Global Cancer Statistics 2020: GLOBOCAN Estimates of Incidence and Mortality Worldwide for 36 Cancers in 185 Countries. CA: a Cancer Journal For Clinicians, 2021. 71(3): p. 209-249.
3. Dekker, E., et al., Colorectal cancer. Lancet (London, England), 2019. 394(10207): p. 1467-1480.
4. Smyth, E.C., et al., Gastric cancer. Lancet (London, England), 2020. 396(10251): p. 635-648.
5. Xia, C., et al., Cancer statistics in China and United States, 2022: profiles, trends, and determinants. Chinese Medical Journal, 2022. 135(5): p. 584-590.
6. Woloshin, S. and B.S. Kramer, The Increasing Incidence of Early-Onset Colorectal Cancer. The New England Journal of Medicine, 2022. 387(1): p. 91-93.
7. Zoucas, E. and M.L. Lydrup, Hospital costs associated with surgical morbidity after elective colorectal procedures: a retrospective observational cohort study in 530 patients. Patient Saf Surg, 2014. 8(1): p. 2.
8. Tokuhara, K., et al., Short- and long-term outcomes of laparoscopic surgery for colorectal cancer in the elderly: A prospective cohort study. Int J Surg, 2016. 27: p. 66-71.
9. de Neree Tot Babberich, M.P.M., et al., Postoperative Outcomes of Screen-Detected vs Non-Screen-Detected Colorectal Cancer in the Netherlands. JAMA Surg, 2018. 153(12): p. e183567.
10. Springer, J.E., et al., Drivers of Inpatient Costs After Colorectal Surgery Within a Publicly Funded Healthcare System. Dis Colon Rectum, 2019. 62(6): p. 747-754.
11. Tamini, N., et al., Clinical Validation of the Comprehensive Complication Index in Colon Cancer Surgery. Cancers (Basel), 2021. 13(7).
12. Louis, M., et al., Financial burden of postoperative complications following colonic resection: A systematic review. Medicine (Baltimore), 2021. 100(27): p. e26546.
13. Chen, Q., et al., Optimal surgical sequence for colorectal cancer liver metastases patients receiving colorectal cancer resection with simultaneous liver metastasis resection: A multicentre retrospective propensity score matching study. Int J Surg, 2022. 106: p. 106952.
14. Kang, J., et al., Risk factors and economic burden of postoperative anastomotic leakage related events in patients who underwent surgeries for colorectal cancer. PLoS One, 2022. 17(5): p. e0267950.
15. Keikes, L., et al., Evaluating the scientific basis of quality indicators in colorectal cancer care: A systematic review. European Journal of Cancer (Oxford, England : 1990), 2017. 86: p. 166-177.
16. Denost, Q., et al., International variation in managing locally advanced or recurrent rectal cancer: prospective benchmark analysis. The British Journal of Surgery, 2020. 107(13): p. 1846-1854.
17. Romanus, D., et al., Concordance with NCCN Colorectal Cancer Guidelines and ASCO/NCCN Quality Measures: an NCCN institutional analysis. Journal of the National Comprehensive Cancer Network : JNCCN, 2009. 7(8): p. 895-904.
18. Staiger, R.D., et al., Benchmarks in colorectal surgery: multinational study to define quality thresholds in high and low anterior resection. The British Journal of Surgery, 2022. 109(12): p. 1274-1281.
19. Clavien, P.A., et al., The Clavien-Dindo classification of surgical complications: five-year experience. Ann Surg, 2009. 250(2): p. 187-96.
20. Katayama, H., et al., Extended Clavien-Dindo classification of surgical complications: Japan Clinical Oncology Group postoperative complications criteria. Surgery Today, 2016. 46(6): p. 668-685.
21. Charlson, M.E., et al., Charlson Comorbidity Index: A Critical Review of Clinimetric Properties. Psychotherapy and Psychosomatics, 2022. 91(1).
22. Silber, J.H., et al., Evaluation of the complication rate as a measure of quality of care in coronary artery bypass graft surgery. JAMA, 1995. 274(4): p. 317-323.
23. Schneider, M.A., et al., Defining benchmarks for total and distal gastrectomy: global multicentre analysis. The British Journal of Surgery, 2024. 111(2).
24. Azevedo, J.M., et al., Textbook Oncological Outcomes for Robotic Colorectal Cancer Resections: An Observational Study of Five Robotic Colorectal Units. Cancers, 2023. 15(15).
25. Voigt, K.R., et al., Association between textbook outcome and long-term survival after surgery for colorectal liver metastases. The British Journal of Surgery, 2023. 110(10): p. 1284-1287.
26. Görgec, B., et al., Assessment of Textbook Outcome in Laparoscopic and Open Liver Surgery. JAMA Surgery, 2021. 156(8): p. e212064.
27. McNair, A.G.K., et al., Core Outcomes for Colorectal Cancer Surgery: A Consensus Study. PLoS Medicine, 2016. 13(8): p. e1002071.
28. van Helsdingen, C.P., et al., Consensus on the definition of colorectal anastomotic leakage: A modified Delphi study. World Journal of Gastroenterology, 2020. 26(23): p. 3293-3303.
29. Rahbari, N.N., et al., Definition and grading of anastomotic leakage following anterior resection of the rectum: a proposal by the International Study Group of Rectal Cancer. Surgery, 2010. 147(3): p. 339-351.
30. Unger, J.M., et al., Association of Patient Comorbid Conditions With Cancer Clinical Trial Participation. JAMA Oncol, 2019. 5(3): p. 326-333.
31. Dong, X., et al., Risk-Adapted Starting Age for Personalized Colorectal Cancer Screening: Validated Evidence From National Population-Based Studies. Clin Gastroenterol Hepatol, 2023. 21(3): p. 819-826.e13.
32. van den Bosch, T., et al., Predictors of 30-Day Mortality Among Dutch Patients Undergoing Colorectal Cancer Surgery, 2011-2016. JAMA Netw Open, 2021. 4(4): p. e217737.
33. Bertelsen, C.A., et al., Anastomotic leakage after curative anterior resection for rectal cancer: short and long-term outcome. Colorectal Dis, 2010. 12(7 Online): p. e76-81.
34. Hasselager, R.P., J. Hallas, and I. Gögenur, Inhalation anaesthesia compared with total intravenous anaesthesia and postoperative complications in colorectal cancer surgery: an observational registry-based study(†). Br J Anaesth, 2022. 129(3): p. 416-426.
35. Eklöv, K., et al., Colon cancer treatment in Sweden during the COVID-19 pandemic: A nationwide register-based study. Colorectal Dis, 2022. 24(8): p. 925-932.
36. Henneman, D., et al., Safety of elective colorectal cancer surgery: non-surgical complications and colectomies are targets for quality improvement. J Surg Oncol, 2014. 109(6): p. 567-73.
37. van Leersum, N.J., et al., Synchronous colorectal carcinoma: a risk factor in colorectal cancer surgery. Dis Colon Rectum, 2014. 57(4): p. 460-6.
38. Arnarson, Ö., S. Butt-Tuna, and I. Syk, Postoperative complications following colonic resection for cancer are associated with impaired long-term survival. Colorectal Dis, 2019. 21(7): p. 805-815.
39. Xu, J., et al., Robotic colorectal cancer surgery in China: a nationwide retrospective observational study. Surg Endosc, 2021. 35(12): p. 6591-6603.
40. Mizoguchi, M., et al., Comparison of short-term outcomes between robot-assisted and laparoscopic rectal surgery for rectal cancer: A propensity score-matched analysis using the Japanese Nationwide diagnosis procedure combination database. Ann Gastroenterol Surg, 2023. 7(6): p. 955-967.
41. 潞, 臧., 李树春, and 郑民华, 腹腔镜胃癌外科手术30年:感悟与展望. 中国实用外科杂志, 2023. 43(09): p. 975-980.
42. 季加孚. 卫生部办公厅关于印发《胃癌诊疗规范(2011年版)》的通知. 2011 [cited 2024 06-16].
43. 卫生部. 卫生部关于印发 《医院手术部(室)管理规范(试行)》的通知. 2009.
44. 卫生部. 医疗质量控制中心管理办法(试行). 2009.
45. Park, S.H., et al., Changes in failure to rescue after gastrectomy at a large-volume center with a 16-year experience in Korea. Scientific Reports, 2023. 13(1): p. 5252.
46. 卫生健康委. 卫生健康委介绍区域医疗中心建设等有关情况. 2021.
47. Yu, J., et al., Effect of Laparoscopic vs Open Distal Gastrectomy on 3-Year Disease-Free Survival in Patients With Locally Advanced Gastric Cancer: The CLASS-01 Randomized Clinical Trial. JAMA, 2019. 321(20): p. 1983-1992.
48. Huang, C., et al., Laparoscopic vs Open Distal Gastrectomy for Locally Advanced Gastric Cancer: Five-Year Outcomes From the CLASS-01 Randomized Clinical Trial. JAMA Surgery, 2022. 157(1).
49. Ji, J., Chinese consensus on standardization of complication diagnosis and registration after gastrointestinal cancer surgery (ver. 2018). Chinese Journal of Practical Surgery, 2018. 38(6): p. 589-595.
50. Zhang, S.Q., et al., [Incidence of postoperative complications in Chinese patients with gastric or colorectal cancer based on a national, multicenter, prospective, cohort study]. Zhonghua Wei Chang Wai Ke Za Zhi = Chinese Journal of Gastrointestinal Surgery, 2024. 27(3): p. 247-260.
51. Allemani, C., et al., Global surveillance of trends in cancer survival 2000-14 (CONCORD-3): analysis of individual records for 37?513?025 patients diagnosed with one of 18 cancers from 322 population-based registries in 71 countries. Lancet (London, England), 2018. 391(10125): p. 1023-1075.
52. 姚宏伟, et al., 中国结直肠癌手术病例登记数据库2022年度报告:一项全国性登记研究. 中国实用外科杂志, 2023. 43(01): p. 93-99.
53. Voeten, D.M., et al., Outcomes of Esophagogastric Cancer Surgery During Eight Years of Surgical Auditing by the Dutch Upper Gastrointestinal Cancer Audit (DUCA). Annals of Surgery, 2021. 274(5): p. 866-873.
54. de Nes, L.C.F., et al., Postoperative mortality risk assessment in colorectal cancer: development and validation of a clinical prediction model using data from the Dutch ColoRectal Audit. BJS Open, 2022. 6(2).
55. Seishima, R., et al., Safety and feasibility of laparoscopic surgery for elderly rectal cancer patients in Japan: a nationwide study. BJS Open, 2021. 5(2).
56. Kim, T.-H., et al., The comprehensive complication index (CCI) is a more sensitive complication index than the conventional Clavien-Dindo classification in radical gastric cancer surgery. Gastric Cancer : Official Journal of the International Gastric Cancer Association and the Japanese Gastric Cancer Association, 2018. 21(1): p. 171-181.
57. Kanda, M., et al., Multi-institutional analysis of the prognostic significance of postoperative complications after curative resection for gastric cancer. Cancer Medicine, 2019. 8(11): p. 5194-5201.
58. Bartlett, E.K., et al., Morbidity and mortality after total gastrectomy for gastric malignancy using the American College of Surgeons National Surgical Quality Improvement Program database. Surgery, 2014. 156(2): p. 298-304.
59. Aurello, P., et al., Impact of Anastomotic Leakage on Overall and Disease-free Survival After Surgery for Gastric Carcinoma: A Systematic Review. Anticancer Research, 2020. 40(2): p. 619-624.
60. Jínek, T., et al., Risk factors and post-operative complications after gastrectomy for cancer. Rozhledy V Chirurgii : Mesicnik Ceskoslovenske Chirurgicke Spolecnosti, 2018. 97(8): p. 384-393.
61. Prof, C.-C., et al. TheAsia-Pacific perspective : Redefining obesity and its treatment.
62. Global status report on noncommunicable diseases 2014 / World Health Organization. 2014.
63. Stephen, A.M., et al., Dietary fibre in Europe: current state of knowledge on definitions, sources, recommendations, intakes and relationships to health. Nutrition Research Reviews, 2017. 30(2): p. 149-190.
64. Koh, A., et al., From Dietary Fiber to Host Physiology: Short-Chain Fatty Acids as Key Bacterial Metabolites. Cell, 2016. 165(6): p. 1332-1345.
65. Burkitt, D.P., A.R. Walker, and N.S. Painter, Effect of dietary fibre on stools and the transit-times, and its role in the causation of disease. Lancet (London, England), 1972. 2(7792): p. 1408-1412.
66. Kok, D.E., et al., Association of Habitual Preoperative Dietary Fiber Intake With Complications After Colorectal Cancer Surgery. JAMA Surgery, 2021. 156(9).
67. Desai, M.S., et al., A Dietary Fiber-Deprived Gut Microbiota Degrades the Colonic Mucus Barrier and Enhances Pathogen Susceptibility. Cell, 2016. 167(5).
68. Birchenough, G., et al., Dietary destabilisation of the balance between the microbiota and the colonic mucus barrier. Gut Microbes, 2019. 10(2): p. 246-250.
69. Stavrou, G. and K. Kotzampassi, Gut microbiome, surgical complications and probiotics. Annals of Gastroenterology, 2017. 30(1): p. 45-53.
70. Alverdy, J.C., et al., The gut microbiome and the mechanism of surgical infection. The British Journal of Surgery, 2017. 104(2): p. e14-e23.
71. Cuschieri, A., et al., Patient survival after D1 and D2 resections for gastric cancer: long-term results of the MRC randomized surgical trial. Surgical Co-operative Group. British Journal of Cancer, 1999. 79(9-10): p. 1522-1530.
72. Bonenkamp, J.J., et al., Extended lymph-node dissection for gastric cancer. The New England Journal of Medicine, 1999. 340(12): p. 908-914.
73. Songun, I., et al., Surgical treatment of gastric cancer: 15-year follow-up results of the randomised nationwide Dutch D1D2 trial. The Lancet. Oncology, 2010. 11(5): p. 439-449.
74. Peters, E.G., et al., The clinical and economical impact of postoperative ileus in patients undergoing colorectal surgery. Neurogastroenterol Motil, 2020. 32(8): p. e13862.
75. Cleary, R.K., et al., Intracorporeal and extracorporeal anastomosis for robotic-assisted and laparoscopic right colectomy: short-term outcomes of a multi-center prospective trial. Surgical Endoscopy, 2022. 36(6): p. 4349-4358.
76. 中国胃肠肿瘤外科联盟, 中国胃肠肿瘤外科联盟数据报告(2014-2016). 中国实用外科杂志, 2018. 38(1): p. 90-93.
77. 吴舟桥, et al., 对当前结直肠术后吻合口漏研究的思考, in 中华胃肠外科杂志, 吴舟桥, et al., Editors. 2018. p. 6.
78. Chen, G., et al., Effect of perioperative autologous versus allogeneic blood transfusion on the immune system in gastric cancer patients. Journal of Zhejiang University. Science. B, 2007. 8(8): p. 560-565.
79. Joharatnam-Hogan, N., K.K. Shiu, and K. Khan, Challenges in the treatment of gastric cancer in the older patient. Cancer Treatment Reviews, 2020. 85: p. 101980.
80. Sedgwick, D.M., J.A. Akoh, and I.M. Macintyre, Gastric cancer in Scotland: changing epidemiology, unchanging workload. BMJ (Clinical Research ed.), 1991. 302(6788): p. 1305-1307.
81. Group, C.C.C., Surgery for colorectal cancer in elderly patients: a systematic review. Lancet (London, England), 2000. 356(9234): p. 968-974.
82. Yasuda, K., et al., Laparoscopically assisted distal gastrectomy for early gastric cancer in the elderly. The British Journal of Surgery, 2004. 91(8): p. 1061-1065.
83. Kroenke, C.H., et al., Analysis of Body Mass Index and Mortality in Patients With Colorectal Cancer Using Causal Diagrams. JAMA Oncology, 2016. 2(9): p. 1137-1145.
84. Kim, H.-S., A. Ike, and S.K. Ahlawat, The Optimal Body Mass Index Range for Patients With Colorectal Cancer. JAMA Oncology, 2017. 3(5): p. 707-708.
85. Yamano, T., et al., Influence of age and comorbidity on prognosis and application of adjuvant chemotherapy in elderly Japanese patients with colorectal cancer: A retrospective multicentre study. European Journal of Cancer (Oxford, England : 1990), 2017. 81.
86. Ahern, T.P., et al., Colorectal cancer, comorbidity, and risk of venous thromboembolism: assessment of biological interactions in a Danish nationwide cohort. British Journal of Cancer, 2016. 114(1).
87. Panis, Y., et al., Mortality after colorectal cancer surgery: a French survey of more than 84,000 patients. Annals of Surgery, 2011. 254(5).
88. van den Bosch, T., et al., Predictors of 30-Day Mortality Among Dutch Patients Undergoing Colorectal Cancer Surgery, 2011-2016. JAMA Network Open, 2021. 4(4): p. e217737.
89. Cardoso, R., et al., Colorectal cancer incidence, mortality, and stage distribution in European countries in the colorectal cancer screening era: an international population-based study. The Lancet. Oncology, 2021. 22(7): p. 1002-1013.
90. Benedix, F., et al., Comparison of 17,641 patients with right- and left-sided colon cancer: differences in epidemiology, perioperative course, histology, and survival. Diseases of the Colon and Rectum, 2010. 53(1): p. 57-64.
91. Hu, J., et al., [Analysis of clinicopathologic and survival characteristics in patients with right-or left-sided colon cancer]. Zhonghua Yi Xue Za Zhi, 2015. 95(28): p. 2268-2271.
92. Wu, Z., et al., Postoperative abdominal complications of gastric and colorectal cancer surgeries in China: a multicentered prospective registry-based cohort study. Science Bulletin, 2022. 67(24): p. 2517-2521.
93. Siegel, R.L., et al., Colorectal cancer statistics, 2023. CA: a Cancer Journal For Clinicians, 2023. 73(3): p. 233-254.
94. Tadros, M., et al., The rise of proximal colorectal cancer: a trend analysis of subsite specific primary colorectal cancer in the SEER database. Annals of Gastroenterology, 2021. 34(4): p. 559-567.
95. Ostomy Professional Committee, C.S.o.C., Chinese Medical Doctor Association; Chinese Society of Colorectal Surgery, Chinese Society of Surgery, Chinese Medical Association; Colorectal Tumor Professional Committee, Chinese Medical Doctor Association, Chinese expert consensus on protective ostomy for mid-low rectal cancer (version 2022). Zhonghua Wei Chang Wai Ke Za Zhi = Chinese Journal of Gastrointestinal Surgery, 2022. 25(6): p. 471-478.
96. Li, Y., et al., Effect of neoadjuvant radiotherapy and prophylactic stoma on the incidence of anastomotic leakage after radical surgery for low to intermediate rectal cancer. Zhonghua Wei Chang Wai Ke Za Zhi = Chinese Journal of Gastrointestinal Surgery, 2021. 24(6): p. 498-504.
97. Zhao, X., et al., Study on the correlation between prevention of ileostomy and anastomotic leakage after neoadjuvant radiotherapy for rectal cancer. International Journal of Surgery, 2021(02): p. 82-86.
98. Tan, W.S., et al., Meta-analysis of defunctioning stomas in low anterior resection for rectal cancer. Br J Surg, 2009. 96(5): p. 462-72.
99. Kang, C.Y., et al., Risk factors for anastomotic leakage after anterior resection for rectal cancer. JAMA Surgery, 2013. 148(1): p. 65-71.
100. Shiomi, A., et al., Effects of a diverting stoma on symptomatic anastomotic leakage after low anterior resection for rectal cancer: a propensity score matching analysis of 1,014 consecutive patients. Journal of the American College of Surgeons, 2015. 220(2): p. 186-194.
101. Ambe, P.C., et al., Intestinal Ostomy. Deutsches Arzteblatt International, 2018. 115(11): p. 182-187.
102. Pang, N.Q., et al., Quality of life in colorectal cancer patients with stoma or adjuvant therapy. Annals of the Academy of Medicine, Singapore, 2021. 50(5): p. 444-446.
103. Zamaray, B., et al., Timing of restoration of bowel continuity after decompressing stoma, in left-sided obstructive colon cancer: a nationwide retrospective cohort. International Journal of Surgery (London, England), 2024. 110(2): p. 864-872.
104. Augestad, K.M., A.M. Sneve, and R.O. Lindsetmo, Telemedicine in postoperative follow-up of STOMa PAtients: a randomized clinical trial (the STOMPA trial). The British Journal of Surgery, 2020. 107(5): p. 509-518.
105. Krogsgaard, M., et al., Impact of a Parastomal Bulge on Quality of Life - A Cross-sectional Study of Patients From the Danish Stoma Database. Annals of Surgery, 2021. 274(6): p. e1085-e1092.
106. Van Leersum, N.J., et al., The Dutch surgical colorectal audit. Eur J Surg Oncol, 2013. 39(10): p. 1063-70.
107. Busweiler, L.A., et al., Early outcomes from the Dutch Upper Gastrointestinal Cancer Audit. Br J Surg, 2016. 103(13): p. 1855-1863.
108. 王敬普, et al., 科学严谨的患者信息登记是高质量胃癌外科研究的基石--荷兰上消化道癌症审计数据库11年经验分享 %J 中华胃肠外科杂志 %J Chinese Journal of Gastrointestinal Surgery. 2023. 26(2): p. 148-153.
109. Global variation in postoperative mortality and complications after cancer surgery: a multicentre, prospective cohort study in 82 countries. Lancet (London, England), 2021. 397(10272): p. 387-397.
110. Du, M., et al., Multicenter surveillance study of surgical site infection and its risk factors in radical resection of colon or rectal carcinoma. BMC Infectious Diseases, 2019. 19(1): p. 411.
111. Smith, R.L., et al., Wound infection after elective colorectal resection. Annals of Surgery, 2004. 239(5).
112. Lee, S.W., D. Gregory, and C.L. Cool, Clinical and economic burden of colorectal and bariatric anastomotic leaks. Surg Endosc, 2020. 34(10): p. 4374-4381.
113. Hammond, J., et al., The burden of gastrointestinal anastomotic leaks: an evaluation of clinical and economic outcomes. J Gastrointest Surg, 2014. 18(6): p. 1176-85.
114. Borstlap, W.A.A., et al., Anastomotic Leakage and Chronic Presacral Sinus Formation After Low Anterior Resection: Results From a Large Cross-sectional Study. Annals of Surgery, 2017. 266(5): p. 870-877.
115. 杨廷翰 and 王自强, 直肠癌术后吻合口漏的早期诊断与治疗. 中华胃肠外科杂志, 2018. 21(4): p. 388-394.
116. Zhang, W., et al., Multicenter analysis of risk factors for anastomotic leakage after middle and low rectal cancer resection without diverting stoma: a retrospective study of 319 consecutive patients. International Journal of Colorectal Disease, 2017. 32(10): p. 1431-1437.
117. Docherty, J.G., et al., Comparison of manually constructed and stapled anastomoses in colorectal surgery. West of Scotland and Highland Anastomosis Study Group. Annals of Surgery, 1995. 221(2): p. 176-184.
118. Dobson, G.P., Trauma of major surgery: A global problem that is not going away. International Journal of Surgery (London, England), 2020. 81: p. 47-54.
119. Hearps, A.C., et al., Aging is associated with chronic innate immune activation and dysregulation of monocyte phenotype and function. Aging Cell, 2012. 11(5): p. 867-875.
120. Bain, C.R., et al., Postoperative systemic inflammatory dysregulation and corticosteroids: a narrative review. Anaesthesia, 2023. 78(3): p. 356-370.
121. Sanders, R.D., III. Perioperative immunity: is there an anaesthetic hangover? British Journal of Anaesthesia, 2014. 112(2): p. 210-212.
122. Alazawi, W., et al., Inflammatory and Immune Responses to Surgery and Their Clinical Impact. Annals of Surgery, 2016. 264(1): p. 73-80.
123. Watanabe, S., et al., The role of macrophages in the resolution of inflammation. The Journal of Clinical Investigation, 2019. 129(7): p. 2619-2628.
124. Kehlet, H., Enhanced postoperative recovery: good from afar, but far from good? Anaesthesia, 2020. 75 Suppl 1: p. e54-e61.
125. Bone, R.C., Toward an epidemiology and natural history of SIRS (systemic inflammatory response syndrome). JAMA, 1992. 268(24): p. 3452-3455.
126. Xiao, W., et al., A genomic storm in critically injured humans. The Journal of Experimental Medicine, 2011. 208(13): p. 2581-2590.
127. 中华医学会外科学分会腹腔镜与内镜外科学组, 中国医师协会外科医师分会上消化道外科医师专家工作组, and 《中华消化外科杂志》编辑委员会, 精准胃癌外科诊疗中国专家共识(2024版). 中华消化外科杂志, 2024. 23(3): p. 323-333.
128. Amri, R., et al., Risk Stratification for Surgical Site Infections in Colon Cancer. JAMA Surgery, 2017. 152(7): p. 686-690.
129. Sachdev, G. and L.M. Napolitano, Postoperative pulmonary complications: pneumonia and acute respiratory failure. The Surgical Clinics of North America, 2012. 92(2).
130. Bai, D., et al., [Risk factors of postoperative pulmonary infection of gastric cancer and perioperative intervention measures]. Zhonghua Wei Chang Wai Ke Za Zhi = Chinese Journal of Gastrointestinal Surgery, 2021. 24(2): p. 185-190.
131. 中国抗癌协会胃癌专业委员会, 中国医师协会外科医师分会上消化道外科医师委员会, and 中国人群健康风险管理协作组-胃癌专业组, 中国人群胃癌风险管理公众指南(2023版). 中华医学杂志, 2023. 103(36): p. 2837-2849.
132. Thrift, A.P. and H.B. El-Serag, Burden of Gastric Cancer. Clinical Gastroenterology and Hepatology : the Official Clinical Practice Journal of the American Gastroenterological Association, 2020. 18(3): p. 534-542.
133. Dai, Y., et al., Risk factors for postoperative pulmonary complications in elderly patients receiving elective colorectal surgery: A retrospective study. Frontiers In Oncology, 2022. 12: p. 1002025.
134. Boakye, D., et al., Impact of comorbidity and frailty on prognosis in colorectal cancer patients: A systematic review and meta-analysis. Cancer Treatment Reviews, 2018. 64: p. 30-39.
135. Fagard, K., et al., Postoperative complications in individuals aged 70 and over undergoing elective surgery for colorectal cancer. Colorectal Disease : the Official Journal of the Association of Coloproctology of Great Britain and Ireland, 2017. 19(9): p. O329-O338.
136. Ghaly, P., J. Iliopoulos, and M. Ahmad, The role of nutrition in wound healing: an overview. British Journal of Nursing (Mark Allen Publishing), 2021. 30(5): p. S38-S42.
137. Grada, A., J. Mervis, and V. Falanga, Research Techniques Made Simple: Animal Models of Wound Healing. The Journal of Investigative Dermatology, 2018. 138(10).
138. 中医药局, 卫., 全面提升医疗质量行动计划(2023-2025年). 2023, 卫生健康委网站: https://www.gov.cn/zhengce/zhengceku/202305/content_6883704.htm.
139. 国家卫生健康委办公厅. 手术质量安全提升行动方案(2023-2025年). 2023 [cited 2024 06-16].