中国抗癌协会
立即下载App张瑾教授:“化疗plus”时代的中性粒细胞减少防治策略——抗肿瘤联合治疗方案更需预防
近年来,靶向药物、免疫治疗药物、抗体偶联药物(ADCs)等新型抗肿瘤药物不断涌现,抗肿瘤药物治疗格局正在由以往单独化疗逐步迈入化疗联合多种新型抗肿瘤疗法的“化疗plus”时代。化疗引起的中性粒细胞减少是其最常见的血液学毒性,是肿瘤辅助治疗偏离既定方案的重要原因,随着新型抗肿瘤药物临床应用日益广泛,一些本被认为不具有明确骨髓抑制作用的新型抗肿瘤药物亦被报道可能导致中性粒细胞减少[1,2]。本期【守护者】特邀浙江大学医学院附属邵逸夫医院血液科张瑾教授,对肿瘤治疗“化疗plus”时代的中性粒细胞减少情况及防治策略进行深入解析与探讨,旨在促进广大医药从业者对于肿瘤治疗综合管理的深入理解与重视。

1、靶向、免疫治疗具有引起中性粒细胞减少的风险
近年来靶向、免疫治疗的临床应用逐年增加。研究显示(N=13209),至2019年,接受靶向治疗的患者数量达21.3%,接受免疫治疗的患者数量则从2014年的5%上升至12%[3]。然而,部分靶向、免疫治疗具有引起包括3-4级中性粒细胞减少风险在内的严重血液学毒性的风险,尤其在与化疗联用时,可能导致整体治疗方案的中性粒细胞减少及发热性中性粒细胞减少症(febrile neutropenia,FN)风险增高[4]。
接受联合治疗的患者,中性粒细胞减少的发生风险高于单独化疗。据《柳叶刀·肿瘤学》杂志报道,免疫检查点抑制剂与化疗联用时,中性粒细胞减少的发生率为34.3%,3级及以上严重中性粒细胞减少的发生率为19.6%(图1)[5]。一项纳入2014年至2019年间29项随机对照试验、共计8576例患者的系统性研究结果显示,在接受化疗+免疫联合治疗的患者中,中性粒细胞减少的风险高于仅接受化疗的患者(RR:1.77[95% CI: 0.58-5.42])[4]。
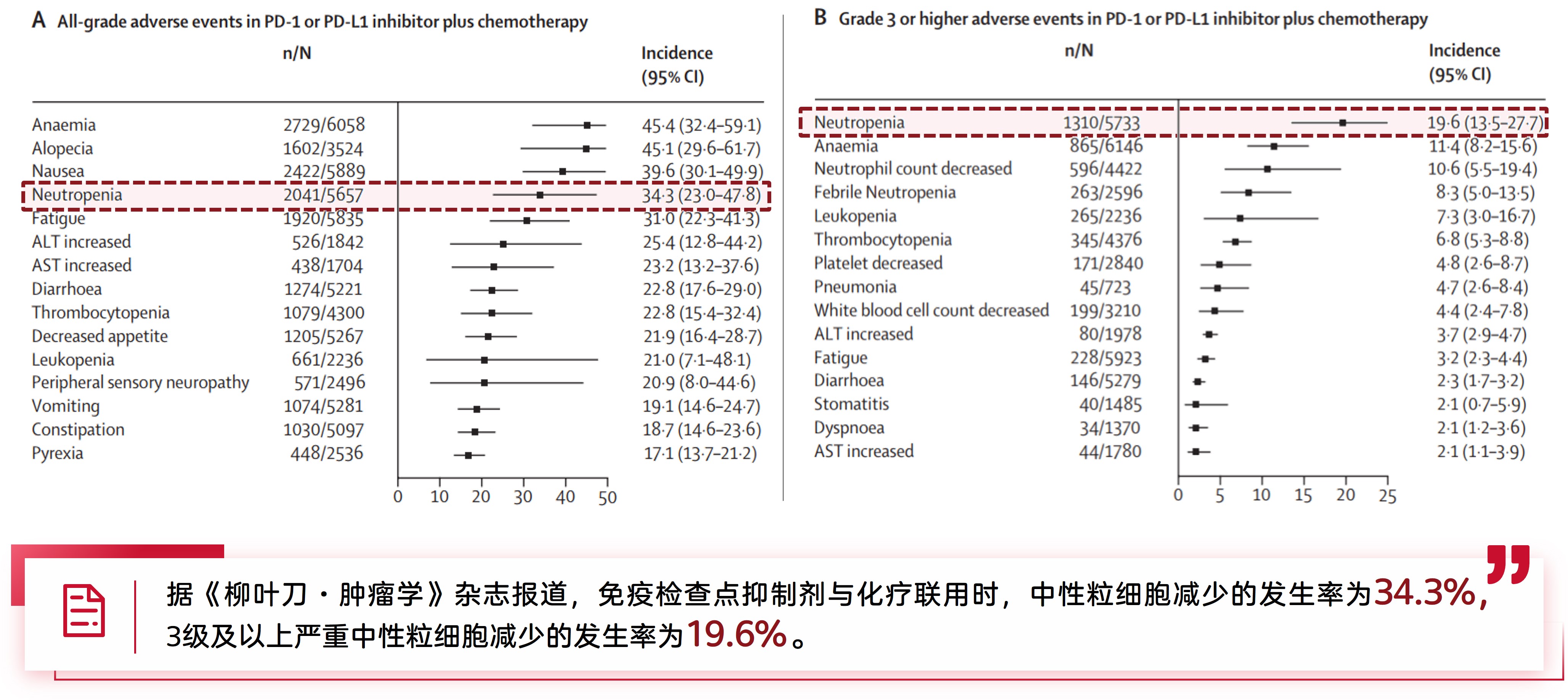
图1. PD-1/PD-L1抑制剂具有引起中性粒细胞减少的风险
2、常见肿瘤靶向治疗的中性粒细胞减少发生情况
2.1 乳腺癌靶向治疗的中性粒细胞减少与FN发生情况
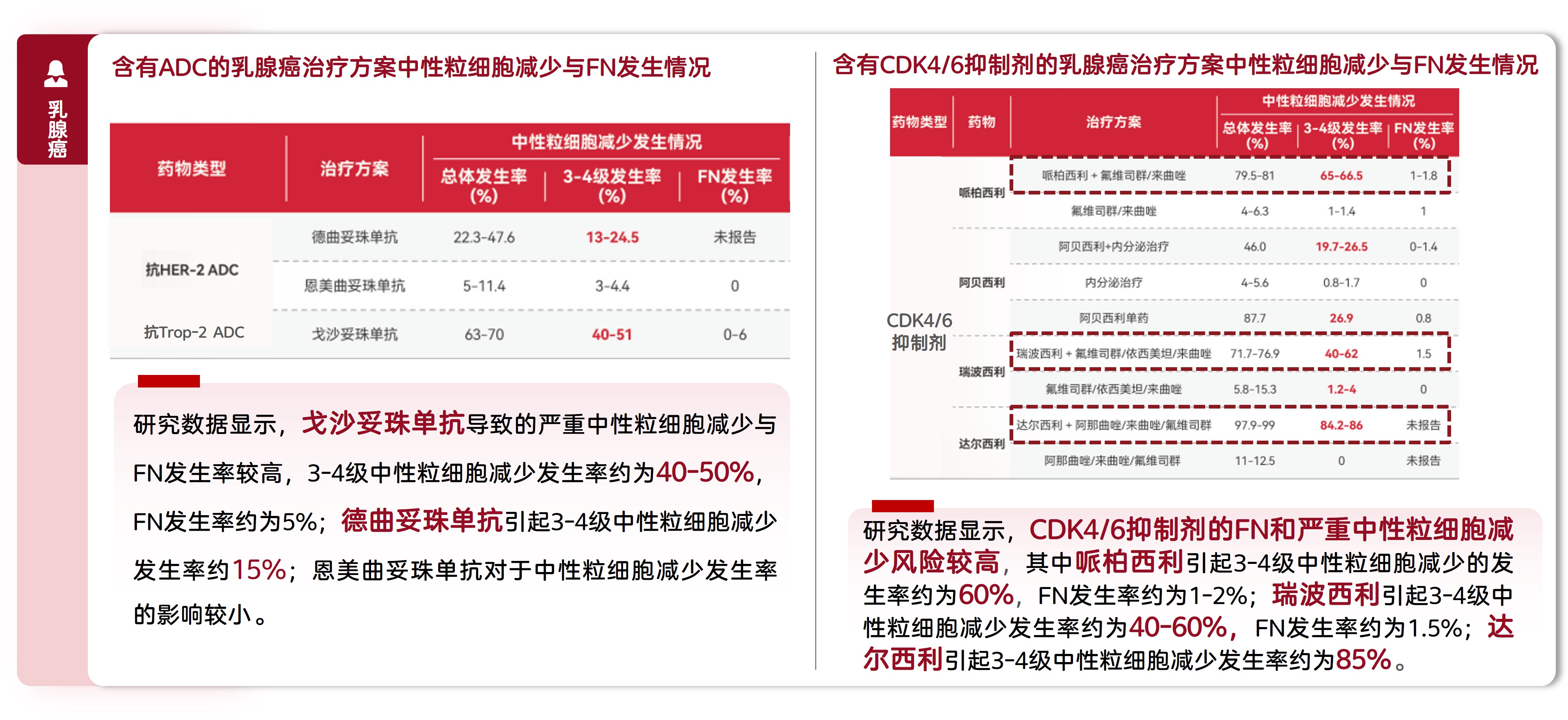
图2. 乳腺癌常用靶向治疗的中性粒细胞减少与FN发生情况
在乳腺癌治疗方案中,含有ADC的乳腺癌治疗方案中性粒细胞减少与FN风险较高[6-15],CDK4/6抑制剂亦具有较高的FN和严重中性粒细胞减少风险(图2)[16-25]。一项纳入2010.1至2019.12期间随机对照临床试验的分析表明,CDK4/6抑制剂联合内分泌疗法组的中性粒细胞减少(RR: 32.04[17.14-59.90])及FN(RR: 4.31[1.33-13.99])发生风险显著增加[26,27]。
2.2 消化道肿瘤靶向治疗的中性粒细胞减少与FN发生情况
在消化道肿瘤治疗方案中,德曲妥珠单抗具有较高的严重中性粒细胞减少发生风险,此外,雷莫西尤单抗与FOLFIRI方案或与紫杉醇联用时,可能增加严重中性粒细胞减少的发生风险(图3)。
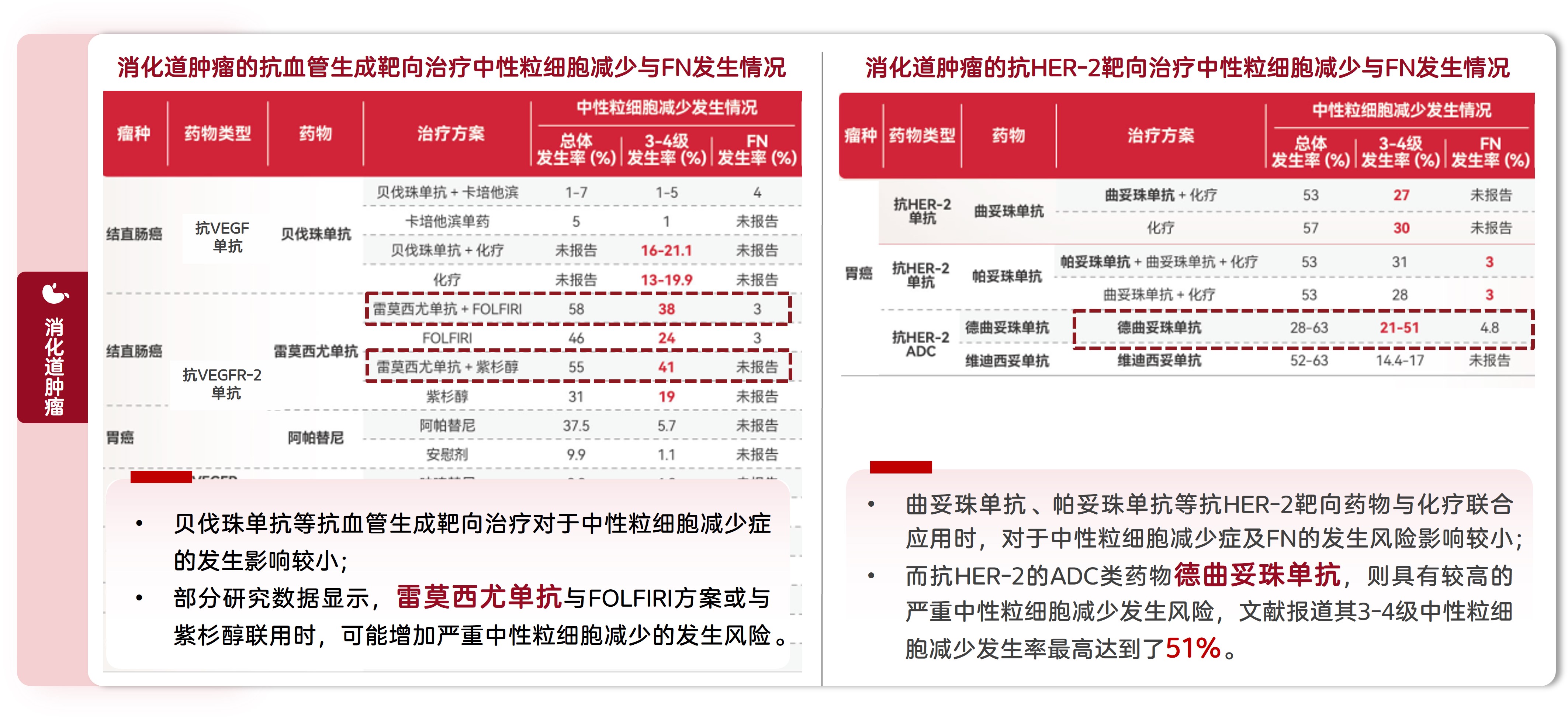
图3. 消化道肿瘤常用靶向治疗的中性粒细胞减少与FN发生情况[28-46]
2.3 妇科肿瘤靶向治疗的中性粒细胞减少与FN发生情况
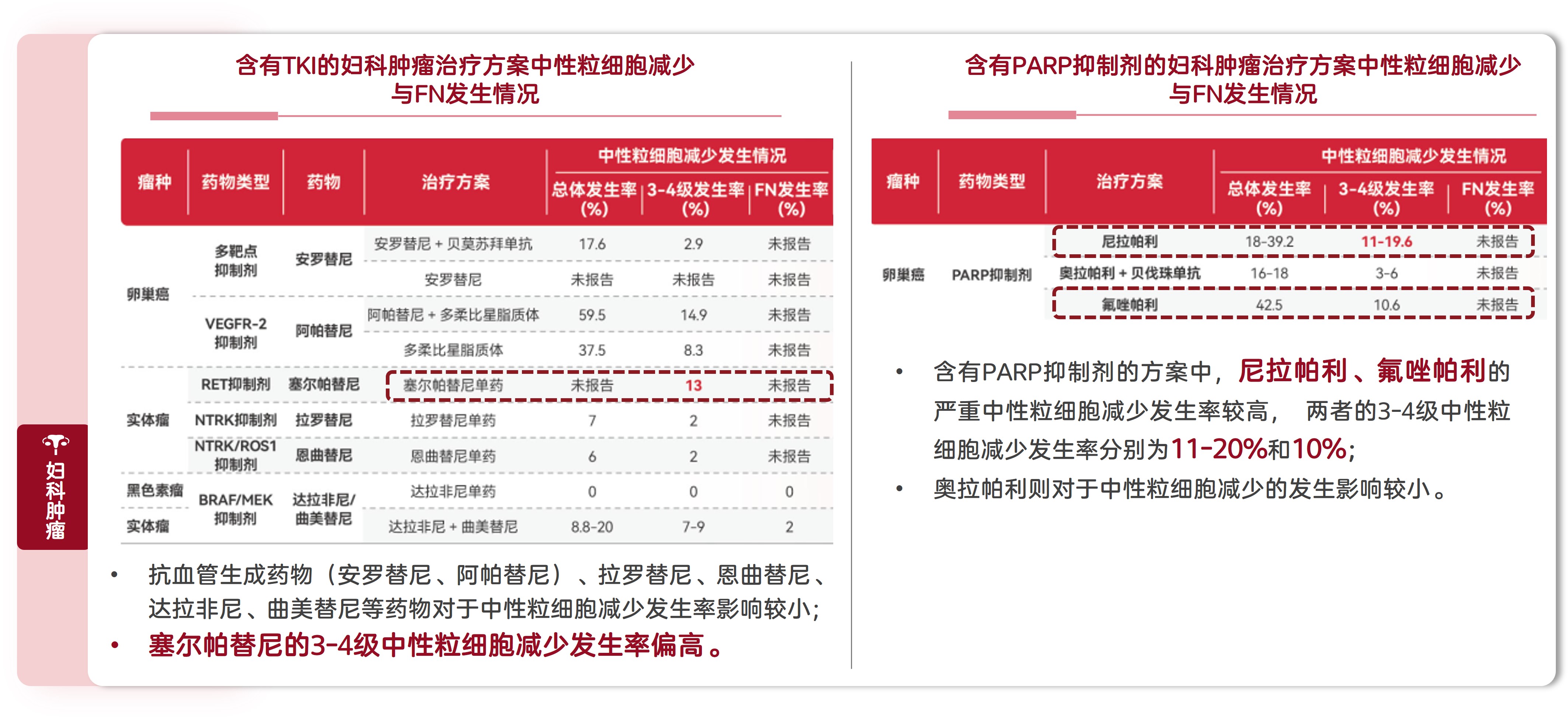
图4. 妇科肿瘤常用靶向治疗的中性粒细胞减少与FN发生情况[47-60]
妇科肿瘤治疗方案中,一项纳入了10项PARP抑制剂相关临床研究(N=4553)的荟萃分析结果表明:接受PARP抑制剂治疗的晚期卵巢癌患者出现贫血、白细胞减少、中性粒细胞减少、血小板减少等全级别和高级别血液学毒性的风险更高(P < 0.05)[61]。在PARP抑制剂中,尼拉帕利、氟唑帕利的3-4级中性粒细胞减少发生率分别为11-20%和10%;奥拉帕利则对于中性粒细胞减少的发生影响较小(图4)。
2.4 血液肿瘤靶向治疗的中性粒细胞减少与FN发生情况
血液肿瘤治疗方案中,CD38单抗及ADCs对严重中性粒细胞减少发生率有较大影响,其引起3-4级中性粒细胞减少的发生率约在15%至40%之间,其中贝林妥欧单抗引起FN的发生率约为20%[62-74];部分小分子靶向药引起严重中性粒细胞减少乃至于FN的风险亦较高(图5)[75-88]。

图5. 血液肿瘤常用靶向治疗的中性粒细胞减少与FN发生情况[75-88]
来那度胺、泊马度胺引起的3-4级中性粒细胞减少发生率分别约为35%和60%[65-67,89,90]。欧洲骨髓瘤网络(EMN)2018年发布的多发性骨髓瘤新型药物不良事件的预防和管理共识中,对于免疫调节剂、硼替佐米、帕比司他、达雷妥尤单抗都附有关于发生中性粒细胞减少症和FN的 “特别提示”[91]。
3、G-CSF预防为接受FN中高风险靶免治疗的患者带来临床获益
3.1 G-CSF预防可降低严重中性粒细胞减少的发生率,提高抗肿瘤药物的耐受剂量
一项维利帕尼联合卡铂和吉西他滨治疗晚期实体瘤的研究中(N=75),所有级别和3-4级中性粒细胞减少的发生率分别为74.6%(n=56)和56%(n=42),有多例患者因此需要减少维利帕尼(n=20)或吉西他滨(n=27)的剂量。在G-CSF的支持下(n=41),患者在联合治疗期间可以耐受持续服用MTD(250 mg,BID)或更高剂量的维利帕尼,并且可以长期耐受维利帕尼单药治疗,最高可达400 mg,BID,表明G-CSF支持有助于提高肿瘤治疗药物的耐受剂量[92]。另一项来那度胺+阿霉素+地塞米松(RAD)方案治疗复发和难治性多发性骨髓瘤的研究结果亦显示,在靶向、免疫等新型抗肿瘤药物联合化疗的治疗方案中,G-CSF预防可降低严重中性粒细胞减少的发生率,有助于提高肿瘤治疗药物的耐受剂量,减少药物减量的发生(图6)[93]。

图6. G-CSF预防可降低严重中性粒细胞减少的发生率,提高抗肿瘤药物的耐受剂量
3.2 长效G-CSF一级预防显著降低中性粒细胞减少症相关的感染和FN导致的化疗中断,保护效果确切
一项帕博利珠单抗联合AVD方案(多柔比星+长春新碱+达卡巴嗪)治疗霍奇金淋巴瘤的研究中(N=30),使用G-CSF预防后,FN及感染发生率降低;因此,研究建议对年龄≥60 岁、伴有合并症及既往发生过FN等危险因素的受试者使用 G-CSF进行预防[94]。
长效G-CSF一级预防组对中性粒细胞减少的保护效果优于短效G-CSF组(图7),可显著降低中性粒细胞减少症相关的感染和FN导致的化疗中断,减少化疗剂量延迟,改善老年患者的PFS和OS(图8)。
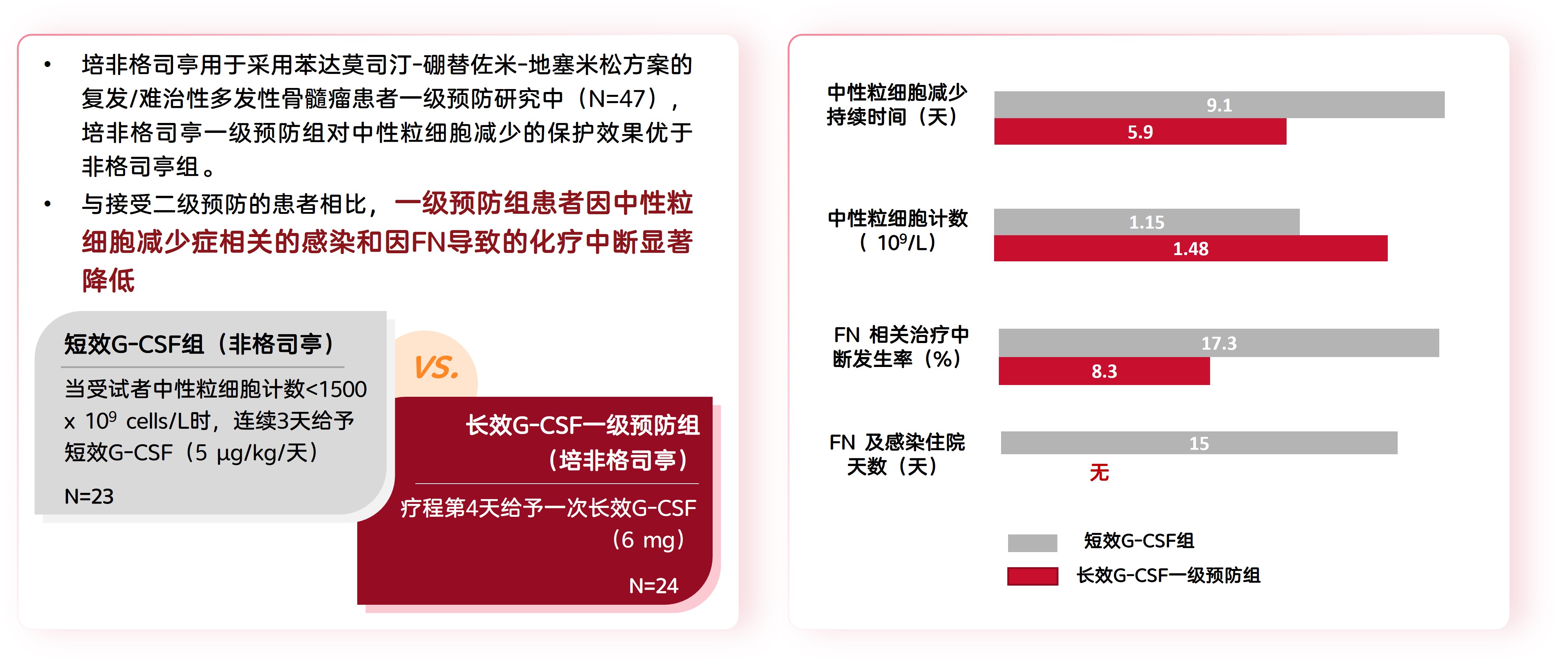
图7. 长效G-CSF一级预防对中性粒细胞减少的保护效果优于短效G-CSF组[95,96]
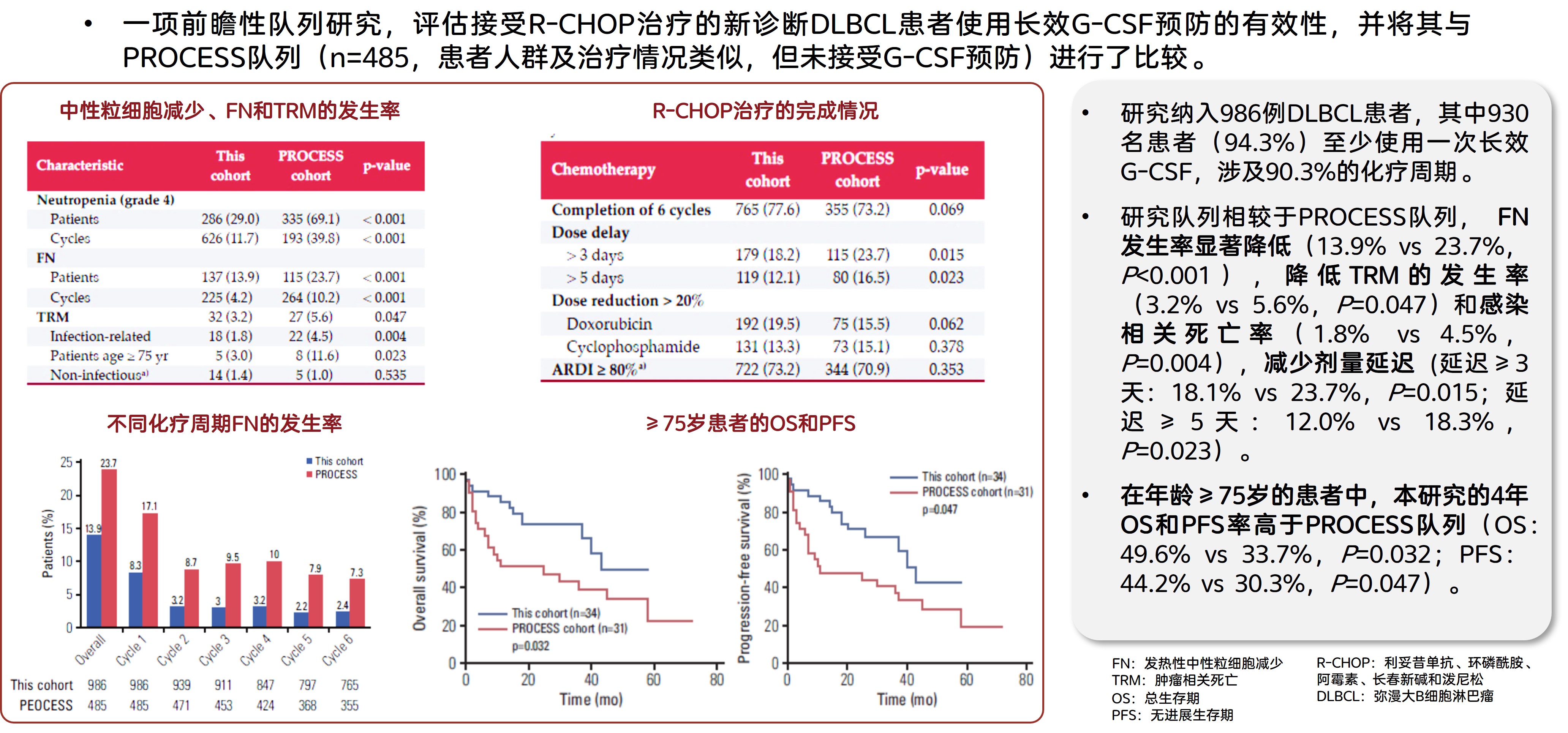
图8. 长效G-CSF有效降低FN发生率,减少化疗剂量延迟,改善老年患者的PFS和OS[97]
4、同步放化疗方案中性粒细胞减少的预防
近年来,G-CSF用于同步放化疗的安全性在国内外多项研究中逐渐得到证实,研究结果显示在同步放化疗期间使用长效G-CSF一级预防,可有效降低中性粒细胞减少发生率。2015年以来,国内外多个指南更新了肿瘤同步放化疗期间联合应用G-CSF的相关内容。2020年,NCCN造血生长因子临床实践指南取消了“同步放化疗期间不推荐预防性应用G-CSF”的表述,表明在精确放疗技术条件下,同步放化疗期间联合使用rhG-CSF类药物预防中性粒细胞减少症是安全的,有望为患者带来获益(图9)[98-104]。

图9. 指南共识更新,推荐G-CSF用于同步放化疗患者,可能带来生存获益
专家点评:
虽然靶向、免疫等新型抗肿瘤药物由于其高效低毒的特点而获得广泛应用,但部分靶向、免疫治疗药物仍具有引起严重血液学毒性的风险,接受“化疗+靶免”联合治疗的患者,中性粒细胞减少的发生风险高于单独化疗。
预防性使用长效G-CSF可降低“化疗+靶免”联合治疗方案的严重中性粒细胞减少及FN的发生率,显著降低中性粒细胞减少症相关的感染和FN导致的化疗中断;有助于提高抗肿瘤治疗药物耐受剂量并维持预期治疗方案,从而保证患者接受足剂量、足疗程化疗,提高患者的生活质量和治疗效果,为广大肿瘤患者带来临床获益。
参考文献:
[1] 中华肿瘤杂志,2023; 45(7): 575-583
[2] 中华医学杂志,2022; 102(40): 3167-3173
[3] Curr Oncol. 2023; 30(9):7984-8004.
[4] Int J Surg. 2023; 109(6):1753-1768.
[5] Lancet Oncol. 2021; 22(9):1265-1274.
[6] Lancet. 2023;401(10371):105-117
[7] Neuro Oncol. 2023;25(1):157-166.
[8] Ann Oncol. 2024;35(3):302-307.
[9] N Engl J Med. 2022;387(1):9-20.
[10] Ann Oncol. 2022;33:S464-S465.
[11] Lancet Oncol. 2014;15(7):689-99.
[12] J Clin Oncol. 2017; 35(2): 141–148.
[13] Lancet. 2023;402(10411):1423-1433
[14]N Engl J Med. 2021;384(16):1529-1541
[15] N Engl J Med. 2019;380(8):741-751.
[16] Lancet Oncol. 2016;17(4):425-439.
[17] Lancet Oncol. 2022;23(11):1367-1377.
[18] Lancet Oncol. 2023;24(1):77-90.
[19] J Clin Oncol. 2017;35(25):2875-2884.
[20] Clin Cancer Res. 2017;23(17):5218-5224
[21] Ann Oncol. 2018;29(7):1541-1547.
[22] J Clin Oncol. 2023;41(24):4004-4013.
[23] Lancet Oncol. 2018;19(7):904-915.
[24] Nat Med. 2021;27(11):1904-1909.
[25] Lancet Oncol. 2023;24(6):646-657.
[26] Transl Cancer Res. 2020;9(2):657-668.
[27] Ann Palliat Med. 2021;10(5):5590-5599.
[28] Ann Oncol. 2020;31(9):1160-1168
[29] Lancet Oncol. 2013;14(1):29-37
[30] Oncologist. 2013;18(9):1004-12.
[31] Lancet Oncol. 2015;16(5):499-508.
[32] Lancet Oncol. 2014;15(11):1224-35.
[33] J Clin Oncol. 2016;34(13):1448-54.
[34] Cancer Manag Res. 2021:13:6199-6205.
[35] J Gastrointest Oncol. 2022;13(2):722-731.
[36] Front Oncol. 2022:12:942678.
[37] Cancer Med. 2021;10(5):1681-1689.
[38] Oncologist. 2022;27(11):e856-e869.
[39] Lancet Oncol. 2015;16(6):619-29.
[40] Lancet. 2010;376(9742):687-97.
[41] Lancet Oncol. 2018;19(10):1372-1384
[42] N Engl J Med. 2020;382(25):2419-2430.
[43] J Clin Oncol. 2023;41(4):816-825.
[44] Lancet Oncol. 2019;20(6):827-836.
[45] Cancer Commun (Lond). 2021;41(11):1173-1182.
[46] EClinicalMedicine. 2024:68:102415.
[47]. Lancet Oncol. 2019;20(5):636-648
[48]. N Engl J Med. 2016;375(22):2154-2164.
[49]. N Engl J Med. 2019;381(25):2391-2402.
[50]. N Engl J Med. 2019;381(25):2416-2428.
[51]. Clin Cancer Res. 2021;27(9):2452-2458
[52]. Cell Rep Med. 2022;3(7):100689.
[53]. Front Oncol. 2021:11:720343.
[54]. Invest New Drugs. 2023;41(5):768-776.
[55]. Lancet Oncol. 2020;21(4):531-540.
[56]. Lancet Oncol. 2020;21(2):271-282.
[57]. Lancet. 2012 Jul 28;380(9839):358-365.
[58]. EClinicalMedicine. 2024:69:102447.
[59]. Lancet Oncol. 2016l;17(7):984-993.
[60]. Lancet Oncol. 2022;23(1):53-64.
[61] Crit Rev Oncol Hematol. 2021; 157:103145.
[62]. Ann Oncol. 1998;9(5):527-534.
[63]. Blood. 1998;92(6):1927-1932
[64]. Lancet Oncol. 2016;17(8):1081-1093
[65]. Lancet Oncol. 2021;22(6):801-812.
[66]. Lancet Oncol. 2021;22(11):1582-1596
[67]. Lancet. 2019;394(10214):2096-2107.
[68]. Lancet Oncol. 2021;22(4):512-524.
[69]. J Clin Oncol. 2012;30(18):2183-2189.
[70]. J Clin Oncol. 2024;42(3):273-282
[71]. Br J Haematol. 2016;174(4):571-581.
[72]. J Clin Oncol. 2017;35(16):1795-1802
[73]. Lancet Oncol. 2015;16(1):57-66.
[74]. JAMA. 2021;325(9):833-842.
[75]. N Engl J Med. 2018;379(26):2517-2528.
[76]. Lancet. 2016;387(10020):770-778.
[77]. J Clin Oncol. 2021;39(31):3441-3452.
[78]. N Engl J Med. 2023;388(4):319-332
[79]. Am J Hematol. 2023;98(4):571-579
[80]. Am J Hematol. 2023;98(11):1742-1750
[81]. Blood Adv. 2023;7(16):4349-4357
[82].Lancet Oncol. 2020;21(9):1188-1200.
[83]. Ann Oncol. 2015;26(8):1766-71.
[84]. J Clin Oncol. 2019;37(11):912-922.
[85]. Blood. 2018;132(23):2446-2455.
[86]. Clin Cancer Res. 2023;29(8):1440-1449.
[87]. J Hematol Oncol. 2021;14(1):130.
[88]. N Engl J Med. 2019;381(8):727-738.
[89]. N Engl J Med. 2018;379(10):934-947.
[90]. Lancet Oncol. 2019;20(1):57-73.
[91] Leukemia (2018) 32:1542–1560.
[92] Gynecol Oncol. 2018;148(3):507-514.
[93] Blood. 2009;113(18):4137-4143.
[94] Blood. 2023 May 25;141(21):2576-2586.
[95] Blood (2022) 140 (Supplement 1): 13248–13249.
[96] Support Care Cancer. 2019;27(5):1587-1588.
[97] 1. Cancer Res Treat. 2022;54(4):1268-1277.
[98] Eur J Cancer. 2022; 169:42-53.
[99] Radiation Emergency Medical Management. Myeloid cytokines for treatment of acute exposure to myelosuppressive doses of radiation: hematopoietic subsyndrome of acute radiation syndrome (H-ARS)[R/OL]. 2015[ 2020-11-25].
[100] 中华肿瘤杂志,2017; 39( 11): 868- 878.
[101] NCCN Guidelines Insights: Hematopoietic Growth Factors, Version 1.2020[J]. JNCCN, 2020, 18( 1): 12- 22
[102] 临床肿瘤学杂志.2021.26(7):638-648.
[103] 中华肿瘤防治杂志,2023,30(6): 333-340.
[104] 肿瘤药学, 2023, 13(1): 1-10.