中国抗癌协会
立即下载App【守护者】姜洁教授:发热性中性粒细胞减少的患者危险因素深度解析
【守护者】项目是中国抗癌协会(China Anti-Cancer Association,CACA)指导、中国抗癌协会康复分会发起的一项聚焦于中国肿瘤患者中性粒细胞减少的规范化诊疗项目,旨在深化临床对于中性粒细胞减少的风险评估、预防、监测和治疗的认识,为肿瘤患者足剂量、足疗程的治疗保驾护航。本期守护者项目,特邀山东大学齐鲁医院姜洁教授解析肿瘤患者中性粒细胞减少相关风险因素。

防治肿瘤治疗导致的中性粒细胞减少,风险评估必不可少
肿瘤治疗导致的中性粒细胞减少与多种因素相关,建议在首次化疗前及后续每个化疗周期开始前应对患者进行发热性中性粒细胞减少(FN)风险评估及分层管理,从而根据具体情况选择出更加适合患者的干预措施以减轻其接受肿瘤治疗而引发的血液学毒性。国外一些机构已开发出针对肿瘤患者中性粒细胞减少的风险评估模型,例如MASCC风险指数、CISNE临床指数等[1,2]。然而目前对于肿瘤治疗导致的中性粒细胞减少的发生风险尚无统一的评估模型,需由临床医生根据实际情况进行个体化的判断并对患者进行分层管理(见图1)。
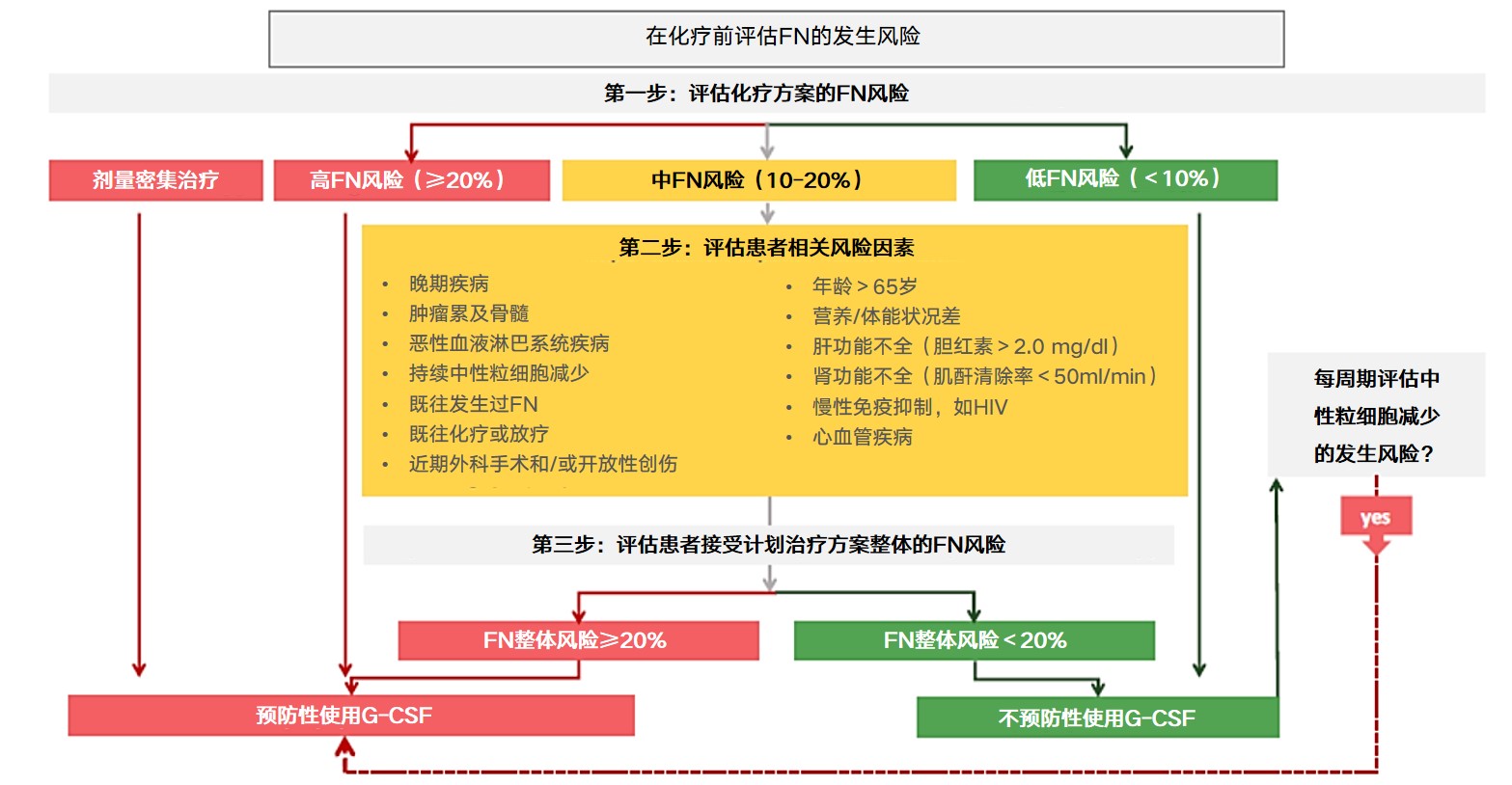
图1 对肿瘤患者进行FN风险评估及分层管理的路径[1]
在第1个化疗周期结束后及后续每个化疗周期前均应进行FN风险评价,如果患者在前一个化疗周期中曾发生FN或出现剂量限制性中性粒细胞减少事件,但本周期未计划降低剂量强度,则该患者从本周期开始属于高FN风险患者[2]。
患者自身相关危险因素亟待引起重视
除化疗方案相关因素外,患者相关危险因素也是影响FN发生风险的重要因素。研究显示,对于伴有FN危险因素的患者,FN导致其住院风险增加、计划平均相对剂量强度降低[3]。因而对于接受中、低FN风险化疗方案的患者,也应对其患者相关危险因素进行全面详尽的评估,以准确判定患者发生FN的总体风险。目前国内外主要的中性粒细胞减少症相关指南对于患者的FN危险因素认定如表1所示。此外,文献报道显示,一些未在指南中明确指出的患者危险因素,如伴随慢性阻塞性肺病(COPD)、应激性高血糖(SIH)等合并症,亦对FN及严重中性粒细胞减少的发生率具有有统计学意义的影响。针对其中广泛报道的患者FN危险因素,本次解析内容进行了详细的介绍。
表1 国内外主要的FN相关指南对于患者相关危险因素的认定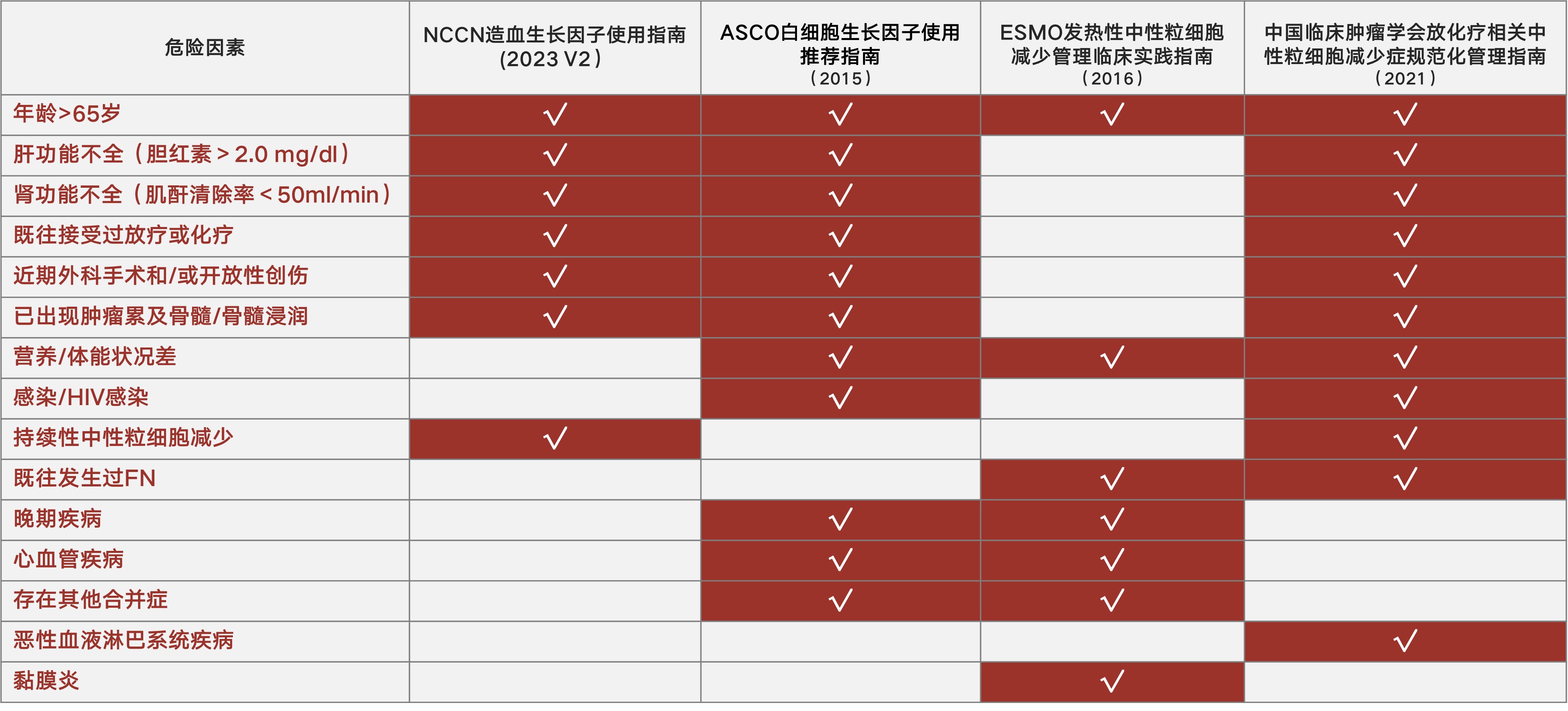
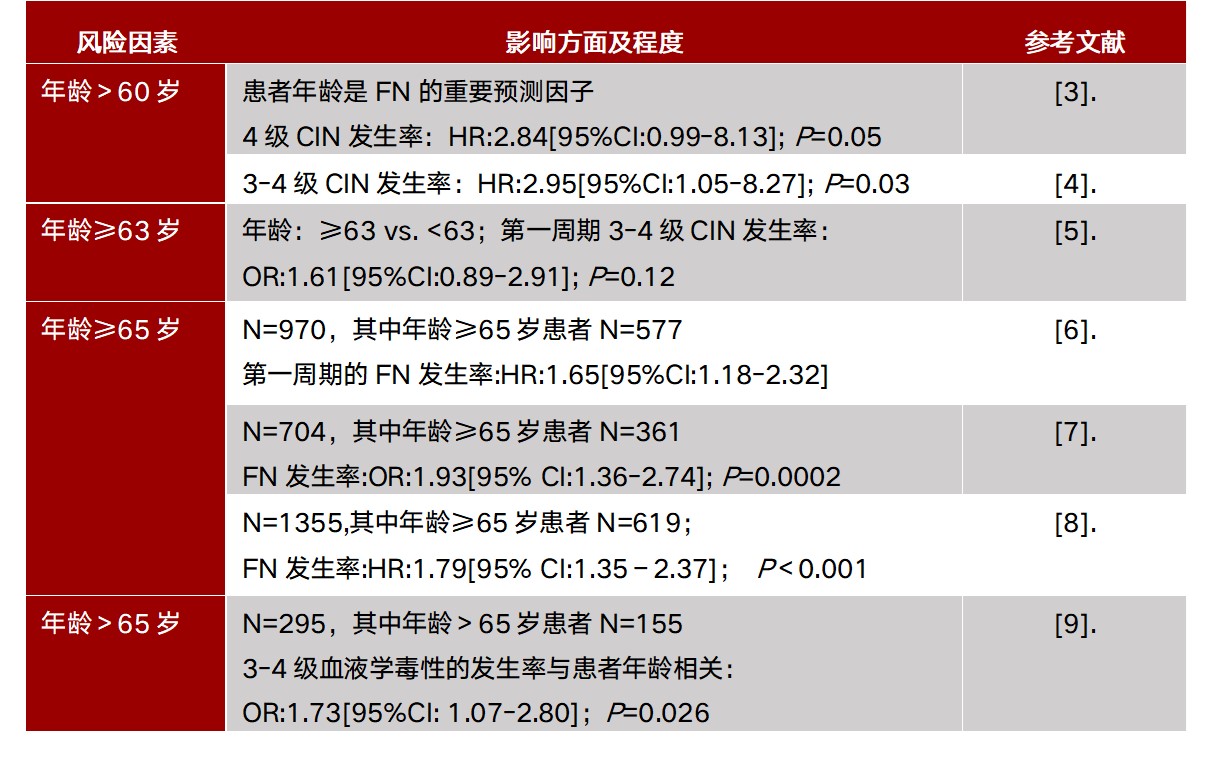
1. 患者年龄>65岁且接受足剂量强度化疗
高龄是中外指南广泛收录的患者相关FN危险因素,《美国国立综合癌症网络造血生长因子临床实践指南(2024.V2)》(以下简称NCCN指南)和《中国临床肿瘤学会肿瘤放化疗相关中性粒细胞减少症规范化管理指南(2021版)》将该风险因素定义为“患者年龄>65岁且接受足剂量强度化疗”;ASCO白细胞生长因子使用推荐指南(2015)(以下简称“ASCO指南”)与ESMO发热性中性粒细胞减少管理临床实践指南(2016)(以下简称“ESMO指南”)将其定义为“患者年龄 > 65岁”。详见表2。
表2. 患者相关FN危险因素:高龄
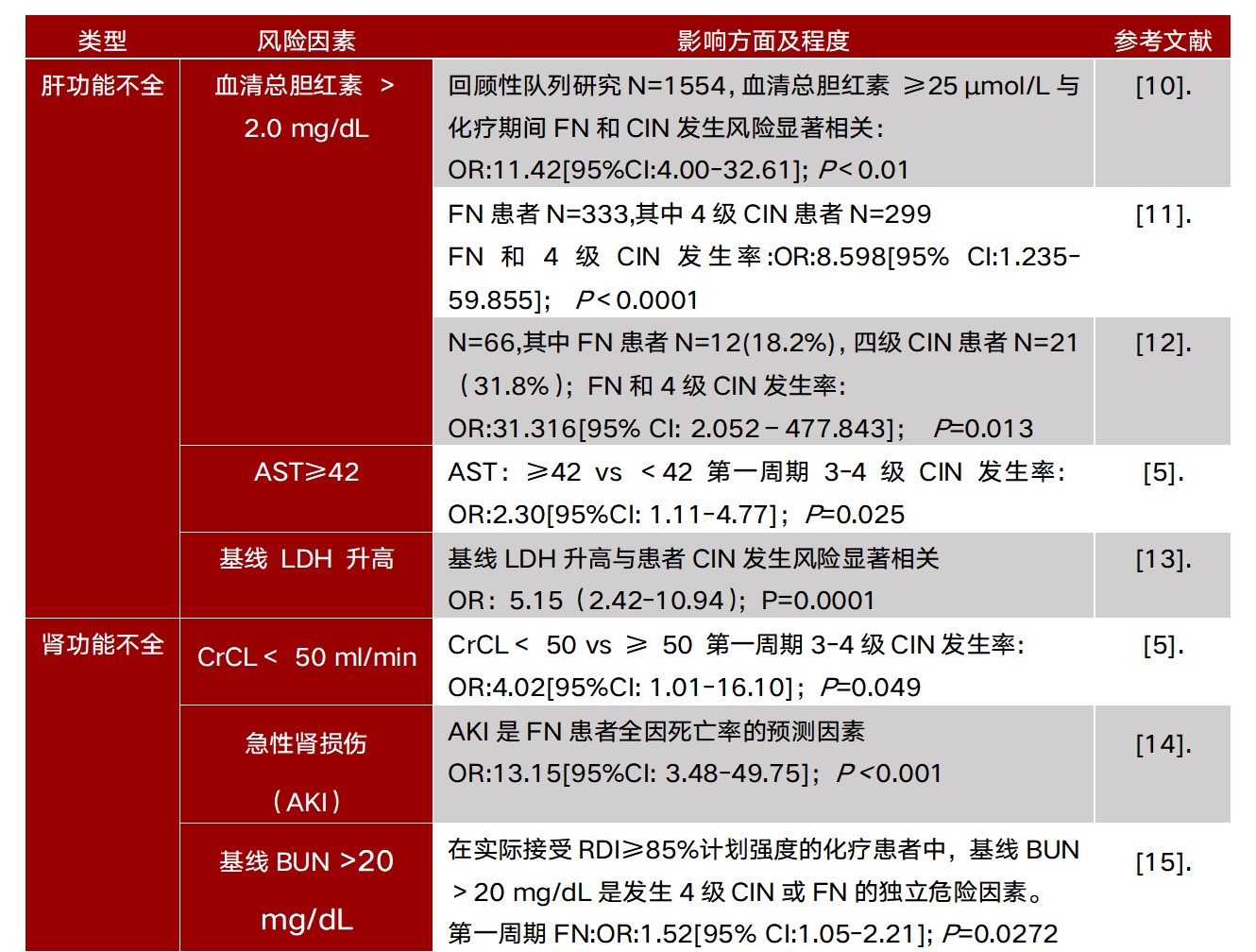
2. 肝肾功能不全
肝、肾功能不全作为患者相关危险因素被收录于NCCN、ASCO等指南中,其中“肝功能不全”评估指标为胆红素>2.0 mg/dL,“肾功能不全”评估指标为CrCl<50 ml/min。见表3。
表3. 患者相关FN危险因素:肝肾功能不全
 3. 既往接受过放疗或化疗
3. 既往接受过放疗或化疗
既往接受过放疗或化疗是NCCN、ASCO等指南认定的患者FN相关危险因素。一些回顾性研究的结果表明,既往放疗可能会增大骨髓抑制的发生率,是骨髓抑制性化疗患者发生3-4级CIN的独立预测因素。既往化疗史亦是患者发生FN的危险因素。一项基于240名非霍奇金淋巴瘤(NHL)患者数据的FN风险预测模型显示,既往化疗史与后续周期FN的发生风险显著相关(OR:6.39[1.72-23.68]; P = 0.006)[16]。一项纳入了976例常见恶性肿瘤化疗患者的回顾性研究结果表明,在接受RDI≥85%计划强度的化疗患者中,既往化疗史是发生4级CIN或FN的独立危险因素(OR:1.87[1.27-2.77]; P = 0.0016)[15]。
前次化疗后发生FN的患者,后续化疗过程中再次发生FN的风险为50~60%[2]。二级预防性使用G-CSF可显著降低患者再次发生FN的风险。二级预防同时还可促进前1个周期化疗导致中性粒细胞下降的恢复过程,保障下个周期化疗的足剂量以及按时进行。
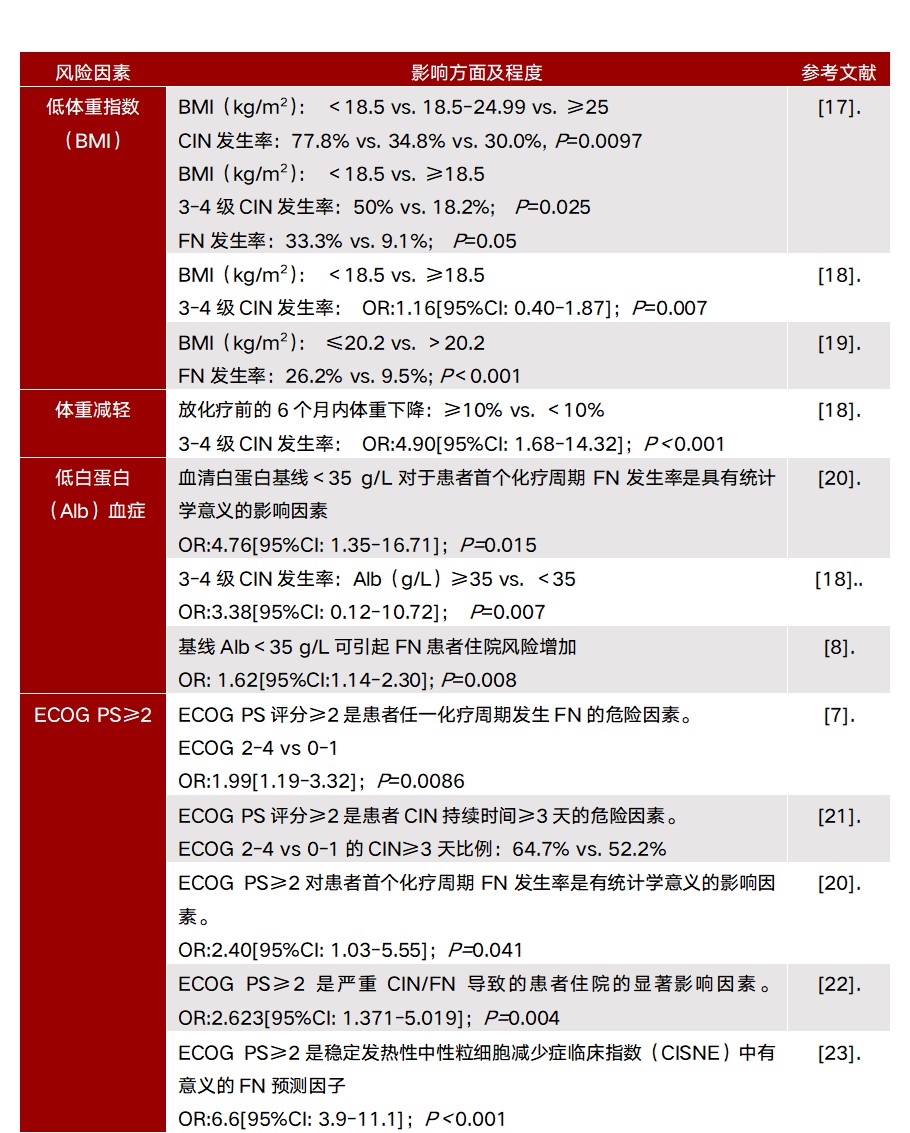
4. 营养/体能状况差
营养/体能状况差作为患者相关危险因素被收录于ASCO、ESMO等指南中,多项有关FN危险因素分析的研究将ECOG PS评分、低白蛋白血症、低体重指数或体重减轻作为FN风险评估的分层因素(表4)。
表4. 患者相关FN危险因素:营养/体能状况差
严重CIN发生风险与肿瘤体积大小、肿瘤临床分期显著相关;在接受化疗的IV期患者中,发生CIN的毒性风险显著提高(OR:8.4[6.1-11.5])[24];肿瘤转移部位≥3与化疗期间FN和CIN的发生风险显著相关:单因素分析OR:6.27 [3.28–11.96], P<0.001;多因素分析OR:6.33[2.66-15.11]; P < 0.001[10]。
6. 患者存在合并症[20, 25-26]

存在其他合并症是ASCO指南和ESMO指南收录的患者相关FN危险因素,据文献报道,合并症的数量、心/肝/肾合并症、慢性阻塞性肺病(COPD)、应激性高血糖(Stress hyperglycaemia)、消化性溃疡、既往其他癌症病史等因素均可作为患者FN风险的预测因素。
7. 肿瘤累及骨髓/恶性血液系统疾病/骨髓基线差
 图3. 患者相关FN危险因素:骨髓基线差
图3. 患者相关FN危险因素:骨髓基线差
恶性肿瘤侵犯骨髓并占据骨髓空间时,骨髓的正常造血功能受到抑制,导致其骨髓功能进一步恶化,可能并发贫血、血小板减少症等。患者的骨髓基线情况,包括各类基线血细胞计数或血红蛋白浓度,均与患者的FN发生风险密切相关[8, 27-29]。详见图3。
接受FN中风险化疗伴自身危险因素的患者,一级预防带来临床获益
对肿瘤治疗导致的中性粒细胞减少进行预防的主要目的是预防或减轻化疗期间中性粒细胞减少的程度,缩短中性粒细胞减少的持续时间,从而降低FN、严重感染和死亡的发生风险,保证患者的化疗相对剂量强度(relative dose intensity,RDI)。对于接受FN中风险化疗伴自身危险因素的患者,预防性使用rhG-CSF可降低化疗患者的FN及中性粒细胞减少的发生率、持续时间及严重程度,有助于保证患者完成足剂量、足疗程化疗[30];预防性使用长效rhG-CSF有效降低FN的发生率,减少化疗剂量延迟,改善老年患者的PFS和OS[31]。
总结:
指南建议对于接受中FN风险化疗方案的患者,需评估患者自身危险因素;若患者满足任意一项引起风险系数增加的因素时,建议预防性使用rhG-CSF[2]。然而在真实世界中,对于接受FN中风险化疗伴自身危险因素的患者,临床中rhG-CSF作为一级预防的应用率仍然存在不足。本次解析对文献中的患者FN危险因素进行了分类与总结,旨在进一步提升临床实践中对患者的FN危险因素评估意识并提供参考,及时识别伴有FN危险因素的患者并进行有效管理,以期更加有效地降低肿瘤治疗过程中的血液学毒性,保证患者接受足剂量、足疗程肿瘤治疗。

参考文献:
[1] 临床肿瘤学杂志,2021, 26(7): 638-648.
[2] 中华肿瘤杂志,2023, 45(7): 575-583.
[3] Cancer. 2003;98(11):2402-2409.
[4] Gynecol Oncol. 2012;125(3):625-630.
[5] Hematology. 2015;20(4):196-202.
[6] In Vivo. 2024;38(1):500-505.
[7] Leuk Lymphoma. 2003;44(12):2069-2076.
[8] Leuk Res. 2012;36(5):548-553.
[9] J Cachexia Sarcopenia Muscle.2022;13(3):1554-1564.
[10] Pharmacology. 2022;107(1-2):69-80.
[11] South Asian J Cancer. 2017;6(1):25-27.
[12] BMC Cancer. 2023;23(1):979.
[13] Chemo Open Access. 2023 Vol.11 Iss.2 No:1000182.
[14] IJID Reg. 2021;20:1:5-11.
[15] Cancer. 2007;110(7):1611-1620.
[16] Br J Haematol. 2009;144(5):677-685.
[17] Oncology. 2018;95(1):1-7.
[18] Br J Radiol. 2022;95(1130):20201004.
[19] Anticancer Res. 2023;43(1):247-254.
[20] Br J Cancer. 2011;105(5):612-617.
[21] Microorganisms. 2023 12;11(10):2547.
[22] J Geriatr Oncol. 2017;8(2):86-95.
[23] J Clin Oncol. 2015;33(5):465-471.
[24] Am J Clin Oncol. 2017 Oct;40(5):470-476.
[25] Ann Oncol. 2014 ;25(9):1821-1829.
[26] Breast Cancer Res Treat. 2013;138(2):621-631.
[27] Curr Radiopharm. 2023;16(1):50-56.
[28] Support Care Cancer. 2014;22(12):3219-3226
[29] Asia Pac J Clin Oncol. 2019;15(4):231-237
[30] Oncologist. 2007; 12(12):1416-1424.
[31] Cancer Res Treat. 2022;54(4):1268-1277.