中国抗癌协会
立即下载App“智能AI互动讲堂-抗血管生成药物成就妇科肿瘤治疗新希望” 医学专栏活动总结
2024年5月至12月,由中国抗癌协会指导、中国抗癌协会康复分会主办的“重塑生机,维来可期-肿瘤微环境重编程之大咖系列访谈”,将由来自肺癌、肉瘤、消化道肿瘤、肝胆胰肿瘤、妇科肿瘤的知名专家,梳理抗血管生成药物调控肿瘤微环境重编程从机制到临床应用的现状和展望,为未来抗肿瘤治疗的发展提供新思路。

肿瘤微环境中每种细胞类型和非细胞成分都以独特的方式调节肿瘤的免疫逃逸及介导肿瘤对常规治疗的原发耐药或获得性/适应性耐药。近几年,靶向肿瘤微环境不同成分的多种治疗方式被逐渐开发出来,为优化肿瘤治疗策略、提高肿瘤治疗疗效提供可能性。越来越多的证据表明,抗血管生成药物的作用机制不仅仅是抑制血管生长,还具有调控肿瘤微环境重编程的作用,在妇科肿瘤的临床治疗中,取得了很好的疗效并得到广泛应用。
本期“智能AI互动讲堂-抗血管生成药物成就妇科肿瘤治疗新希望”医学专栏创新性地采用了先由AI回答,再由专家评价及补充的议题讨论方式,本期分别邀请到东南大学附属中大医院沈杨教授、北京协和医院任彤教授、天津市中心妇产科医院刘彩艳教授、上海第十人民医院/同济大学附属第十人民医院贺银燕教授和中山大学肿瘤防治中心郑敏教授,结合我们的AI智能机器人小安,分别围绕“抗血管生成药物调控肿瘤微环境重编程,与化疗联合协同增效为卵巢癌一线&维持和铂敏感复发患者带来生存获益”、“抗血管生成药物调控肿瘤微环境重编程,与其他治疗方式(化疗/靶向治疗/免疫治疗)联合协同增效为铂耐药复发卵巢癌提供更多的治疗选择”、“结合抗血管生成药物调控肿瘤微环境重编程,展望抗血管生成药物联合方案在宫颈癌治疗中的应用前景”、“结合抗血管生成药物调控肿瘤微环境重编程,展望抗血管生成药物联合方案在子宫内膜癌治疗中的应用前景”及“结合抗血管生成多靶点酪氨酸激酶抑制剂(TKIs)调控肿瘤微环境重编程,谈谈抗血管生成TKIs作为贝伐珠单抗经治患者治疗的机制基础及临床研究数据”,共同探讨抗血管生成药物通过调控肿瘤微环境重编程,实现与化疗,靶向,免疫治疗药物等联合协同增效的机制,并最终从机制到临床,探讨抗血管生成药物在妇科肿瘤领域的研究进展和未来展望,以更好地优化治疗策略,提高肿瘤治疗的疗效。
议题1:抗血管生成药物调控肿瘤微环境重编程,与化疗联合协同增效为卵巢癌一线&维持和铂敏感复发患者带来生存获益
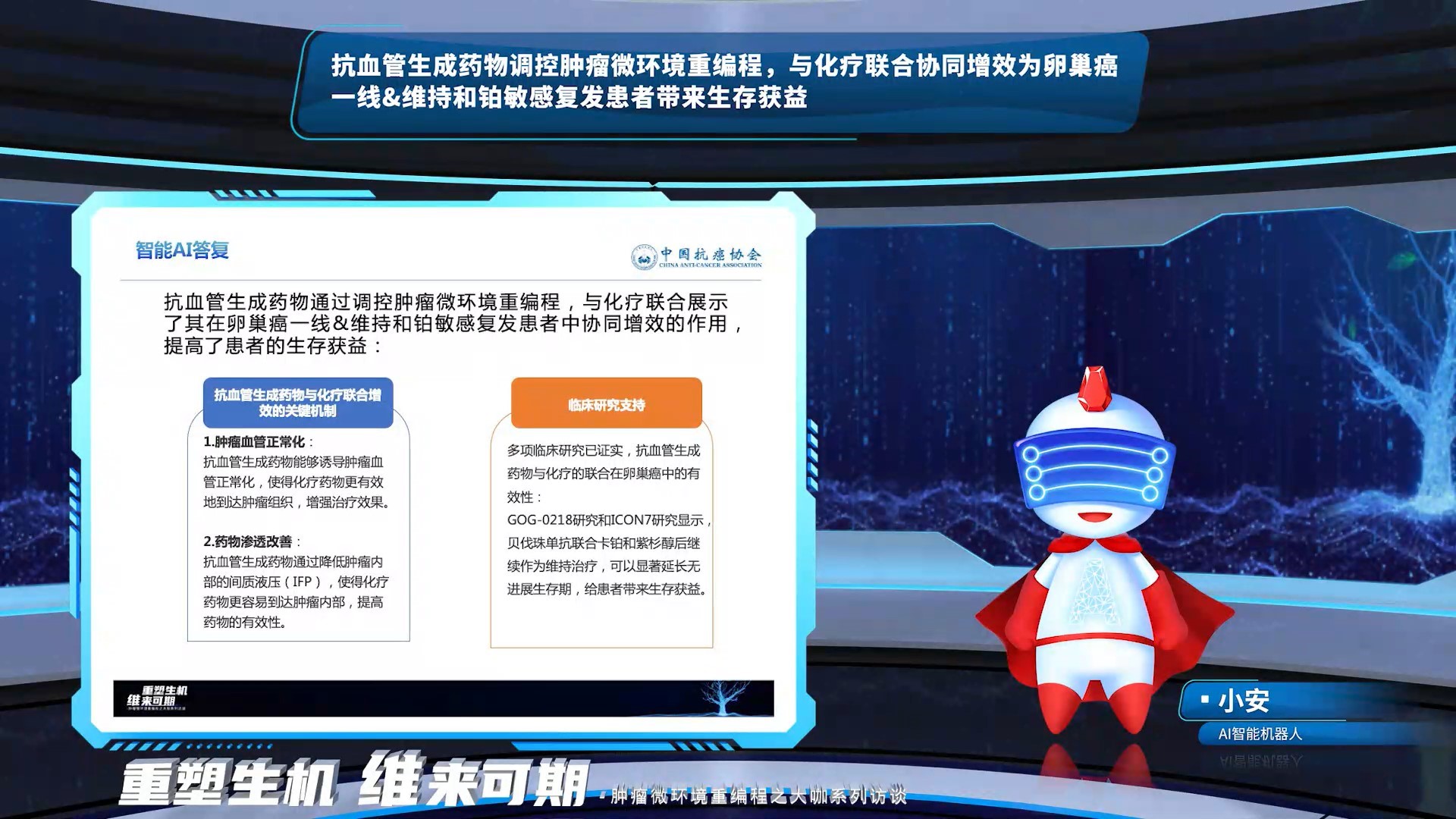
AI指出抗血管生成药物通过调控肿瘤微环境重编程,与化疗联合展示了其在卵巢癌一线&维持和铂敏感复发患者中协同增效,并提高了患者的生存获益。抗血管生成药物调控肿瘤微环境重编程的关键机制主要包括2个方面:肿瘤血管正常化和药物渗透的改善。GOG-0218研究和ICON7研究均已证实贝伐珠单抗联合化疗后继续作为维持治疗为卵巢癌患者带来生存获益。
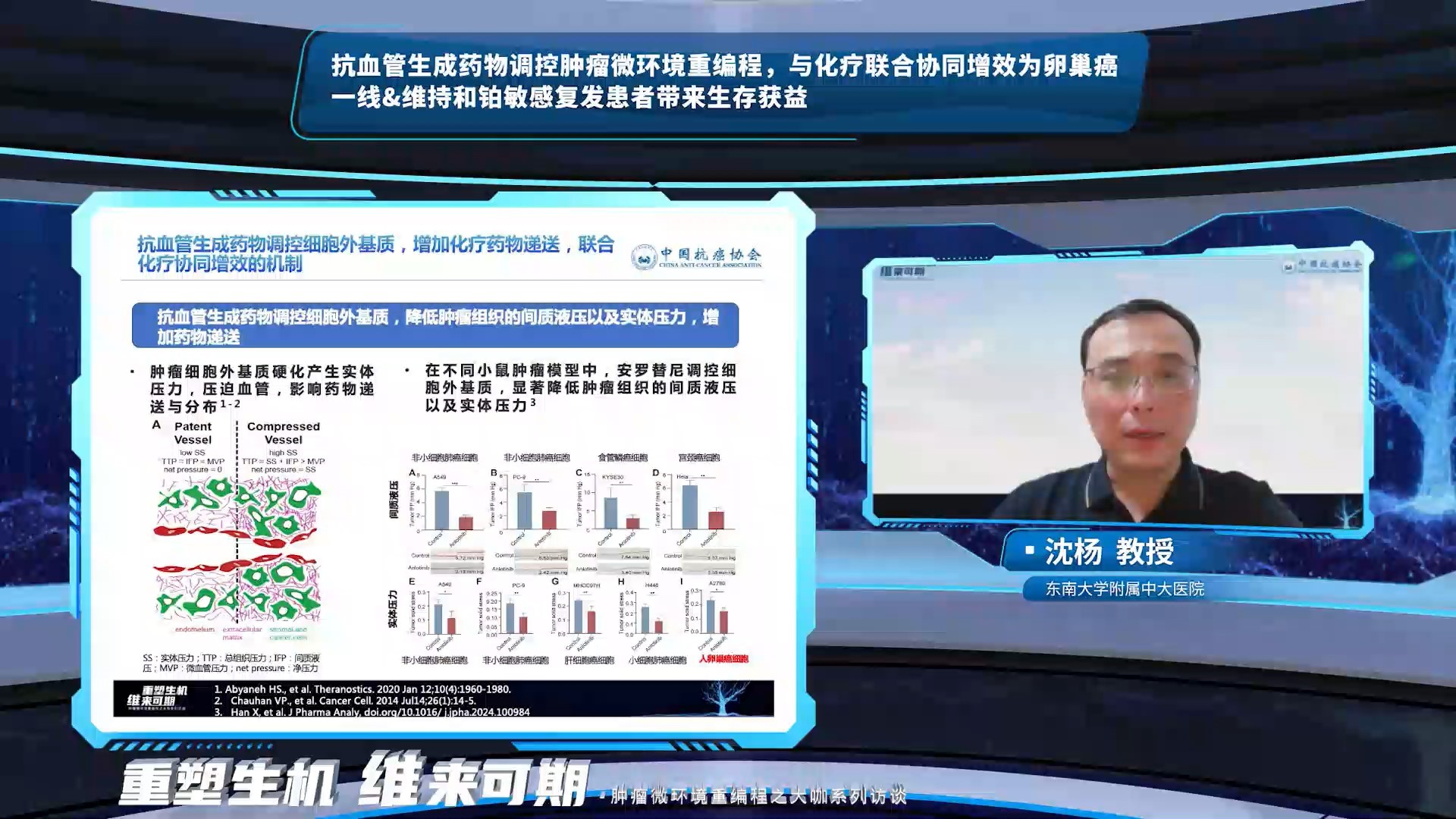
沈杨教授在AI回答的基础上,对本议题进行了进一步的补充,抗血管生成药物除了通过调控血管基质重编程使肿瘤血管正常化,从而增加血流灌注,增加药物递送及其在肿瘤组织中的分布。抗血管生成药物还通过调控肿瘤细胞外基质,降低肿瘤组织的间质液压以及实体压力,增加药物递送,联合化疗协同增效。基础研究显示,在卵巢癌小鼠模型中,安罗替尼显著提高卡铂和紫杉醇在肿瘤部位的分布,并延长分布时间。除了GOG-0218研究和ICON7研究,安罗替尼联合卡铂/紫杉醇一线及维持治疗新诊断晚期卵巢癌显示出初步的疗效。OCEANS研究、GOG-0213研究和MITO16b研究均证实,化疗基础上联合贝伐珠单抗能够为铂敏感复发卵巢癌患者带来生存获益。
议题2:抗血管生成药物调控肿瘤微环境重编程,与其他治疗方式(化疗/靶向治疗/免疫治疗)联合发挥协同的抗肿瘤效果,为铂耐药复发卵巢癌提供更多的治疗选择

AI提出铂耐药复发卵巢癌的治疗一直是临床中的一大挑战。抗血管生成药物通过抑制血管新生、促进肿瘤血管正常化、调节免疫微环境以及调节肿瘤细胞代谢和存活,在铂耐药复发卵巢癌的治疗中,联合化疗、免疫治疗、靶向治疗和放疗发挥协同增效的作用。
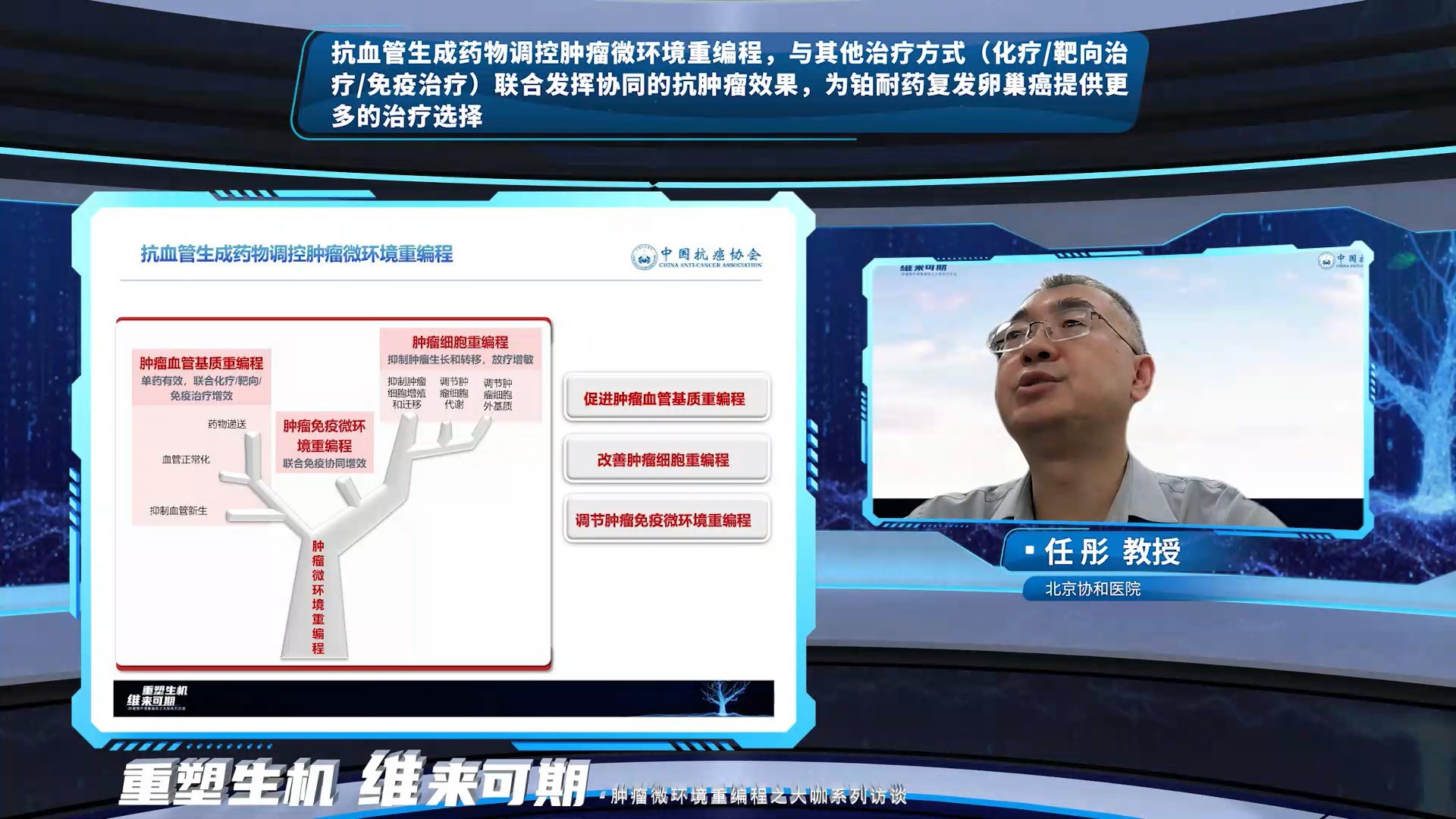
任彤教授对AI的回复给予了肯定,并结合抗血管生成药物在铂耐药复发卵巢癌中的临床研究,对本议题做了更深入的探讨。抗血管生成药物除了调节血管基质重编程和肿瘤细胞外基质,诱导血管正常化,促进药物在肿瘤组织中的分布,还能调控免疫微环境重编程,促进肿瘤组织中免疫细胞浸润,联合免疫治疗协同增效。不同的抗血管生成药物调控肿瘤微环境重编程的机制各不相同,如安罗替尼可以通过促进肿瘤血管基质重编程、改善肿瘤细胞重编程及调节免疫微环境重编程实现对肿瘤微环境重编程的整体调控作用,发挥单药有效和联合增效的机制基础。从机制到临床应用,阐述了抗血管生成药物联合化疗、PARP抑制剂、新型抗体偶联药物(ADC)和免疫检查点抑制剂在铂耐药复发的卵巢癌治疗中显示出良好的抗肿瘤活性。
议题3:结合抗血管生成药物调控肿瘤微环境重编程的作用机制,展望抗血管生成药物联合方案在宫颈癌治疗中的应用前景
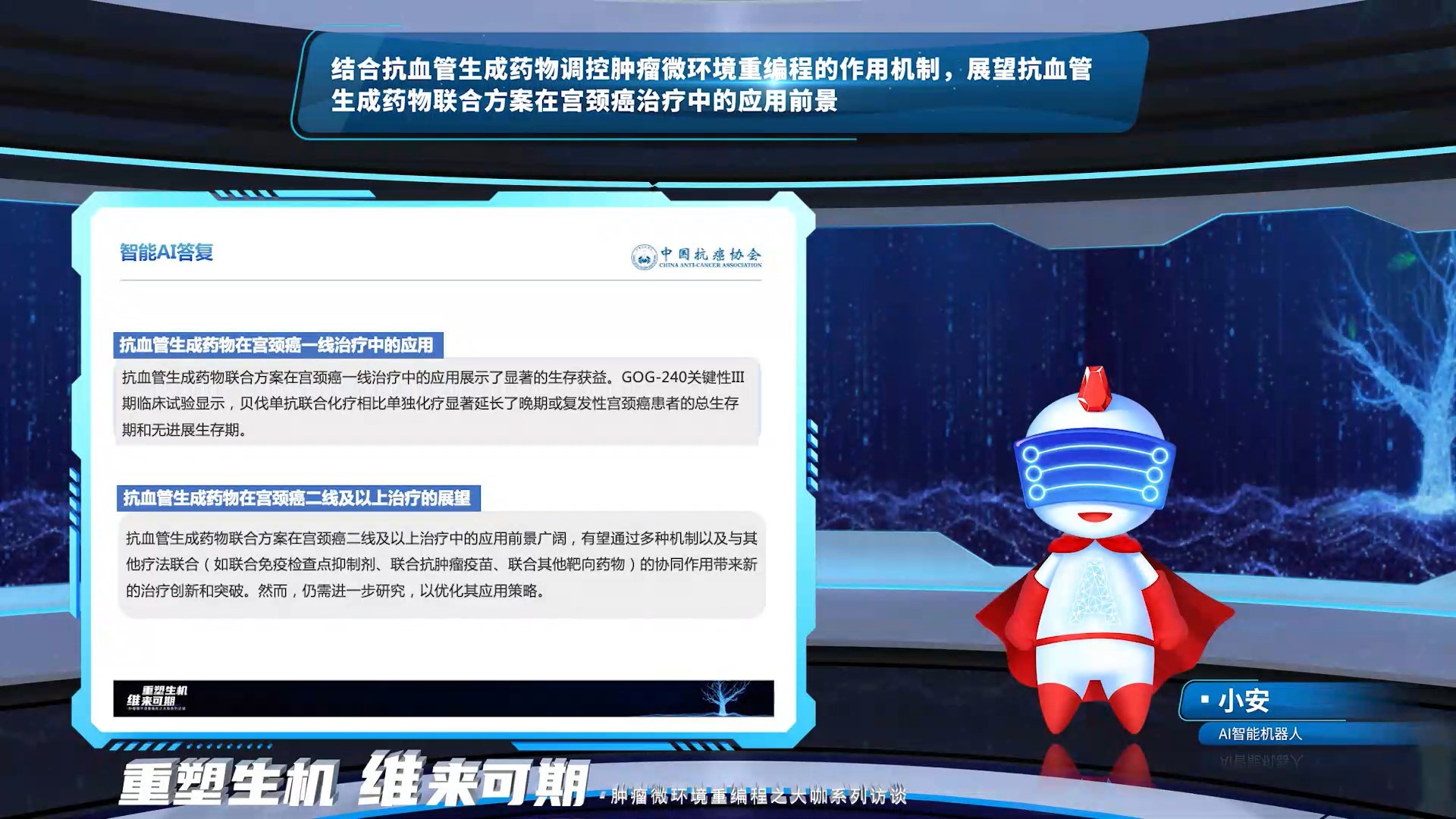
AI回复,基于GOG-240研究结果,抗血管生成药物联合方案在宫颈癌一线治疗中的应用展示了显著的生存获益。抗血管生成药物联合方案在宫颈癌二线及以上治疗中的应用前景广阔,有望通过多种机制以及与其他疗法联合(如联合免疫检查点抑制剂、联合抗肿瘤疫苗、联合其他靶向药物)的协同作用带来新的治疗创新和突破。
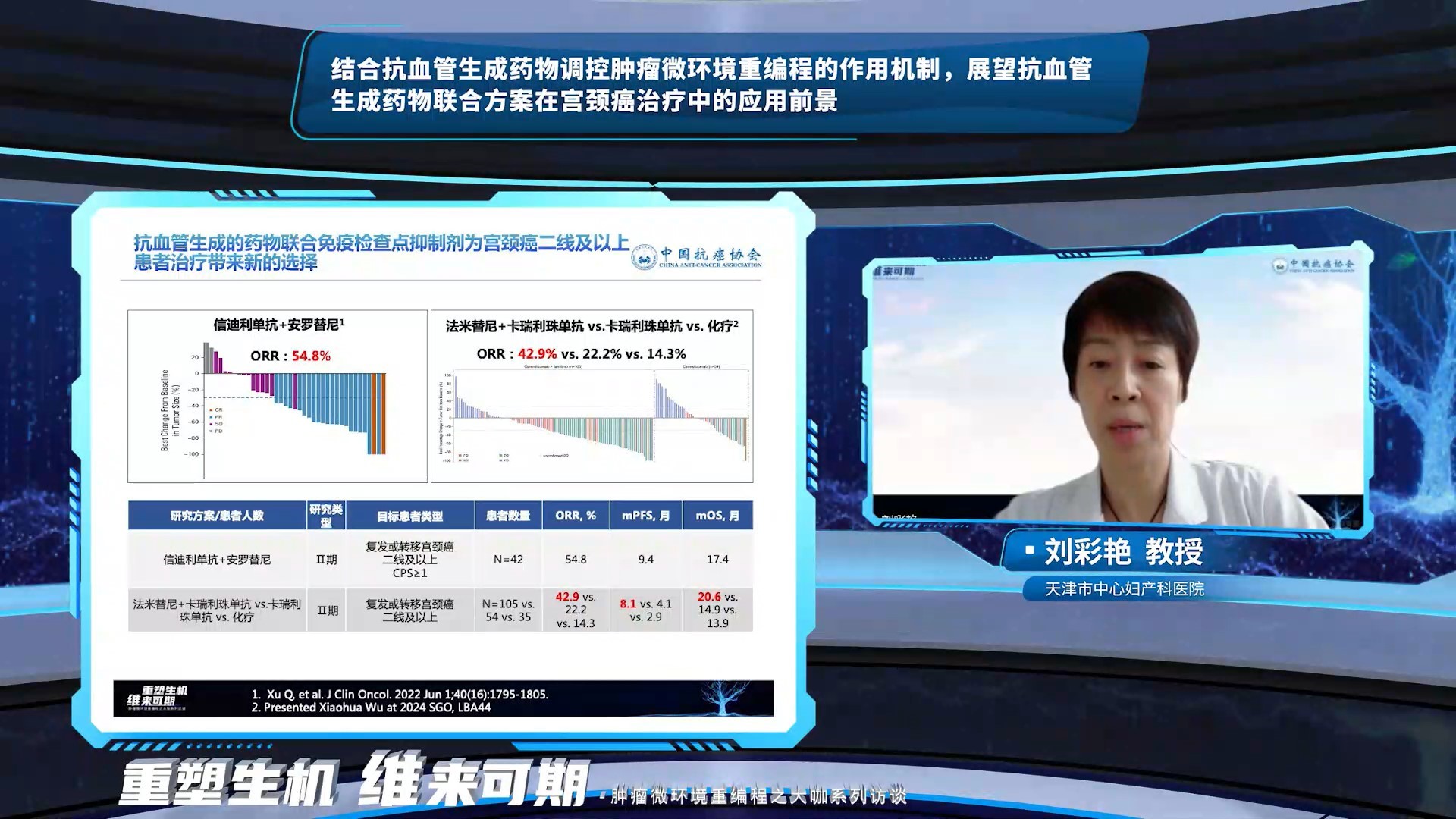
刘彩艳教授在AI回复的基础上,结合临床实践做了更详细的补充。在宫颈癌一线治疗中,GOG-240研究显示,化疗联合贝伐单抗组相对于单独化疗组PFS和OS均显示更好的获益。KEYNOTE-826和BEATcc研究也显示,在化疗和免疫治疗的基础上,联合抗血管生成药物可进一步提高宫颈癌治疗疗效。除了贝伐珠单抗,安罗替尼联合派安普利单抗和减量化疗一线治疗持续性、复发性或转移性宫颈癌展现初步疗效。目前,晚期宫颈癌患者二线及以上治疗尚无标准治疗方案,安罗替尼+信迪利单抗、法米替尼+卡瑞利珠单抗二线及以上治疗复发或转移性宫颈癌取得良好的抗肿瘤效果,抗血管生成药物调控肿瘤微环境重编程,联合免疫检查点抑制剂协同增效,为宫颈癌二线及以上治疗提供新的探索方向。
议题4:结合抗血管生成药物调控肿瘤微环境重编程,展望抗血管生成药物联合方案在子宫内膜癌治疗中的应用前景

AI指出单独使用抗血管生成药物在治疗子宫内膜癌可能会面临抗药性和治疗效果不佳的问题。抗血管生成药物调控肿瘤微环境重编程,联合免疫治疗、化疗和靶向治疗,为实现更好的治疗效果提供了多种可能性。
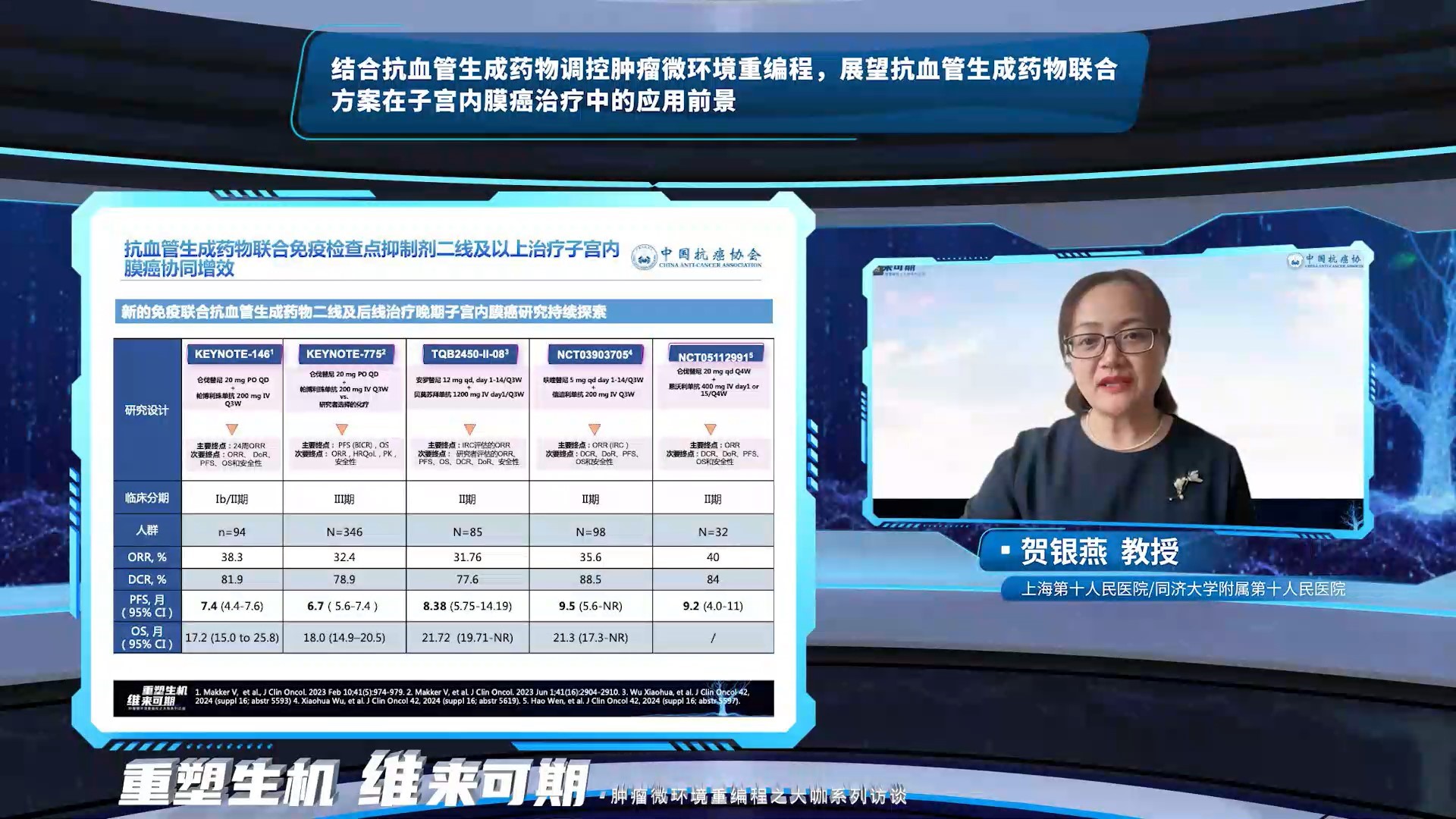
贺银燕教授表示AI针对该议题的回答比较概括,她结合子宫内膜癌的肿瘤本身特征,深刻探讨了抗血管生成药物在子宫内膜癌的应用前景。血管内皮生长因子(VEGF)不但在子宫内膜正常生理性血管生成中具有重要作用,血管生成在子宫内膜癌的生长,浸润,转移中也发挥着重要作用,抗血管生成药物在子宫内膜癌治疗中广泛应用并取得显著疗效。KEYNOTE-775研究显示,与医生选择的化疗方案相比,帕博利珠单抗联合仑伐替尼二线和后线治疗晚期子宫内膜癌显著改善pMMR和总人群的生存。新的免疫联合抗血管生成药物研究方案持续探索,贝莫苏拜单抗联合安罗替尼治疗复发性或转移性子宫内膜癌的II期临床研究显示出有希望的抗肿瘤活性,为子宫内膜癌二线及以上治疗带来更多选择。复发/转移性子宫内膜癌的免疫治疗方案逐渐从二线走向一线,NRG-GY018和RUBY研究最新研究数据显示,含铂化疗的基础上联合免疫检查点抑制剂一线治疗局部晚期、转移性或复发性子宫内膜癌有效改善患者预后,或将成为晚期子宫内膜癌一线治疗的新标准。在化疗+免疫治疗的基础上联合抗血管生成药物一线治疗晚期子宫内膜癌的探索性临床研究正在开展,有望进一步提高疗效。
议题5:结合抗血管生成多靶点酪氨酸激酶抑制剂(TKIs)调控肿瘤微环境重编程,谈谈抗血管生成TKIs作为贝伐珠单抗经治患者治疗的机制基础及临床研究数据

AI指出贝伐珠单抗在妇科肿瘤中广泛应用,长期使用或肿瘤生物学特性的改变都可能导致药物疗效下降,贝伐珠单抗耐药机制主要包括上调替代性血管生成因子和激活补偿性信号通路。而抗血管生成多靶点TKIs通过抑制多重血管生成途径、调控肿瘤基质与间质以及增强联合治疗效果全面调控肿瘤微环境重编程,为贝伐珠单抗经治的患者,提供有效治疗的机制基础。
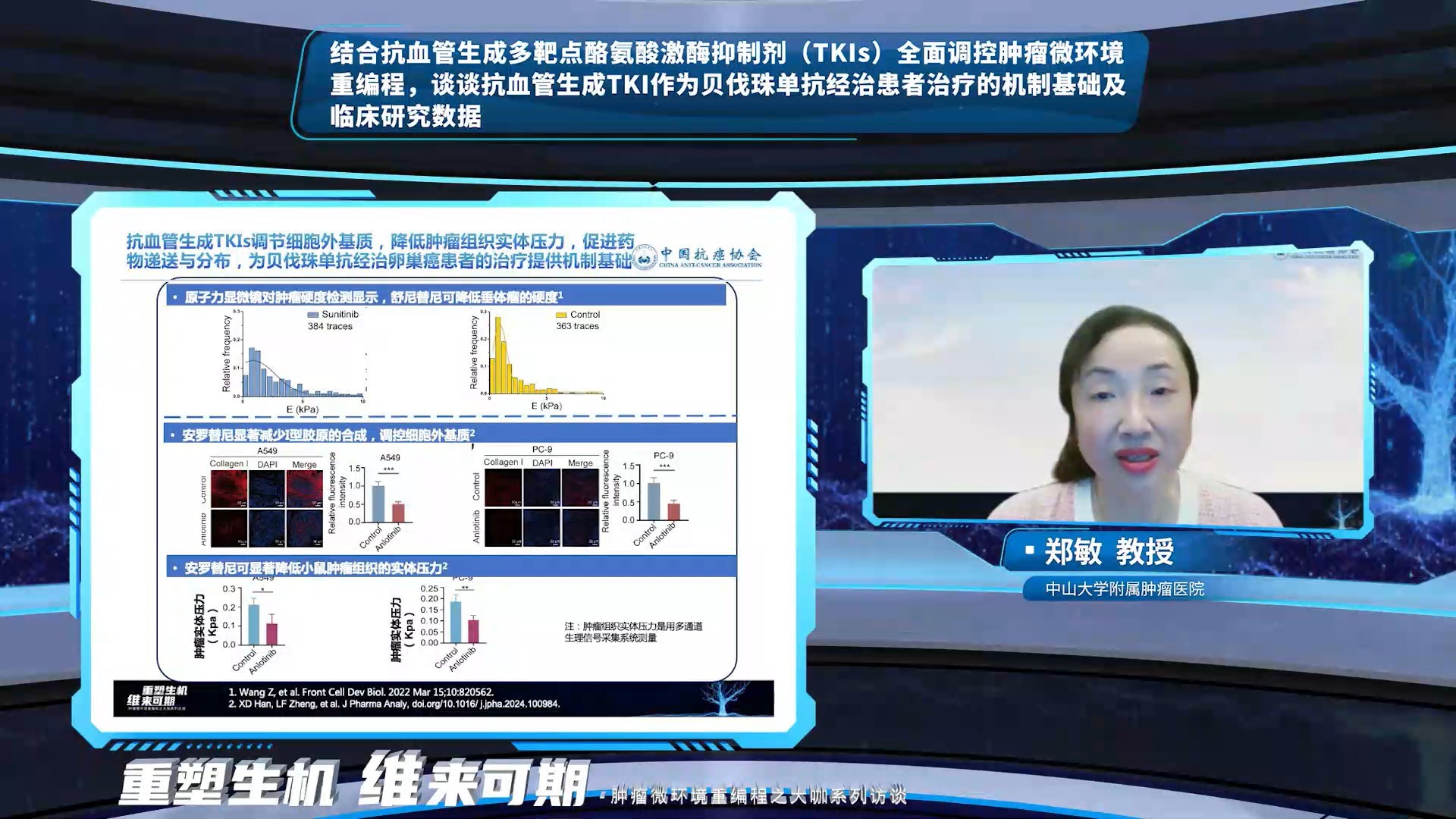
郑敏教授对AI的回复给予了肯定,并结合临床研究数据做了进一步的解释和补充。相较大分子VEGF单抗,小分子TKIs的靶点较多,同时抑制多个血管生成通路和信号传导途径,能够有效克服贝伐珠单抗单一通路抑制剂产生的耐药性。除了血管生成相关通路,小分子TKIs还能阻断肿瘤微环境中的其他相关通路,如c-kit通路、c-Met通路和RET通路,抑制肿瘤细胞增殖和迁移。此外,诱导胶原沉积和细胞外基质硬化,也可能作为贝伐珠单抗耐药机制之一,小分子TKIs如舒尼替尼和安罗替尼可以调节肿瘤细胞外基质,降低肿瘤组织实体压力,促进药物递送与分布。安罗替尼+尼拉帕利治疗铂耐药复发卵巢癌的ANNIE研究,以及安罗替尼联合贝莫苏拜单抗治疗铂耐药或难治性卵巢癌ACTION研究,均显示小分子TKIs联合靶向/免疫可能为贝伐珠单抗经治卵巢癌患者提供更多治疗选择。
综上,本次医学专栏中妇科肿瘤领域的五位知名专家和智能AI一起结合抗血管生成药物通过调控肿瘤微环境重编程,与化疗、靶向治疗、免疫治疗及放疗等联合协同增效,深入探讨了其在妇科肿瘤领域的前沿应用和未来展望。为优化妇科肿瘤的治疗策略,指导临床实践,提供了新的思路和方法,期待未来在妇科肿瘤领域能够有更多突破性的治疗进展,为患者提供更多治疗选择。