中国抗癌协会
立即下载App【患者招募】局部晚期或转移性的胃和胃食管结合部癌患者临床试验信息分享(注射用重组人源化抗HER2双特异性抗体治疗)
背景信息
现多家医院正在进行一项“评估KN026在HER2过表达和中低表达的晚期胃及胃食管结合部癌受试者中的有效性、安全性和耐受性II期临床研究(方案号:KN026-202)”。
KN026是注射用重组人源化抗HER2双特异性抗体,已获得国家食品药品监督管理总局的批准,临床批件号:2018L02285
主要入选标准
1.年龄≥18周岁且≤75周岁,男女不限
2.患有局部晚期或转移性的胃和胃食管结合部癌
3.对于各队列,还需满足以下入选条件:
队列1:HER2过表达胃癌患者(IHC3+,或IHC2+且ISH方法确认HER2基因扩增得到阳性检测结果)
队列2:HER2中低表达胃癌患者(IHC2+且ISH方法确认HER2基因扩增得到阴性检测结果,或者IHC1+且ISH检测得到阳性结果)
4.既往至少接受过一线标准系统治疗
5.ECOG评分0或1分,预期寿命超过3个月
6.既往无免疫缺陷病史、合并其他恶性肿瘤或活动性感染等
7.既往无心血管病史
8.给药前4周内不能接受过其他抗肿瘤治疗
9.给药前2周内不能接受过系统性皮质激素(>10mg/天强的松,或等当量的其他皮质激素)或免疫抑制剂治疗开始研究治疗前4周内未接受过放疗,允许给药前2周接受姑息性放疗
注:以上标准只是初筛,是否能够入组,以医生的判定为准
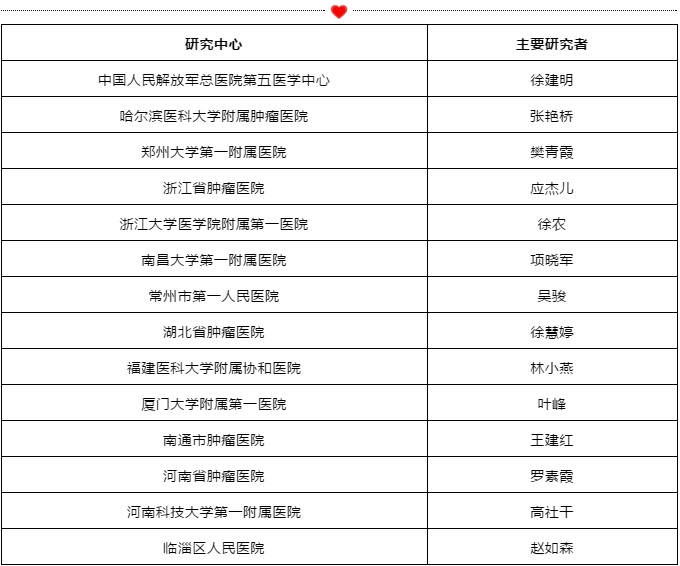
研究中心
转自:中国人民解放军总医院第五医学中心