中国抗癌协会
立即下载App【守护者】宋国红教授:预防为先——肿瘤治疗中性粒细胞减少一级预防策略详解
化疗相关中性粒细胞减少是肿瘤放化疗最常见的血液学毒性,是肿瘤辅助治疗偏离既定方案的重要原因。一级预防作为防治化疗相关中性粒细胞减少的重要手段,对于保障患者治疗、改善患者预后具有重要意义。本期【守护者】特邀北京大学肿瘤医院宋国红教授,对化疗相关中性粒细胞减少与FN一级预防的关键策略及问题进行深入解析与探讨,旨在促进广大医药从业者对于肿瘤治疗综合管理的深入理解与重视。
一、国内外指南广泛推荐G-CSF用于FN的一级预防
目前预防中性粒细胞减少的措施以预防性使用G-CSF为主。预防性使用G-CSF可降低化疗患者的中性粒细胞减少和FN发生率、持续时间及严重程度,有助于保证患者足剂量、足疗程化疗。国内外指南广泛推荐G-CSF用于肿瘤治疗相关中性粒细胞减少及FN的预防(表1)。
表1. 国内外指南推荐G-CSF用于中性粒细胞减少/FN的预防
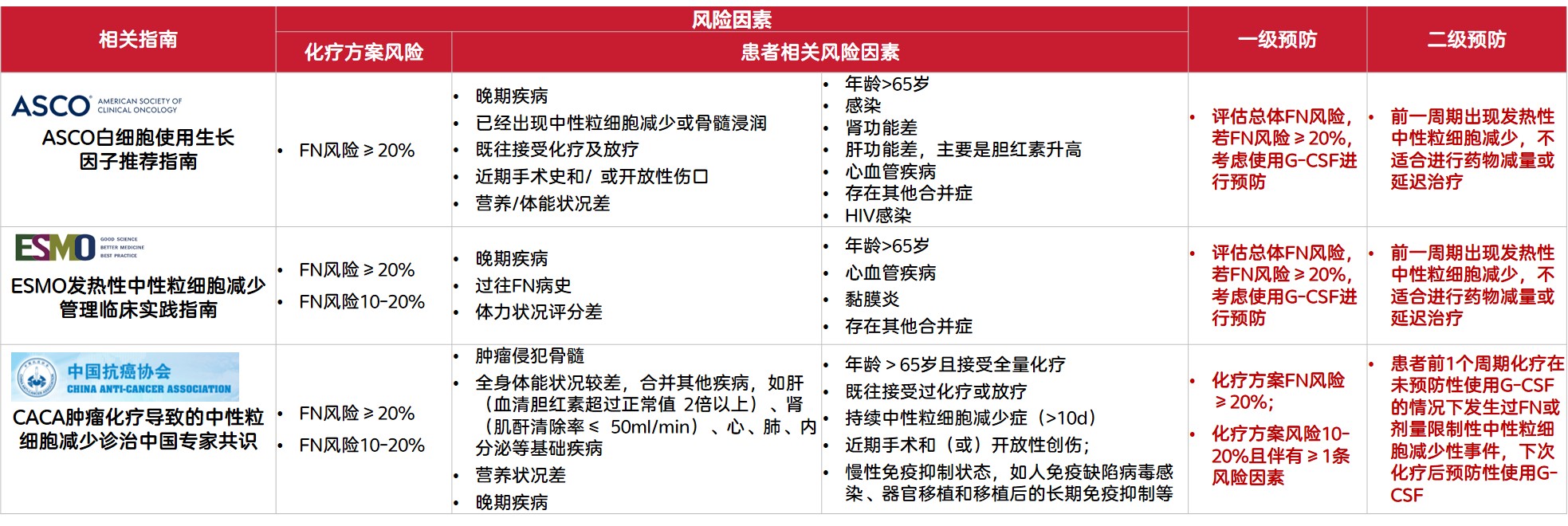
一级预防是指首次使用具有骨髓抑制作用的化疗药物后24-72h预防性使用G-CSF[1]。NCCN造血生长因子临床实践指南(2024.V3)(NCCN指南)建议在首个化疗周期前进行FN的风险评估,推荐对接受FN高风险(≥20%)化疗方案和接受FN中风险(10~20%)化疗方案合并≥1个危险因素的患者应用G-CSF进行一级预防[2]。
二、肿瘤治疗导致中性粒细胞减少一级预防的关键问题探讨
2.1接受FN中风险化疗方案的患者存在预防不足的情况
FN在真实世界中的发生率高于随机对照临床研究,临床实践中接受 FN中风险化疗方案的患者存在预防不足的情况。一项纳入65项观察性研究(n=7812)和110项RCT研究(n=42257)、包含29种化疗方案的系统性回顾研究结果表明:观察性研究中的FN率显著高于RCT:RCT中13%的FN发生率,对应观察性研究中的FN发生率可能高达20%[3]。该现状可能与临床实践中对于患者的基础健康状况等患者自身危险因素评估不充分以及经济因素所限有关。
虽然G-CSF一级预防比例逐年增加,但高/中风险患者的预防比例仍不足,尤其是FN中风险伴危险因素的患者一级预防严重不足。一项纳入1995-2015年间接受化疗的肿瘤患者的队列研究显示,接受中/高FN风险化疗方案患者的G-CSF一级预防使用比例从1995年的5.5%增加到2015年的52.7%,但仍有很大比例的中/高FN风险患者未接受G-CSF一级预防(图1)[4]。总的来说,接受G-CSF一级预防的患者FN发生率降低,化疗延迟、剂量减少的发生率降低,住院天数减少[5]。因此,治疗前充分评估患者的FN风险,全面识别危险因素,充分给予一级预防,对于改善FN中危患者预后有重要意义(表2)。
图1. G-CSF一级预防比例逐年增加,但高/中风险患者的预防比例仍不足
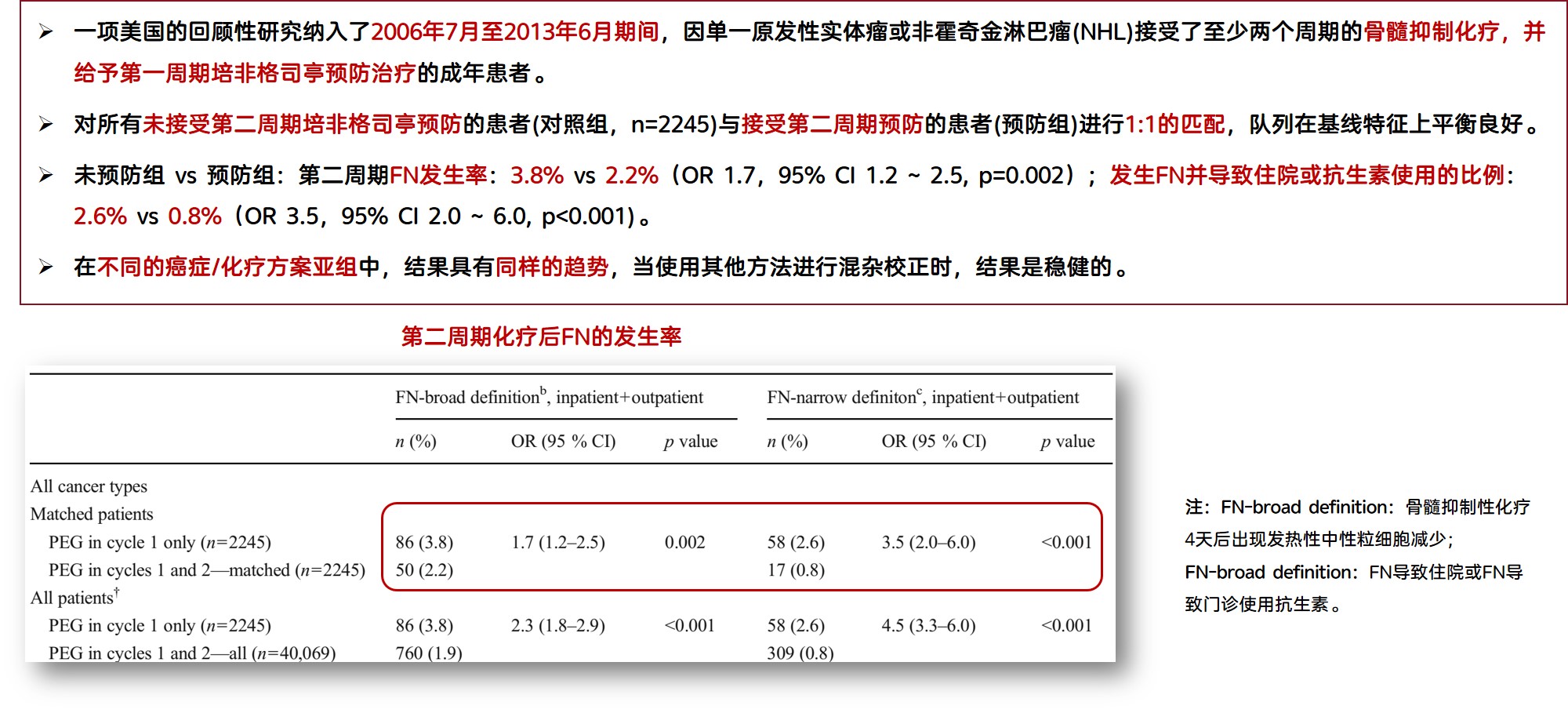
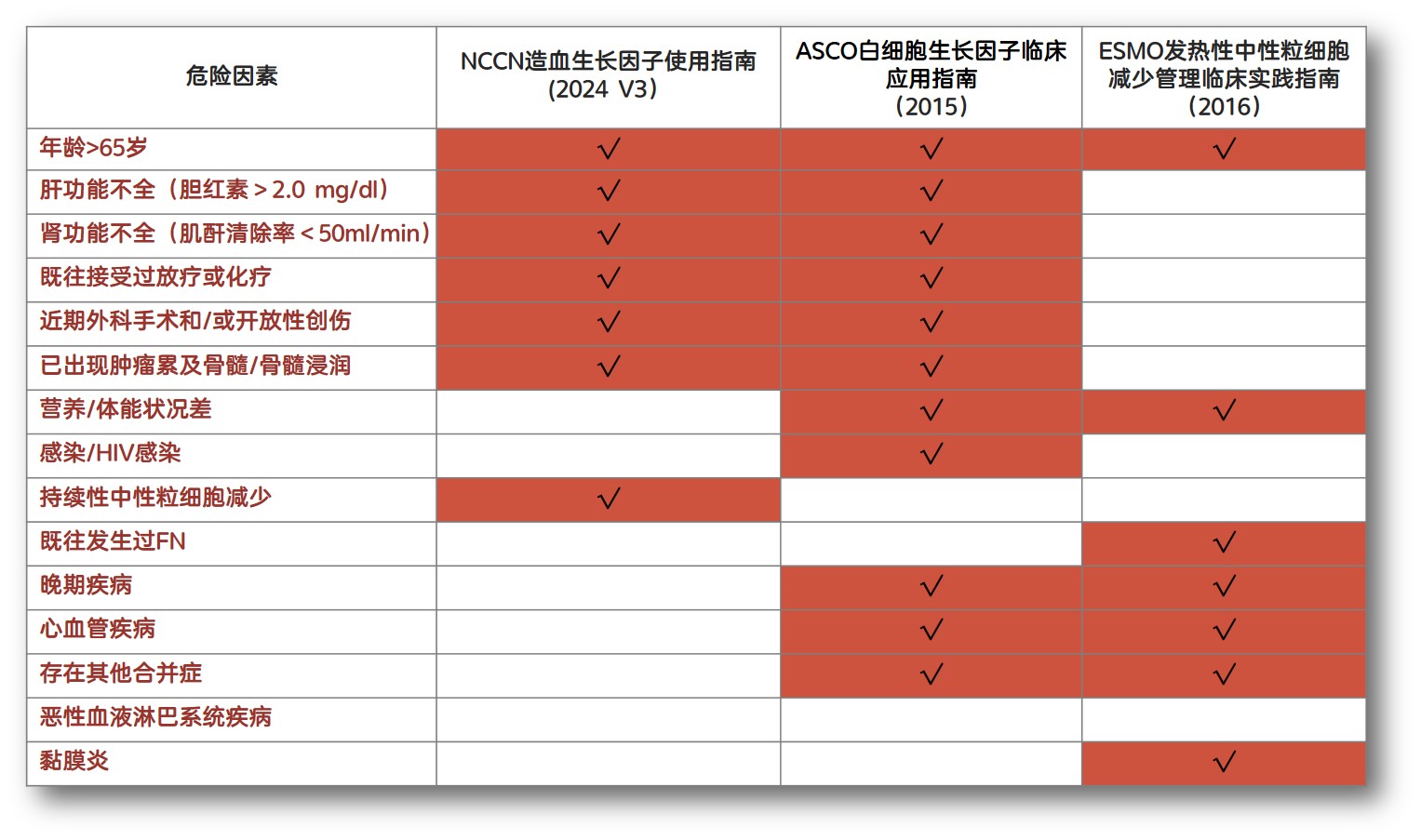
表2. 指南规定的患者FN危险因素
2.2应进行足剂量足疗程的G-CSF预防,中断预防可能导致患者FN风险增加
一项回顾性研究纳入了至少接受了两个周期化疗并于第一周期给予长效G-CSF预防的成年患者,对于第二周期未接受预防与接受长效G-CSF预防的患者(未预防组 vs 预防组),其第二周期FN发生率为3.8% vs 2.2%(OR 1.7, 95% CI: 1.2-2.5, P=0.002);发生FN并导致住院或抗生素使用的比例为2.6% vs 0.8%(OR 3.5, 95% CI: 2.0-6.0, P<0.001);在不同癌症/化疗方案亚组中,结果具有同样的趋势,表明中断G-CSF预防的患者FN风险增加,可能导致感染等不良后果,因而G-CSF预防应当足疗程进行(图2)[6]。
图2. 中断预防的患者FN风险增加,可能导致感染等不良后果

2.3 长效G-CSF有效降低FN的发生,且能提高患者依从性
在真实世界中,长效G-CSF相较于短效G-CSF更有效降低FN的发生。STOP FN in NHL 2研究是日本开展的一项回顾性观察性研究,纳入接受R-CHOP治疗的B-NHL患者,观察其G-CSF的使用情况和FN的发生情况。结果显示在第一周期应用长效G-CSF(22.2%)、短效G-CSF(52.1%)和不进行预防(25.6%)的人群中,其第一周期FN的发生率分别为3.8%、7.4%和23.3%。由于长效G-CSF可以较好地降低FN的发生且使用便捷,在第二及后续周期,长效G-CSF的使用率提升至72.6%;在发生FN的患者中使用率则提升至92.0%,提升了患者依从性[7]。
三、长效G-CSF用于一级预防的特殊场景
3.1 特殊人群用药
多项研究表明G-CSF可有效预防儿童患者FN及感染,且G-CSF类药物在儿童患者中具有与成人患者相似的PK/PD,安全性良好[8]。ASCO白细胞生长因子临床应用指南(ASCO指南)建议:FN高风险的儿童患者采用G-CSFs进行一/二级预防是合理的;某些需采用剂量密集型化疗的儿童肿瘤(如尤文氏肉瘤),应当使用G-CSFs来保障化疗的实施[9]。
高龄是中外指南广泛收录的患者相关FN危险因素,NCCN指南(2024.V3)、ASCO指南(2015版)及ESMO发热性中性粒细胞减少管理临床实践指南(2016版)均认为“患者年龄>65岁”是FN的高危因素[10-12]。研究显示,应用长效G-CSF进行预防显著降低FN及感染相关死亡,并降低化疗剂量降低/延迟的发生率,在年龄≥75岁的患者中,长效G-CSF预防患者的4年OS和PFS率显著提高[13]。
3.2 同步放化疗用药
受GM-CSF影响,早期指南共识不推荐同步放化疗期间应用CSF类药物[14]。1995年之后,研究逐步证实G-CSF与GM-CSF对造血细胞的刺激效果并不相同,G-CSF主要特异性地作用于粒系造血祖细胞,GM-CSF则对于多种造血细胞系具有广泛的调节作用,因而临床应用时不良反应较多[15]。近年来,G-CSF用于同步放化疗的安全性逐渐得到研究证实,2017及2021年对CONVERT研究数据的分析进一步证实了G-CSF用于同步放化疗的安全性[16,17]。
2020年,NCCN指南取消了“同步放化疗期间不推荐预防性应用G-CSF”的表述,表明在精确放疗技术条件下,同步放化疗期间联合使用G-CSF类药物预防中性粒细胞减少症是安全的,有望为患者带来获益。
3.3 双周化疗&周化疗方案用药
基于保护骨髓的考虑两次G-CSF用药间隔一般建议≥2周,NCCN指南则建议长效G-CSF的使用至少需要距离下次化疗12天[2,10],因而双周化疗可以考虑使用长效G-CSF。根据长效G-CSF预防结肠癌双周剂量密集方案辅助化疗后中性粒细胞减少的临床观察研究,应用长效G-CSF可有效预防结肠癌剂量密集化疗后3-4级中性粒细胞减少的发生,且无明显不良反应[18]。然而,目前尚无足够数据支持周化疗方案后使用长效G-CSF。
专家点评:
使用G-CSF进行一级预防可降低化疗患者的中性粒细胞减少和FN发生率、持续时间及严重程度,有助于保证患者完成足剂量、足疗程化疗,NCCN指南建议对接受FN高风险化疗方案和接受FN中风险化疗方案合并≥1个危险因素的患者进行一级预防。然而在临床实践中,还存在着对接受FN中风险化疗方案患者预防不足、使用G-CSF预防的剂量及疗程不规范等情况,仍需要进一步提升预防观念,进行更加规范化的一级预防,尤其是对于儿童和高龄患者等特殊人群,规范化的一级预防可能带来更大的临床获益。
参考文献
[1] CACA肿瘤化疗导致的中性粒细胞减少诊治中国专家共识(2023版).
[2] NCCN造血生长因子指南(2024.V3).
[3] Truong J, et al. Interpreting febrile neutropenia rates from randomized, controlled trials for consideration of primary prophylaxis in the real world: a systematic review and meta-analysis[J]. Annals of Oncology,2016;27(4):608-618.
[4] Li S, et al. Trends in the use of primary prophylactic colony-stimulating factors and neutropenia-related hospitalization in elderly cancer patients receiving myelosuppressive chemotherapy in the USA: 1995-2015[J]. Support Care Cancer, 2019;28(6):2637-2649.
[5] Campbell K, et al. G-CSF primary prophylaxis use and outcomes in patients receiving chemotherapy at intermediate risk for febrile neutropenia: a scoping review[J]. Expert Rev Hematol.2022;15(7):619-633.
[6] Weycker D, et al. Risk of chemotherapy-induced febrile neutropenia with early discontinuation of pegfilgrastim prophylaxis in US clinical practice[J]. Support Care Cancer. 2015;24(6):2481-2490.
[7] Yokoyama M, et al. Factors for the optimal selection of granulocyte colony-stimulating factor preparations and predictors for R-CHOP dose reductions/delays among patients with non-Hodgkin B-cell lymphoma (STOP FN in NHL 2 subanalysis)[J]. BMC Cancer (2021);21:358.
[8] Heeyeon K, et al. Colony stimulating factors for prophylaxis of chemotherapy-induced neutropenia in children[J]. Expert Rev Clin Pharmacol. 2022;15(8):977-986.
[9] ASCO白细胞生长因子临床应用指南(2015版)
[10] CSCO肿瘤放化疗相关中性粒细胞减少症规范化管理指南(2021版)
[11] ESMO发热性中性粒细胞减少管理临床实践指南(2016版)
[12] Pinkie C, et al. Patient factors and their impact on neutropenic events: a systematic review and meta-analysis[J].Support Care Cancer. 2019;27(7):2413-2424.
[13] Seong Hyun Jeong, et al. Pegfilgrastim Prophylaxis Is Effective in the Prevention of Febrile Neutropenia and Reduces Mortality in Patients Aged ≥ 75 Years with Diffuse Large B-Cell Lymphoma Treated with R-CHOP: A Prospective Cohort Study[J]. Cancer Res Treat.2022;54(4):1268-1277.
[14] P A Bunn Jr, et al. Chemoradiotherapy with or without granulocyte-macrophage colony-stimulating factor in the treatment of limited-stage small-cell lung cancer: a prospective phase III randomized study of the Southwest Oncology Group[J]. J Clin Oncol. 1995;13(7):1632-1641.
[15] Becher B, et al. GM-CSF: From Growth Factor to Central Mediator of Tissue Inflammation[J]. Immunity.2016;45(5):963-973.
[16] Gomes F, et al. Use of G-CSF and prophylactic antibiotics with concurrent chemoradiotherapy in limited-stage small cell lung cancer: results from the phase Ⅲ CONVERT trial[J]. Annals of Oncology,2017;28(2):61-62.
[17] Gomes F, et al. Safety of G-CSF with concurrent chemo-radiotherapy in limited-stage small cell lung cancer - Secondary analysis of the randomised phase 3 CONVERT trial[J]. Lung Cancer,2021;153:165-170.
[18] Zhang ZD, et al. Clinical effect of PEG-rhG-GSF in preventing neutropenia after biweekly dose-dense adjuvant chemotherapy in colon cancer[J]. Modern Oncology. 2019;27(03): 0440-0443.