中国抗癌协会
立即下载App“智能AI互动讲堂-抗血管生成药物在肺癌中的突破之旅” 医学专栏活动总结
“智能AI互动讲堂-抗血管生成药物在肺癌中的突破之旅”医学专栏活动总结
2024年5月至12月,由中国抗癌协会指导、中国抗癌协会康复分会主办的“重塑生机,维来可期-肿瘤微环境重编程之大咖系列访谈”,将由来自肺癌、肉瘤、消化道肿瘤、肝胆胰肿瘤、妇科肿瘤的知名专家,梳理抗血管生成药物调控肿瘤微环境重编程从机制到临床应用的现状和展望,为未来抗肿瘤治疗的发展提供新思路。
肿瘤的发生发展并不只是肿瘤细胞的单一行为,肿瘤细胞和其所在环境的免疫细胞、间质细胞、细胞外基质、细胞因子、血管和淋巴管网络等一起作为整体构成肿瘤微环境,共同参与肿瘤进展以及抗肿瘤治疗过程。
抗血管生成类药物最基础的药物机制为阻断肿瘤血管生成,通过调控血管基质重编程来抑制肿瘤血管新生,促进血管正常化,增加药物在肿瘤组织分布。抗血管生成类药物还可调控肿瘤细胞重编程和肿瘤免疫微环境重编程,不仅可以抑制肿瘤细胞增殖/迁移、促进凋亡、改变肿瘤细胞代谢,还可以增强免疫细胞浸润,使肿瘤微环境从免疫抑制型转变为免疫促进型,调节细胞因子释放。因此在肺癌领域,抗血管生成类药物不仅单药有效,更能够与化疗、免疫治疗、放疗等协同增效。
本期“智能AI互动讲堂-抗血管生成药物在肺癌中的突破之旅”医学专栏创新性地采用了先由AI回答,再由专家评价及补充的议题讨论方式,邀请了北京大学国际医院 汤传昊教授、广东省人民医院 涂海燕教授、浙江大学医学院附属第二医院 夏旸教授、江苏省肿瘤医院 朱向帜教授、四川省肿瘤医院 李娟教授,结合我们的AI智能机器人小安,分别围绕“抗血管生成药物调控肿瘤微环境重编程与联合治疗机制”“抗血管生药物如何调控免疫微环境克服免疫耐药”“肺癌中肝转移灶的肿瘤微环境特点及治疗”“抗血管生成药物联合放疗的机制及应用”“未来肺癌领域新药研发与探索的展望”议题进行讨论。
议题1:抗血管生成药物已成为肺癌领域不可或缺的治疗方式之一。结合临床,请谈谈您对此类药物调控肿瘤微环境重编程的理解以及与其他治疗的联合应用机制?

对于抗血管生成药物调控肿瘤微环境重编程的机制,AI给出了相对全面的回答,包括抑制肿瘤血管生成、改变肿瘤微环境、增强免疫细胞浸润、减少药物耐药性等,而与其他药物的联合应用方面,AI也指出改善肿瘤微环境是抗血管生成药物与化疗、免疫治疗等联合增敏的基础机制。

汤传昊教授在AI回答的基础上,进一步强调了肿瘤微环境组成的整体性,这种微环境具备缺氧、酸性、代谢异常、免疫抑制等特征,肿瘤微环境重编程则是通过干预性方式调节肿瘤微环境中细胞构成和细胞间联系,为优化肿瘤治疗策略、提高肿瘤治疗疗效提供可能性。不同的抗血管生成药物调控肿瘤微环境重编程的机制各不相同,通常可以通过对肿瘤血管、肿瘤细胞及肿瘤免疫微环境等几个方面的影响达到调控肿瘤微环境重编程以及联合增效的目的,在选择联合治疗的策略时需根据患者的具体情况和肿瘤的生物学特征进行个体化调整,其中抗血管生成类药物联合免疫治疗和化疗的“四药联合”模式已通过III期临床试验在广泛期小细胞肺癌的一线治疗中证实了其疗效和安全性。
议题2:肿瘤微环境与免疫治疗耐药密切相关,抗血管生成药物是否可以通过调控免疫微环境克服免疫耐药?
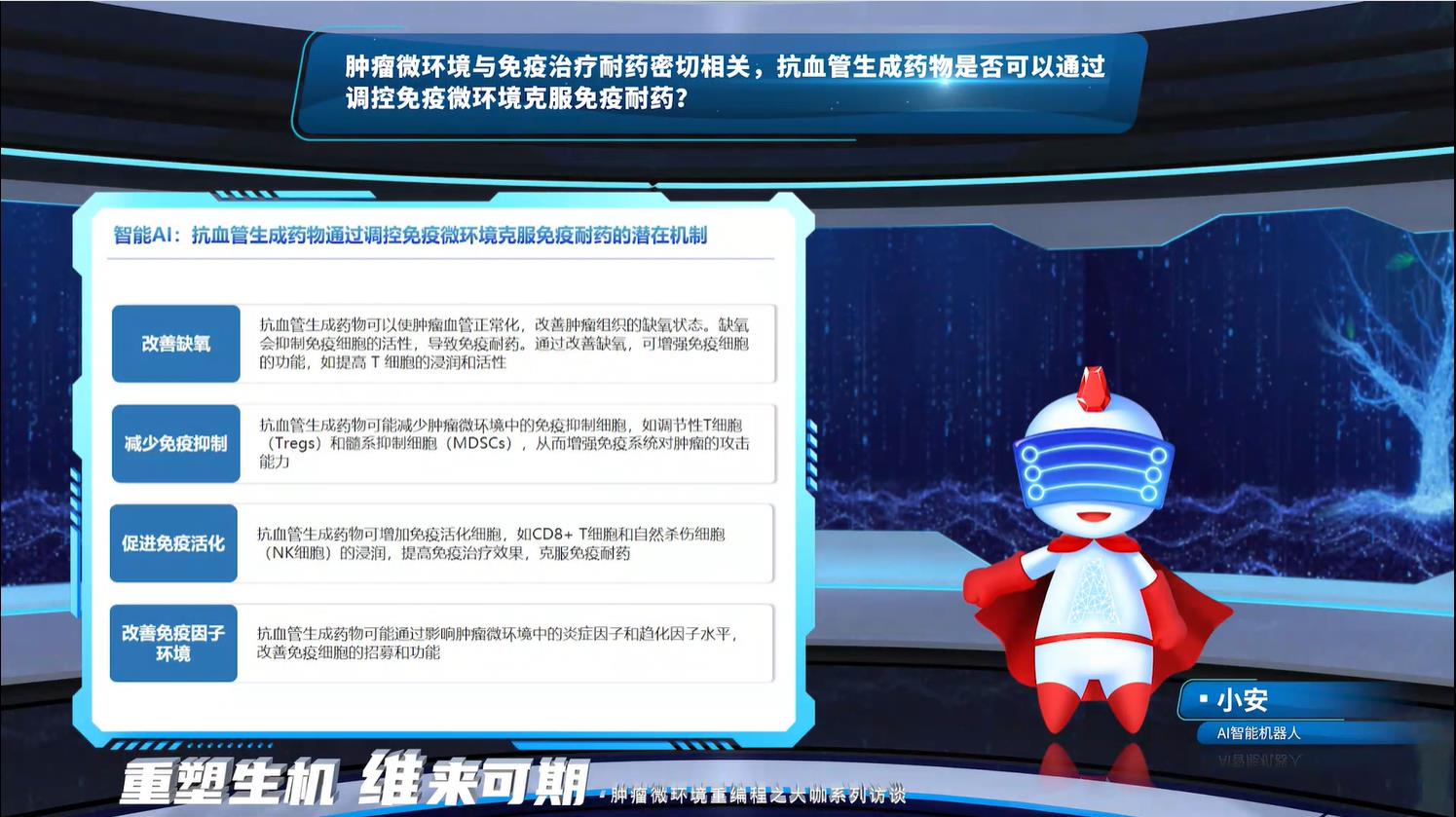
AI提出抗血管生成药物通过调控免疫微环境来克服免疫耐药的潜在机制包括改善缺氧、减少免疫抑制、促进免疫活化和改善免疫因子环境。
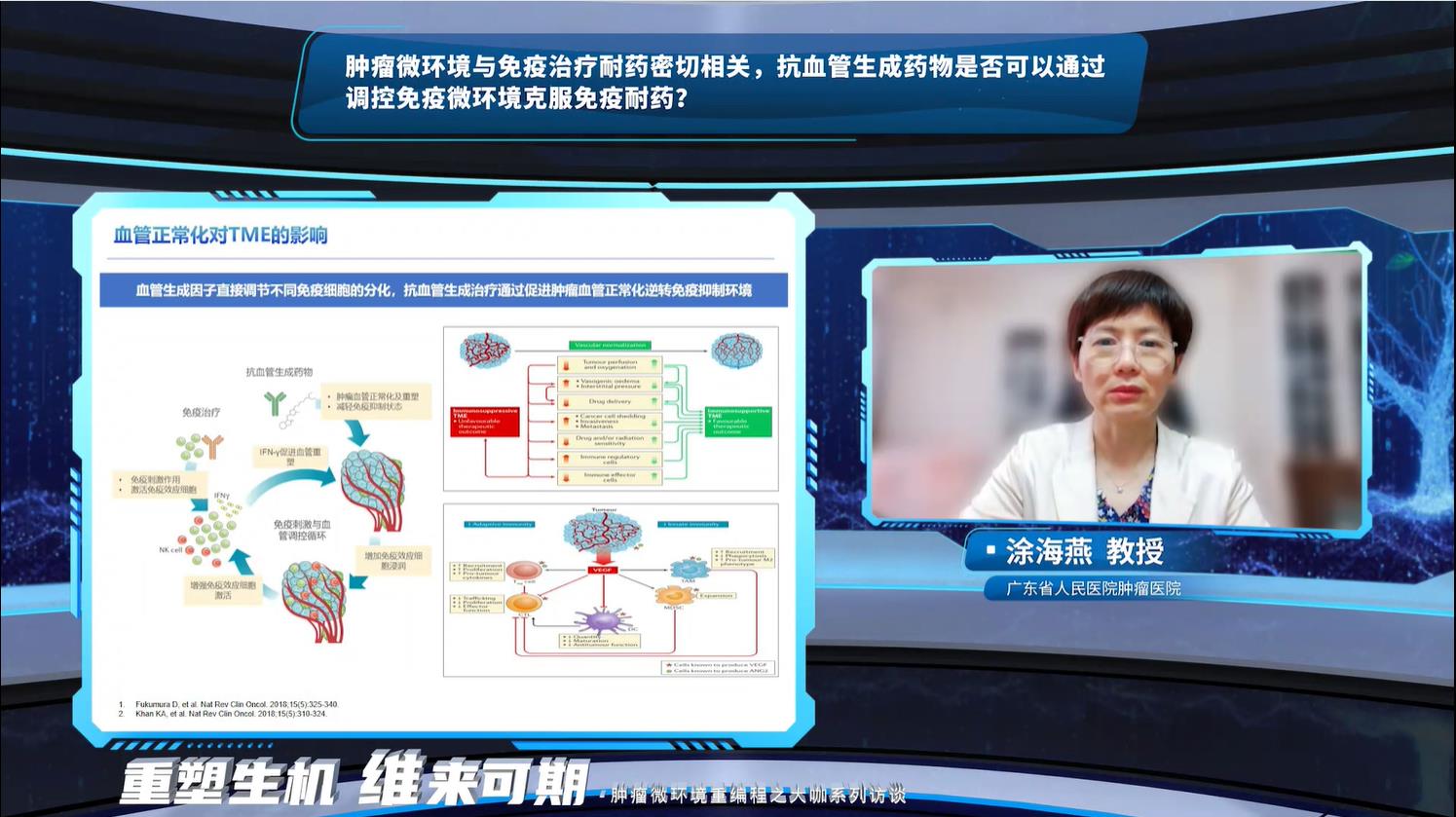
涂海燕教授对这些理论基础持认可态度但同时指出免疫耐药原因复杂,肿瘤细胞表面抗原减少或丢失、抗原呈递减少、异常信号通路共同组成了免疫抑制肿瘤微环境,血管内皮生长因子(VEGF)在其中发挥了重要作用。抗血管生成药物联合免疫治疗可以通过阻断VEGF和PD-(L)1产生协同作用,更好的实现血管正常化,从而纠正这种免疫抑制肿瘤微环境。但这些理论基础并未转化为实际临床获益,多项探索免疫+抗血管在NSCLC免疫耐药后应用的临床试验均宣告失败,提示该治疗模式仍有待改善,潜在策略包括根据不同癌症类型的独特免疫抑制肿瘤微环境情况选择合适的组合、利用免疫刺激血管调节循环、在短暂血管正常化窗口期间改善缓解深度等。
议题3:肺癌中肝转移灶常见,这些病灶的肿瘤微环境有哪些特点,是否适合抗血管生成药物治疗?

AI总结肺癌肝转移灶的肿瘤微环境具有如下特点:1. 免疫抑制细胞增多、效应 T 细胞功能受损;2. 异常血管生成、血管高渗透性;3. 代谢重编程、营养物质缺乏。同时指出基于这些特点,抗血管生成药物有望通过肿瘤血管正常化、调节免疫细胞组成和功能和直接抑制肿瘤血管生成在肺癌肝转移灶中发挥作用。

夏旸教授认为AI技术已有长足的进步,但在这一问题上仍需结合临床实践去更深入的思考和解答,并对肝转移病灶微环境特点进行了补充:1. 血供丰富伴随血管新生,促进肿瘤发展和转移;2. 胶原沉积,ECM增加,导致ECM硬化,增加实体压力,阻碍药物输送;3. 多种细胞间相互作用形成免疫抑制微环境,导致免疫治疗效果不佳。针对上述肝转移病灶微环境特点,抗血管生成TKI类药物通过调控肿瘤微环境重编程在肝转移灶中起效,其中安罗替尼在非小细胞肺癌和小细胞肺癌注册研究中均已证实了对肝转移人群的疗效,抗血管生成类药物联合免疫治疗和化疗的“四药联合”模式在肺癌肝转移中也进行了探索,前景可期。
议题4:抗血管生成药物和放疗均具有调节肿瘤微环境的作用,何种情况下可以考虑靶放联合治疗肺癌?

AI回复,抗血管生成药物联合放疗在以下情况可考虑使用:1. 较大或侵犯重要结构/潜在可切除的局部晚期肺癌患者;2. 身体状况较好的肺癌寡转移患者;3. 复发/难治性肺癌。
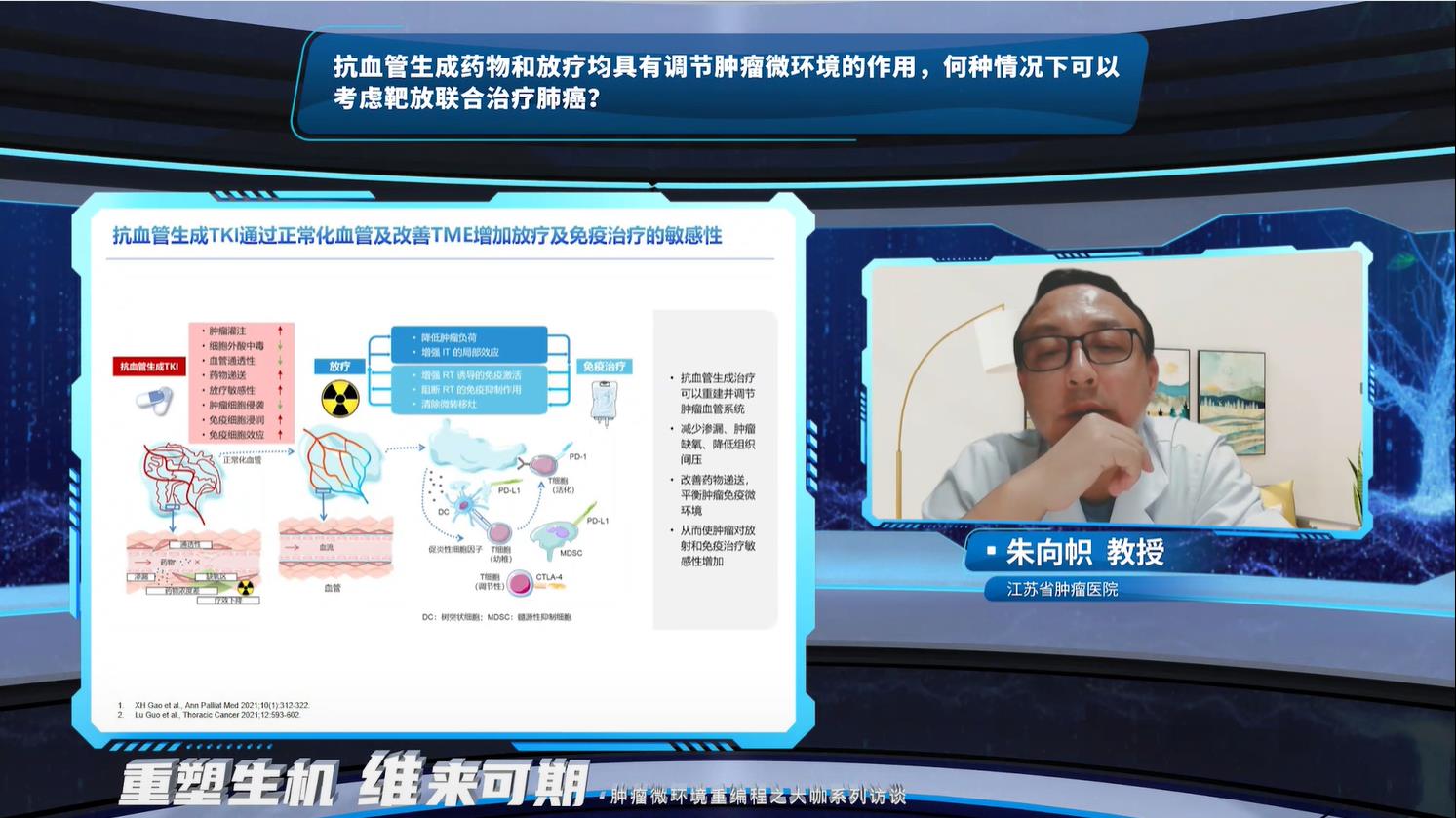
朱向帜教授对于AI的回复基本赞同,但在复发/难治性肺癌进行放疗时需谨慎,要基于复发部位去决定。朱向帜教授指出放疗所致的血管反弹和血管生长诱导作用为放疗联合抗血管治疗创造了条件,同时放疗对肿瘤微环境中免疫抑制机制的针对性作用也为放疗联合免疫治疗创造了条件,但肿瘤微环境缺氧的特点可能导致“放疗抵抗”,抗血管生成TKI则可以有效逆转这种缺氧状态。抗血管联合放疗治疗局晚期非小细胞肺癌的疗效和安全性也已经在一些小样本量研究中得到证实。对于局晚期非小细胞肺癌的同步/序贯放化疗后的巩固治疗, PACIFIC研究已经改变了临床实践,提示PD-L1抑制剂能够给这些患者带来获益,但开拓新的同步/序贯放化疗后的巩固治疗仍有必要性,期待抗血管联合免疫研究结果的出炉,为局晚期非小细胞肺癌患者带来更多的治疗选择。
议题5:结合肿瘤微环境调控及新型靶点的探索,您认为未来哪一类药物在肺癌领域更具潜力?

针对这个问题,AI认为ADC类药物、CAR-T/TIL等新型免疫治疗药物和针对PI3K/Akt/mTOR 通路、Wnt/β-catenin 通路的新型靶向药物在肺癌中更具潜力。
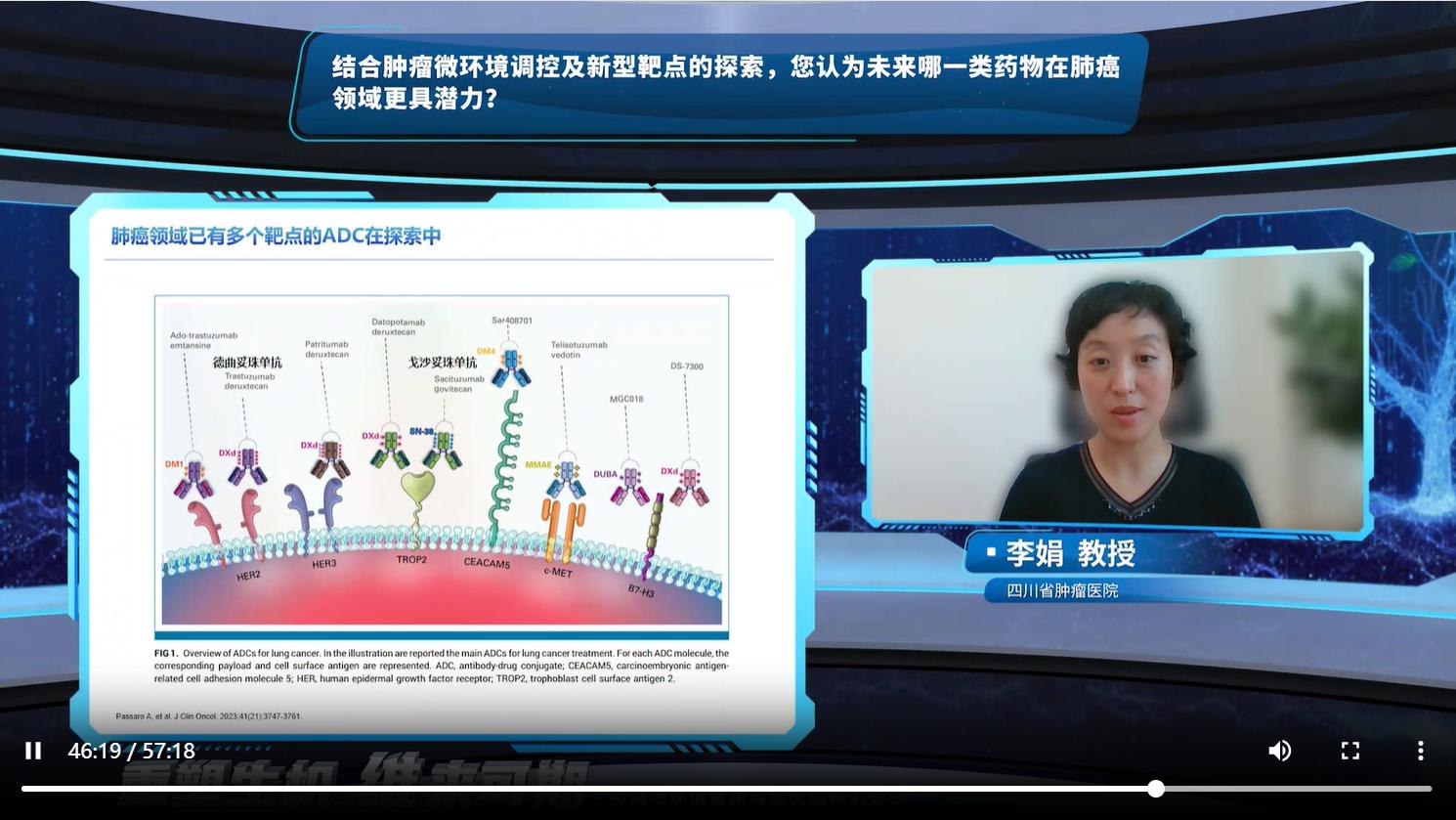
李娟教授对AI的回复给予了肯定,并对其中研究最深入的ADC类药物进行了详细的补充介绍。目前在肿瘤学和免疫学基础研究的推动下,ADC靶抗原的选择已逐渐从传统的肿瘤细胞抗原(过表达和驱动基因)扩展到肿瘤微环境中的靶标(如血管和基质),但在肺癌领域,相对比较成熟的ADC依旧是靶向过表达和驱动基因。TROP2 ADC的Dato-Dxd和戈沙妥珠单抗、HER2 ADC中的德曲妥珠单抗、HER3 ADC中的Patritumab Deruxtecan(HER3-DXd)、B7-H3(CD276)ADC中的Ifinatamab deruxtecan(I-DXd,DS-7300)都陆续公布了研究结果,显示出初步抗肿瘤活性,但安全性问题仍需持续关注。值得一提的是,HER2靶点上除了ADC,Zongertinib等TKI类药物也未来可期。也期待未来能有更多研究去探索ADC与抗血管生成治疗、化疗、免疫治疗等药物的联合治疗,为患者带来更多治疗选择。
综上,本次医学专栏中肺癌领域的五位知名专家和智能AI一起结合抗血管生成药物在肿瘤微环境重编程中的机制,探讨了其在肺癌领域的前沿应用和未来展望。肿瘤微环境是抗肿瘤治疗和新药研发的潜在靶点,抗血管生成药物通过肿瘤微环境重编程机制,与免疫治疗、放疗等联合增效,有望在免疫耐药后、肝转移、局部晚期肺癌等多个治疗场景中发挥作用。期待未来在肺癌领域能够有更多突破性的治疗进展,为患者提供更多治疗选择,不断提升临床获益。