中国抗癌协会
立即下载App“智能AI互动讲堂—抗血管生成药物引领肉瘤治疗及展望”医学专栏活动总结
2024年5月至12月,由中国抗癌协会指导、中国抗癌协会康复分会主办的“重塑生机,维来可期-肿瘤微环境重编程之大咖系列访谈”,将由来自肺癌、肉瘤、消化道肿瘤、肝胆胰肿瘤、妇科肿瘤的知名专家,梳理抗血管生成药物调控肿瘤微环境重编程从机制到临床应用的现状和展望,为未来抗肿瘤治疗的发展提供新思路。
肿瘤微环境的构成包括了肿瘤细胞本身,还有相关的免疫细胞、间质细胞、细胞外基质、细胞因子、血管和淋巴管网络等。这些成分并非独立,而是有机地结合在一起为肿瘤不断生长、侵袭以及抵抗机体或是药物杀伤提供条件。
抗血管生成酪氨酸激酶抑制剂(TKI)类药物,其最基础的药物机制为阻断肿瘤血管生成,通过调控血管基质重编程来抑制肿瘤血管新生,同时还可以使得肿瘤快速生长时杂乱无章的血管变得正常化。另一方面还具备改善肿瘤细胞重编程的机制,即调控肿瘤细胞代谢、抑制肿瘤细胞增殖、迁移、促进肿瘤细胞凋亡、改善肿瘤免疫微环境等作用。因此在肉瘤领域,其不仅可以达到单药控制肿瘤进展的效果,也可以与化疗、免疫治疗等协同增效。
议题1:抗血管生成TKI类药物已成为肉瘤领域不可或缺的治疗方式之一。结合临床,请谈谈您对此类药物调控肿瘤微环境重编程的理解以及与其他治疗的联合应用机制?
首先,对于抗血管生成TKI类药物调控肿瘤微环境重编程的基础机制,AI给出了相对全面的回答,包括血管生成抑制、免疫微环境调节、代谢重编程等,而与其他药物的联合应用方面,AI也明确指出其与化疗、免疫治疗或是其他靶向治疗的联合增敏机制。
刘巍峰教授在AI回答的基础上,进一步强调了肿瘤微环境构成成分的整体性,这种微环境具备缺氧、酸性、代谢异常、免疫抑制等特征,而抗血管生成TKI类药物,其不仅具备肿瘤血管重编程效应,还可以进行肿瘤代谢重编程,即改善肿瘤微环境中的缺氧以及酸性状态,增加肿瘤对放疗的敏感性;另一方面可以通过改善间质液压促进药物递送与分布,为其与化疗、免疫等其他治疗的联合提供条件,但需要注意不同TKI类药物的作用存在一定差异。而实际临床使用中,抗血管生成类药物不管是单药还是联合其他治疗在肉瘤各个治疗阶段均展现了不错的疗效及安全性数据。
 议题2:抗血管生成TKI类药物与化疗联合有协同增效的作用,在肉瘤治疗的过程中如何选择联合的时机?
议题2:抗血管生成TKI类药物与化疗联合有协同增效的作用,在肉瘤治疗的过程中如何选择联合的时机?
AI主要从不同的治疗阶段、个体化治疗以及安全性管理的角度出发回答了这个问题。它提到抗血管生成TKI类药物与化疗的联合治疗时机应综合考虑患者个体因素以及具体治疗阶段,并在专业医疗团队的指导下进行。医生也需要根据最新的临床研究成果和治疗指南来制定最佳的治疗计划。
张星教授指出,首先,抗血管生成TKI类药物其本身具备促进血管正常化、降低细胞外基质硬度、调节间质液压等特性,这些特点可以促进化疗药物的渗透,为其与化疗药物的联合提供协同增效的机制基础。另一方面,抗血管生成类药物联合化疗用于软组织肉瘤的数据从后线到一线均有不错展现,而其用于围术期的探索还需要前瞻性、多中心以及更多样本的验证。整体来说,抗血管靶向药物联合化疗可以达到1+1>2的效果,但具体应用在肉瘤的不同治疗阶段时,需要综合具体亚型、应用目的、安全性以及患者接受程度等因素。

议题3:抗血管生成TKI类药物具有调节肿瘤免疫微环境的作用,何种情况适合采用靶免联合的方式治疗肉瘤?
AI总结,抗血管生成TKI类药物与免疫检查点抑制剂(ICIs)的联合治疗在软组织肉瘤中展现出潜在的协同效应,这种治疗策略适用于以下情况:①对于免疫治疗敏感的肉瘤亚型;②对单纯免疫治疗反应不佳的患者;③寻求替代化疗方案的患者;④前线耐药后的联合应用,可以提高生存率和疾病控制率。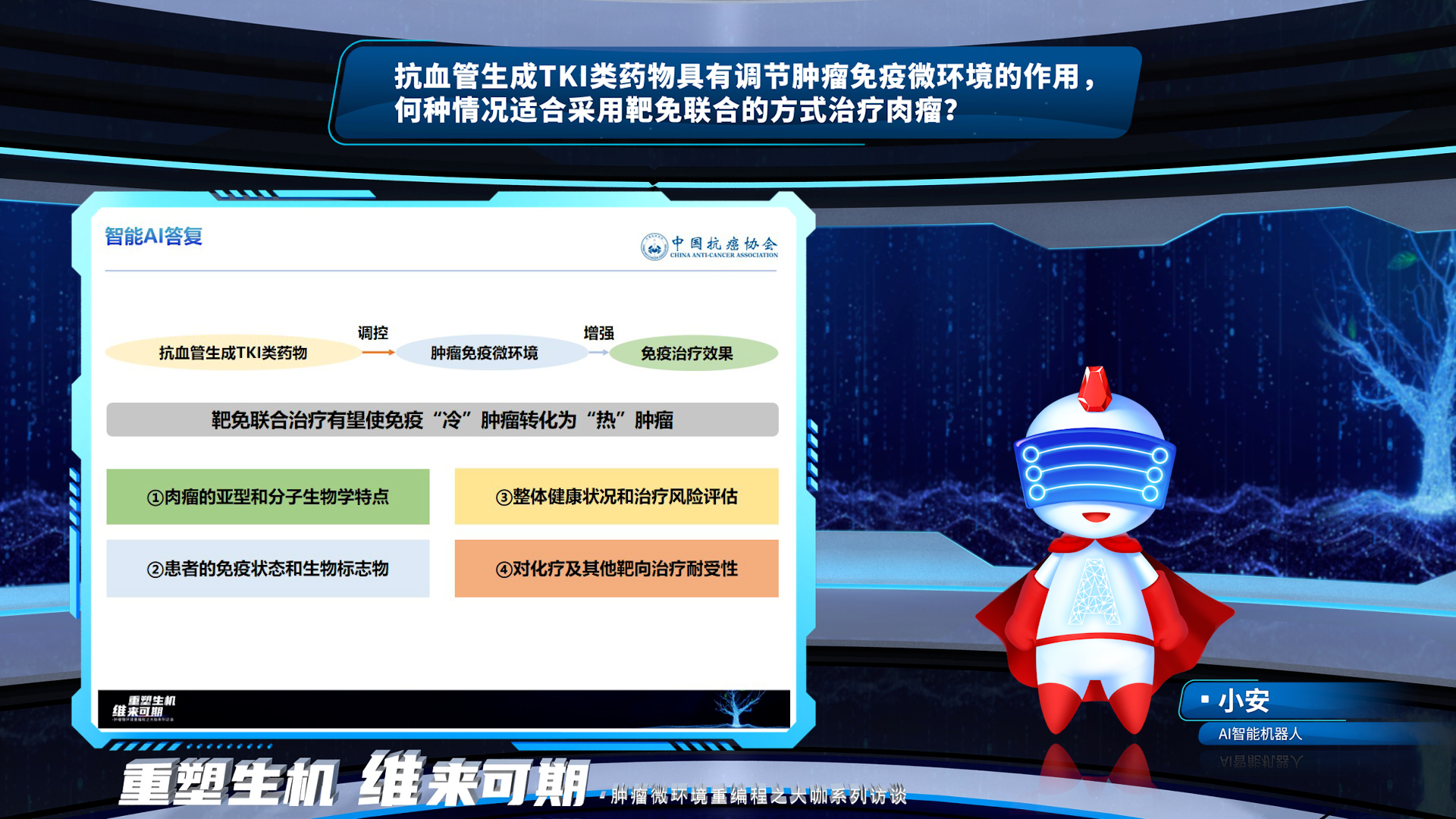 张星教授强调,软组织肉瘤或是骨肉瘤都被认为是免疫“冷”肿瘤,既往包括帕博利珠单抗在内的免疫抑制剂单药疗效不佳。抗血管生成TKI类药物可以通过①增加免疫细胞浸润,②提升肿瘤特异性免疫反应的方式达到改变肿瘤免疫微环境的作用。但目前整体来看,抗血管生成药物联合免疫抑制剂的研究主要集中在软组织肉瘤的二线以及后线,更多的是作为前线化疗或者抗血管生成药物治疗进展后的联合方案,但今年ASCO的一项围术期放疗联合帕博利珠单抗的研究也为临床提供了新的思路和循证依据。此外,一项安罗替尼联合贝莫苏拜单抗用于腺泡状软组织肉瘤(ASPS)扩展队列的研究也提示我们,在临床使用联合方案的过程中还需要挑选合适的亚型,比如未分化多形性肉瘤(UPS)、ASPS这类对于免疫治疗更敏感的亚型,或许可以使患者的临床获益更加明显。
张星教授强调,软组织肉瘤或是骨肉瘤都被认为是免疫“冷”肿瘤,既往包括帕博利珠单抗在内的免疫抑制剂单药疗效不佳。抗血管生成TKI类药物可以通过①增加免疫细胞浸润,②提升肿瘤特异性免疫反应的方式达到改变肿瘤免疫微环境的作用。但目前整体来看,抗血管生成药物联合免疫抑制剂的研究主要集中在软组织肉瘤的二线以及后线,更多的是作为前线化疗或者抗血管生成药物治疗进展后的联合方案,但今年ASCO的一项围术期放疗联合帕博利珠单抗的研究也为临床提供了新的思路和循证依据。此外,一项安罗替尼联合贝莫苏拜单抗用于腺泡状软组织肉瘤(ASPS)扩展队列的研究也提示我们,在临床使用联合方案的过程中还需要挑选合适的亚型,比如未分化多形性肉瘤(UPS)、ASPS这类对于免疫治疗更敏感的亚型,或许可以使患者的临床获益更加明显。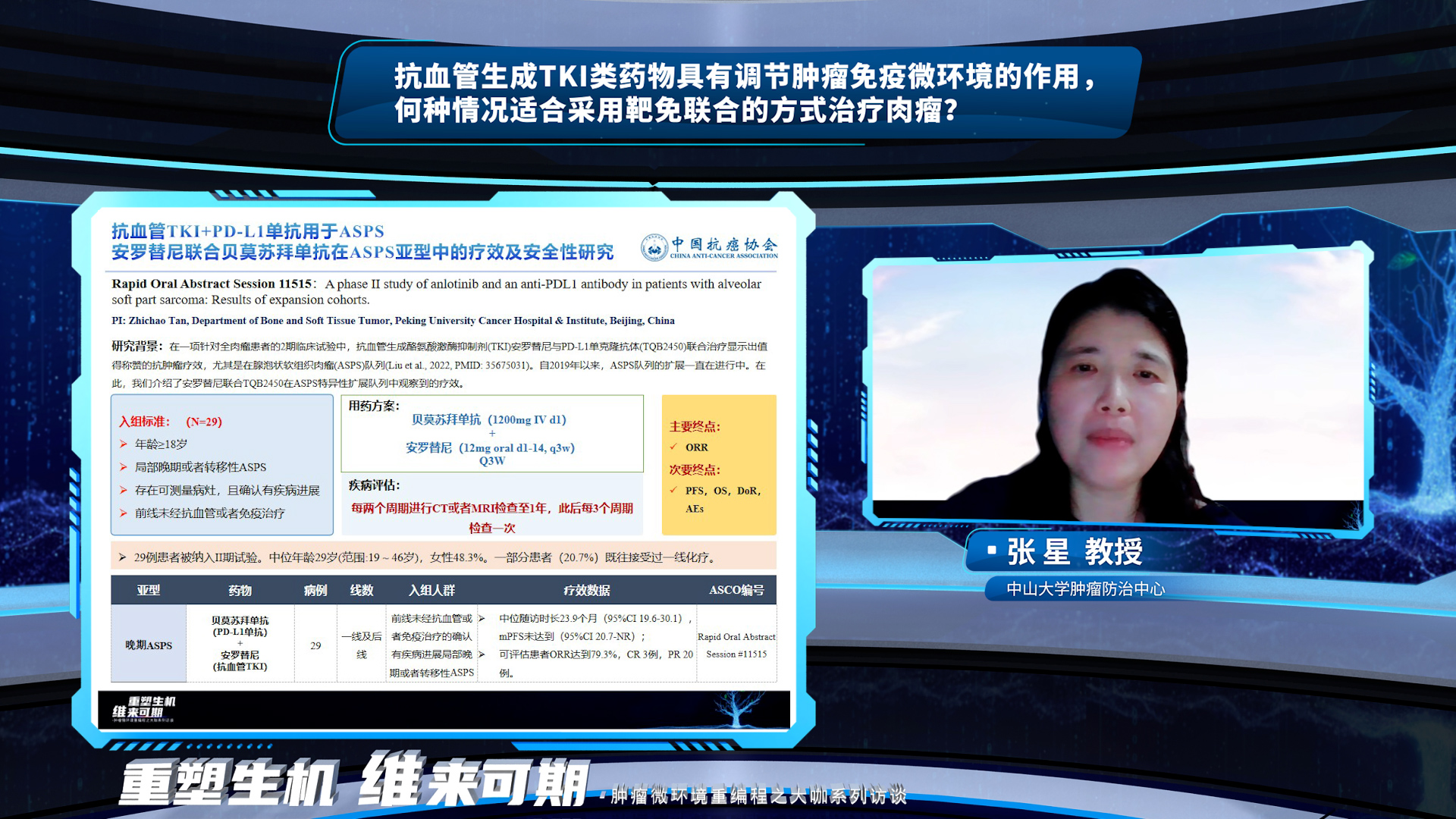
议题4:随着肉瘤治疗逐渐迈向精准化,您觉得抗血管TKI类药物在此过程中如何发挥自己最大的作用?
AI回复,抗血管生成TKI类药物在肉瘤精准化治疗中发挥着重要作用,通过针对性的治疗策略和联合治疗手段、提高治疗效果、克服耐药性、改善患者预后。随着对肉瘤生物学特性和治疗反应机制的深入了解,这些药物的应用将更加广泛和个性化。

最后华教授还强调一点,即抗血管生成类药物耐药性的产生与肿瘤代谢改变、缺氧诱导因子(HIF-1α)通路上调、酸性微环境形成等密切相关,其会导致后续的免疫抑制、肿瘤复发和转移。针对这些机制,抗血管生成类药物的使用需要考虑应用周期、多靶点联合以及未来的探索方向来克服耐药,使患者获益延长。
议题5:结合肿瘤微环境调控及新型靶点的探索,您认为未来哪一类药物在肉瘤领域更具潜力?
 李茹恬教授对AI的回复给予了肯定,评价其站在了相对前沿的角度去思考肉瘤领域未来可供探索的方向。而针对这4个方向,李教授也做出了更为详细的补充。首先双特异性抗体方面,目前已有的较为常见的是抗CTLA-4和抗PD-1的双特异性抗体,而实际上基于PD-1抑制剂,还有很多其他种类的双抗也可能给肉瘤提供选择,比如PD-1联合VEGF双抗、PD-1联合LAG3双抗、PD-1联合CD73双抗等。
李茹恬教授对AI的回复给予了肯定,评价其站在了相对前沿的角度去思考肉瘤领域未来可供探索的方向。而针对这4个方向,李教授也做出了更为详细的补充。首先双特异性抗体方面,目前已有的较为常见的是抗CTLA-4和抗PD-1的双特异性抗体,而实际上基于PD-1抑制剂,还有很多其他种类的双抗也可能给肉瘤提供选择,比如PD-1联合VEGF双抗、PD-1联合LAG3双抗、PD-1联合CD73双抗等。
 ADCs类药物此前在白血病、乳腺癌及尿路上皮癌等领域的疗效已被证实,今年来自北大人民医院谢璐教授的一项ASCO的口头汇报也展现了靶向骨肉瘤细胞膜B7 -H3的ADC药物的疗效数据,未来期待更多此类药物在肉瘤领域的研究。其他潜在的新药靶点则包括MDM2抑制剂、ALK抑制剂、CD47阻断剂等,而新型的治疗方式则包括TCR-T细胞疗法、肿瘤疫苗等等。这些都已在肉瘤领域获得了一定的疗效数据,有待进一步开发和应用。最后李教授也提醒各位专家,由于软组织肉瘤的生物学行为特殊,且存在高度异质性,因此在选择新型治疗方案时需要考虑其病理分型与对应的分子生物学特征。
ADCs类药物此前在白血病、乳腺癌及尿路上皮癌等领域的疗效已被证实,今年来自北大人民医院谢璐教授的一项ASCO的口头汇报也展现了靶向骨肉瘤细胞膜B7 -H3的ADC药物的疗效数据,未来期待更多此类药物在肉瘤领域的研究。其他潜在的新药靶点则包括MDM2抑制剂、ALK抑制剂、CD47阻断剂等,而新型的治疗方式则包括TCR-T细胞疗法、肿瘤疫苗等等。这些都已在肉瘤领域获得了一定的疗效数据,有待进一步开发和应用。最后李教授也提醒各位专家,由于软组织肉瘤的生物学行为特殊,且存在高度异质性,因此在选择新型治疗方案时需要考虑其病理分型与对应的分子生物学特征。