中国抗癌协会
立即下载App“生机安然冲云消——抗血管生成药物助力优化消化系统肿瘤治疗策略”访谈总结
2024年5月至12月,由中国抗癌协会指导、中国抗癌协会康复分会主办的“重塑生机,维来可期-肿瘤微环境重编程之大咖系列访谈”,将由来自肺癌、消化道肿瘤、肝胆胰肿瘤、妇科肿瘤的知名专家,梳理抗血管生成药物调控肿瘤微环境重编程从机制到临床应用的现状和展望,为未来抗肿瘤治疗的发展提供新思路。 
肿瘤微环境中每种细胞类型和非细胞成分都以独特的方式调节肿瘤的免疫逃逸及介导肿瘤对常规治疗的原发耐药或获得性/适应性耐药。因此,全面调控肿瘤微环境重编程的治疗方案,为优化肿瘤治疗策略、提高肿瘤治疗疗效提供可能性。
本期“生机安然冲云消——抗血管生成药物助力优化消化系统肿瘤治疗策略”访谈由山东第一医科大学第一附属医院 王俊教授、山东省肿瘤医院 刘波教授、中国医学科学院肿瘤医院 孙永琨教授、天津市人民医院 王凤玮教授、和天津医科大学总医院 马晴教授分别围绕“抗血管生成药物联合化疗/免疫治疗助力优化消化系统肿瘤治疗策略”和“抗血管生成药物联合局部治疗助力优化消化系统肿瘤治疗策略”两个主题进行讨论。
主题1:抗血管生成药物联合化疗/免疫治疗助力优化消化系统肿瘤治疗策略
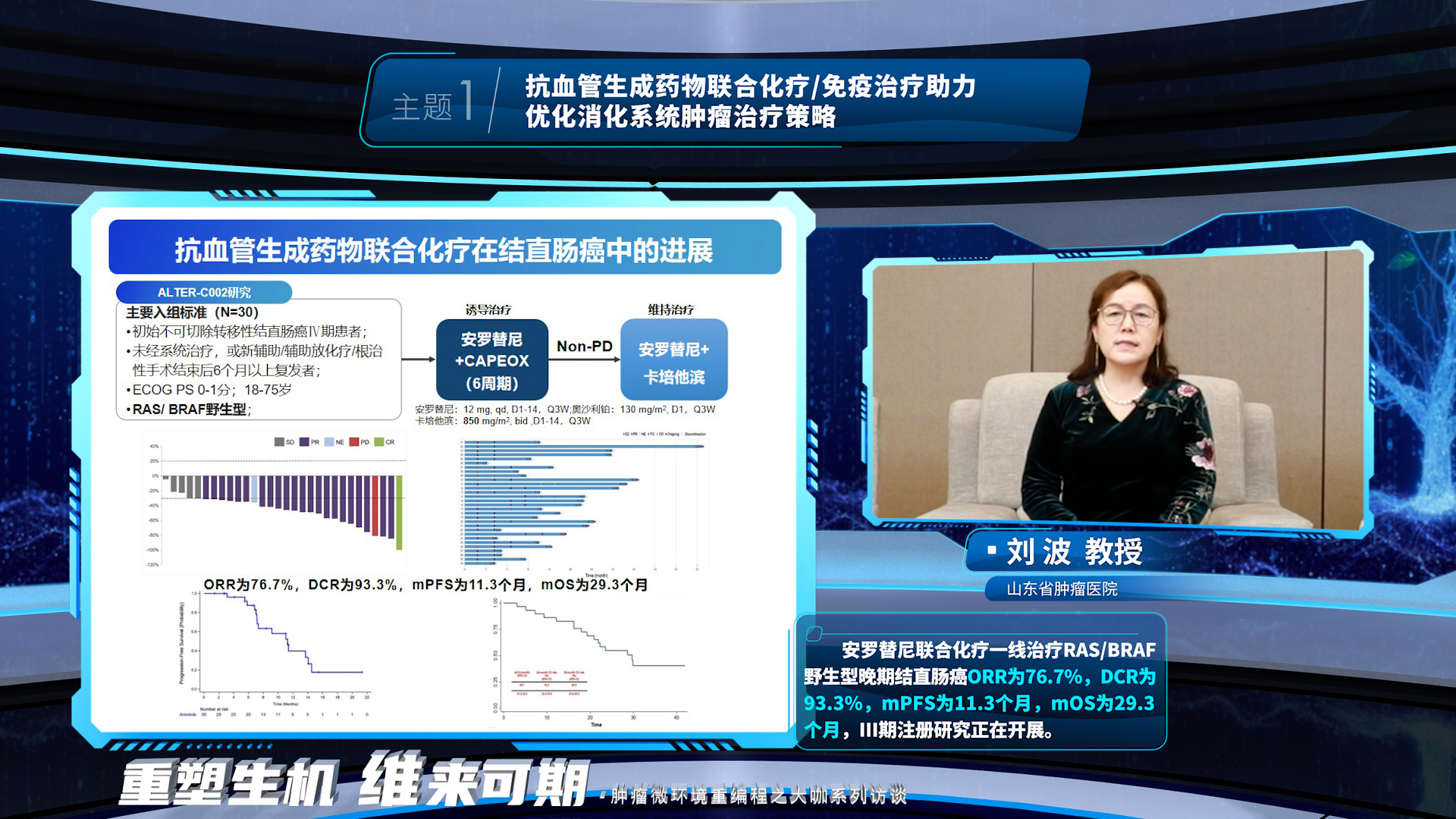
首先,刘波教授详细讲解了抗血管生成药物调控肿瘤微环境重编程的机制,包括:抗血管生成药物能够促进肿瘤血管基质重编程,使血管正常化,增加药物在肿瘤组织中的分布,改善细胞外基质硬化、具有不依赖血管的增加药物递送的作用。抗血管生成药物联合化疗为晚期结直肠癌一线治疗&复发难治型结直肠癌后线治疗带来临床获益。
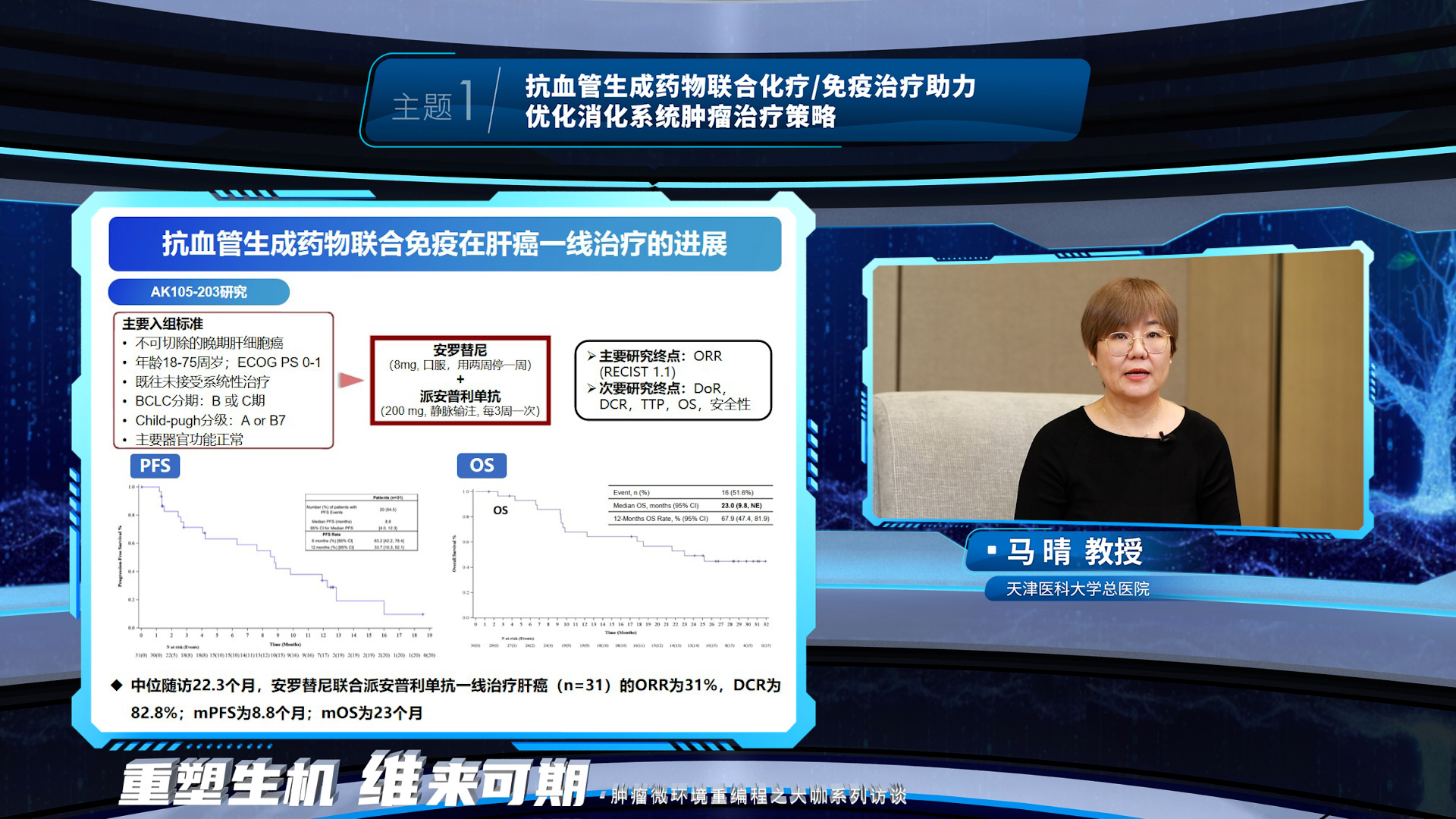
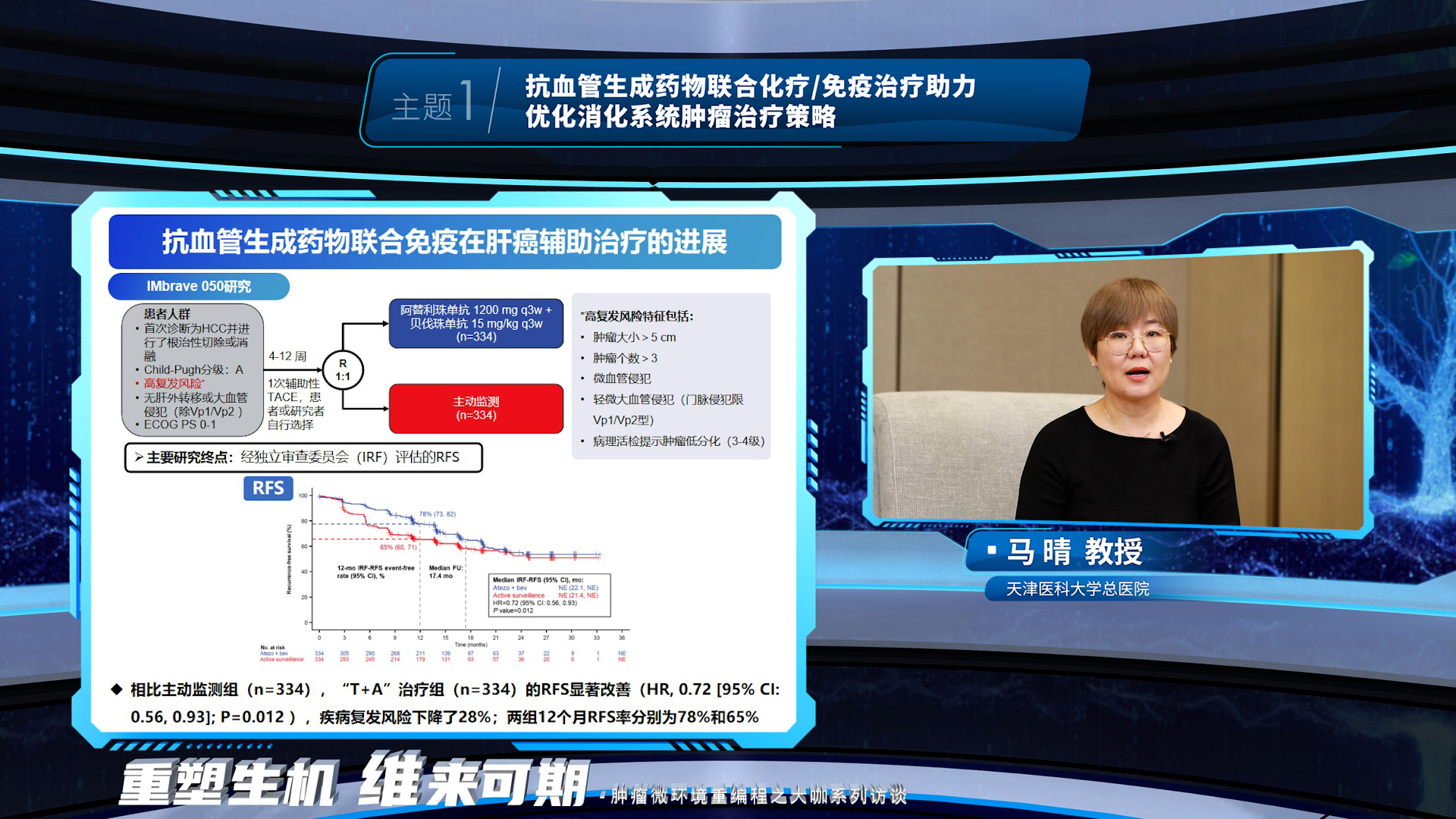
马晴教授阐述了抗血管生成药物可以调控肝胆肿瘤免疫微环境重编程,并介绍了抗血管生成药物联合免疫在肝癌一线治疗、辅助治疗以及免疫经治人群的治疗进展和展望。随着多个靶免联合方案在晚期肝癌一线治疗中取得可喜的疗效,抗血管生成药物联合免疫的这一治疗组合被前移至辅助治疗,填补了肝癌术后无标准辅助治疗方案的空白并再次证实了靶免联合方案的疗效。而一线靶免出现耐药后,二线治疗如何选择是临床关注的重点问题,抗血管生成药物联合免疫在免疫经治人群的研究探索正助力解决这一临床问题。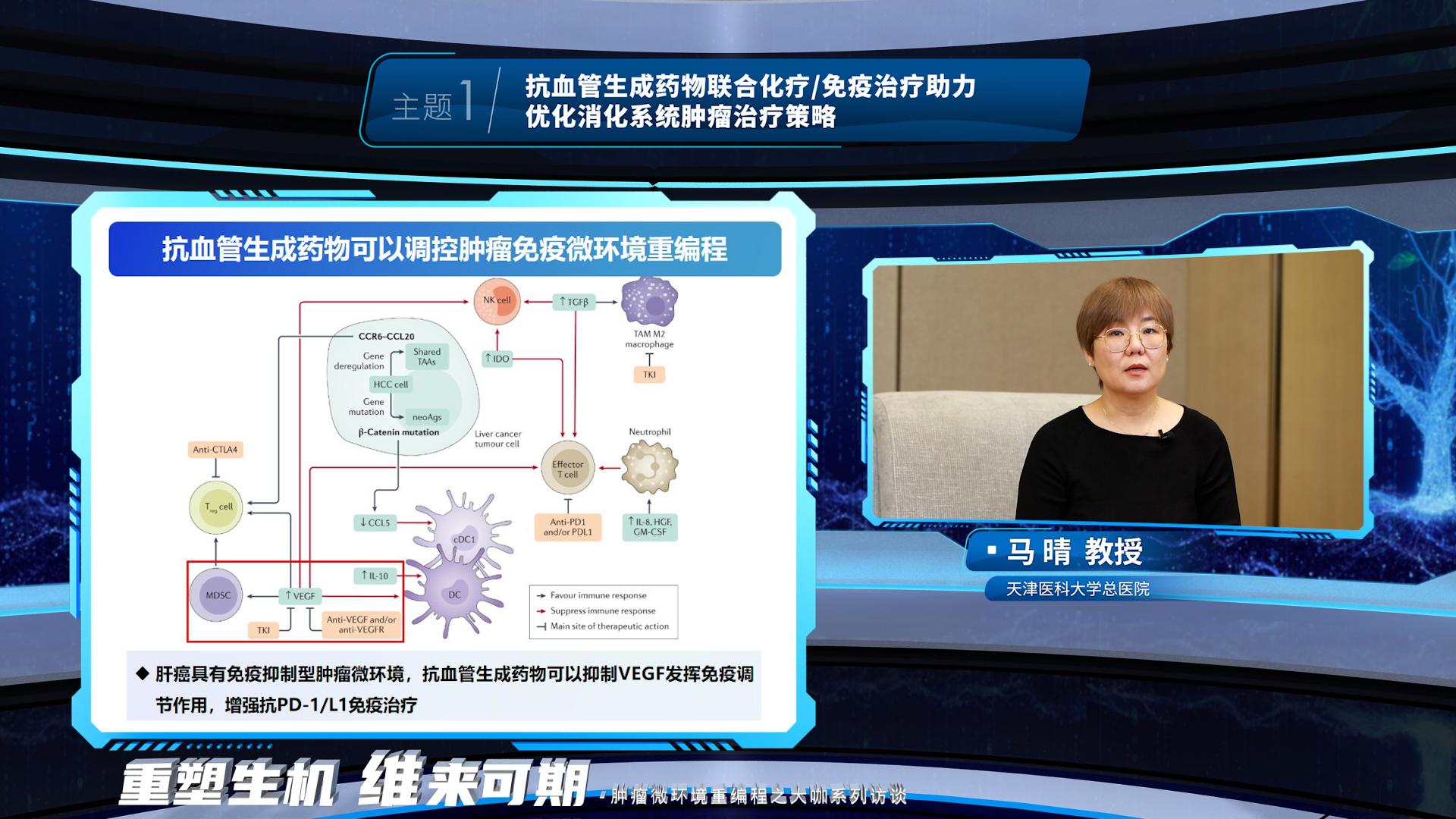

接下来,孙永琨教授指出,抗血管生成药物全面调控肿瘤微环境重编程,为晚期胆道恶性肿瘤和胰腺癌患者的治疗提供机制基础,并提供更多的治疗选择。近年来,抗血管生成药物联合免疫及化疗这种三联四药模式在胆道癌和胰腺癌的临床实践中取得了诸多突破,为患者带来更多的临床获益。 
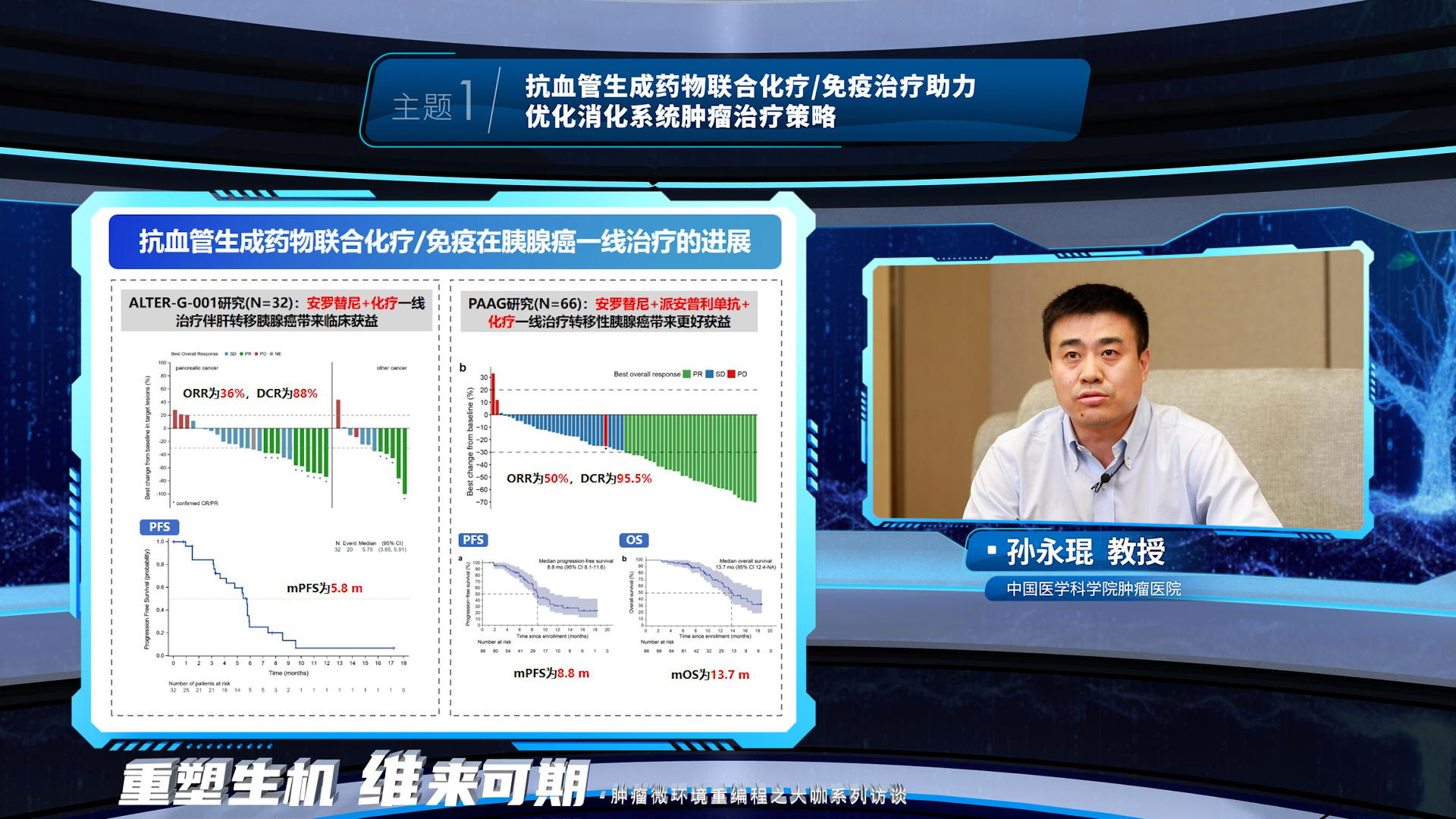
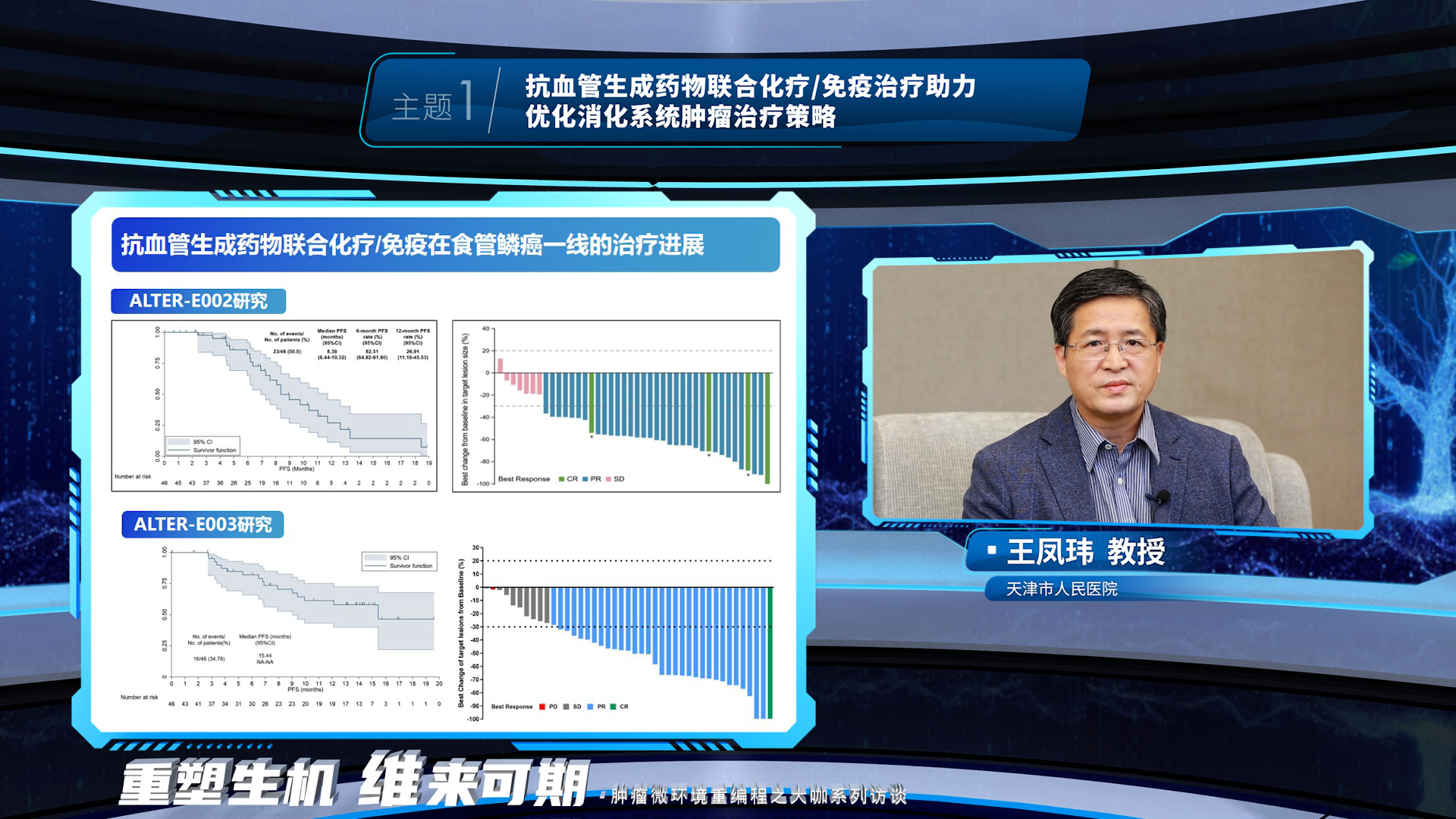
晚期食管鳞癌和胃癌已进入联合治疗时代。王凤玮教授表示,抗血管生成药物可以调控食管鳞癌细胞外基质,促进药物递送与分布,这一机制基础在临床研究中也得到进一步证实,抗血管生成药物联合化疗/免疫一线治疗食管鳞癌、抗血管生成药物同时联合化疗和免疫一线治疗食管鳞癌和胃癌都有很多的探索,旨在为患者带来更多的临床获益。
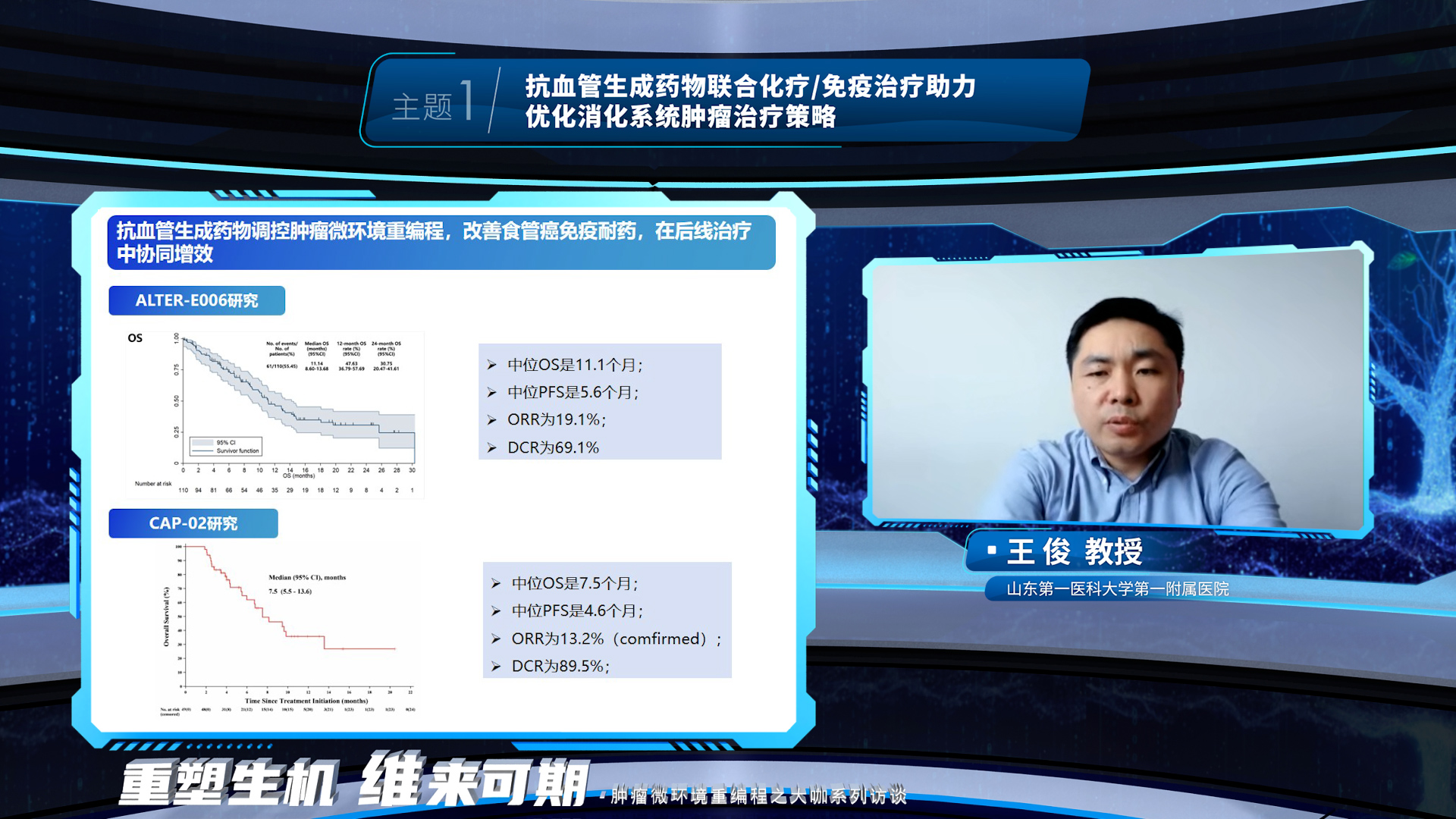
食管鳞癌后线治疗面临的最大困境是免疫耐药。在本环节的最后,王俊教授介绍了抗血管生成药物在食管鳞癌免疫经治患者中的研究探索,抗血管生成药物调控肿瘤微环境重编程,改善食管癌免疫耐药,在后线治疗中协同增效. 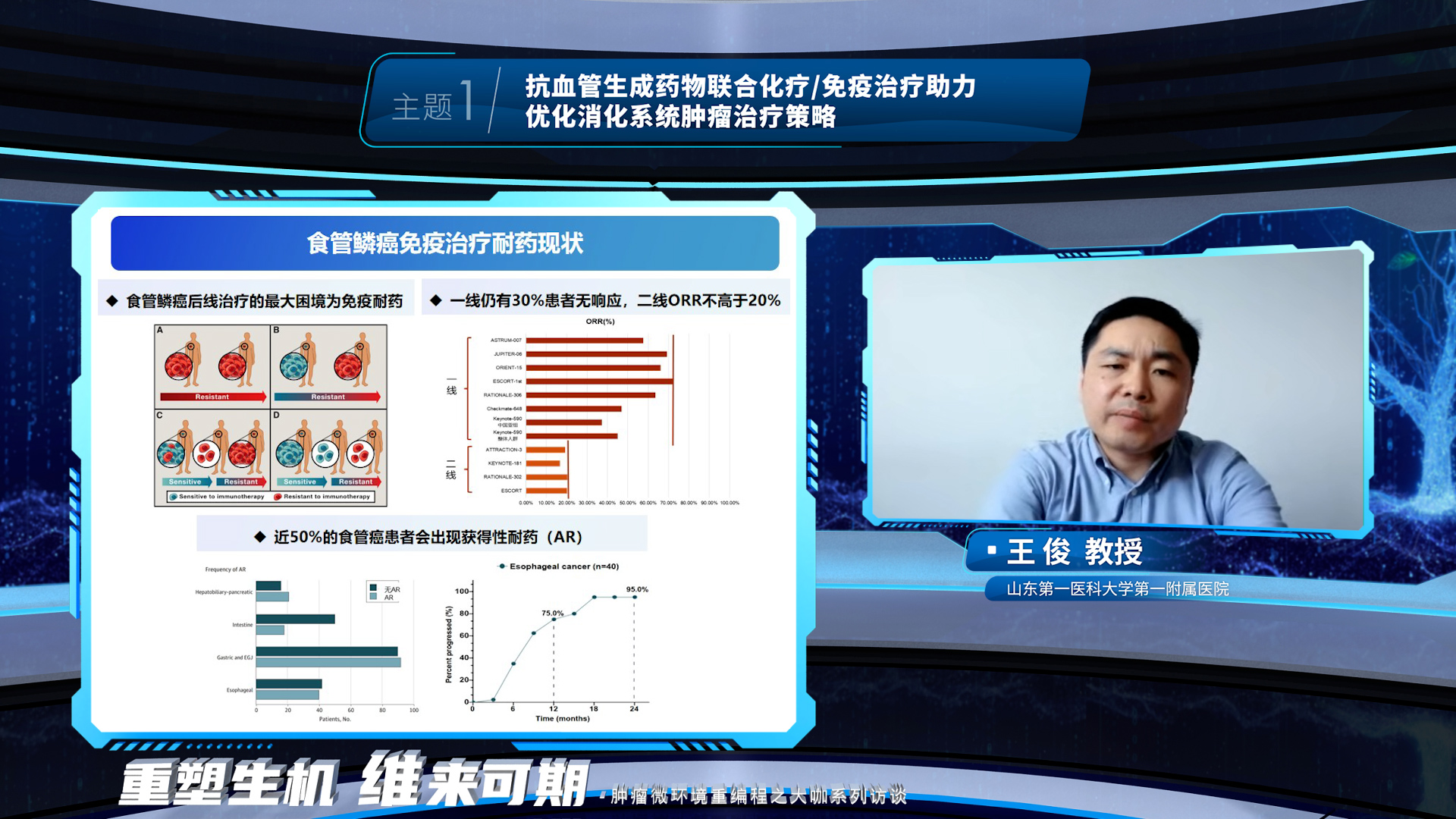
主题2:抗血管生成药物联合局部治疗助力优化消化系统肿瘤治疗策略
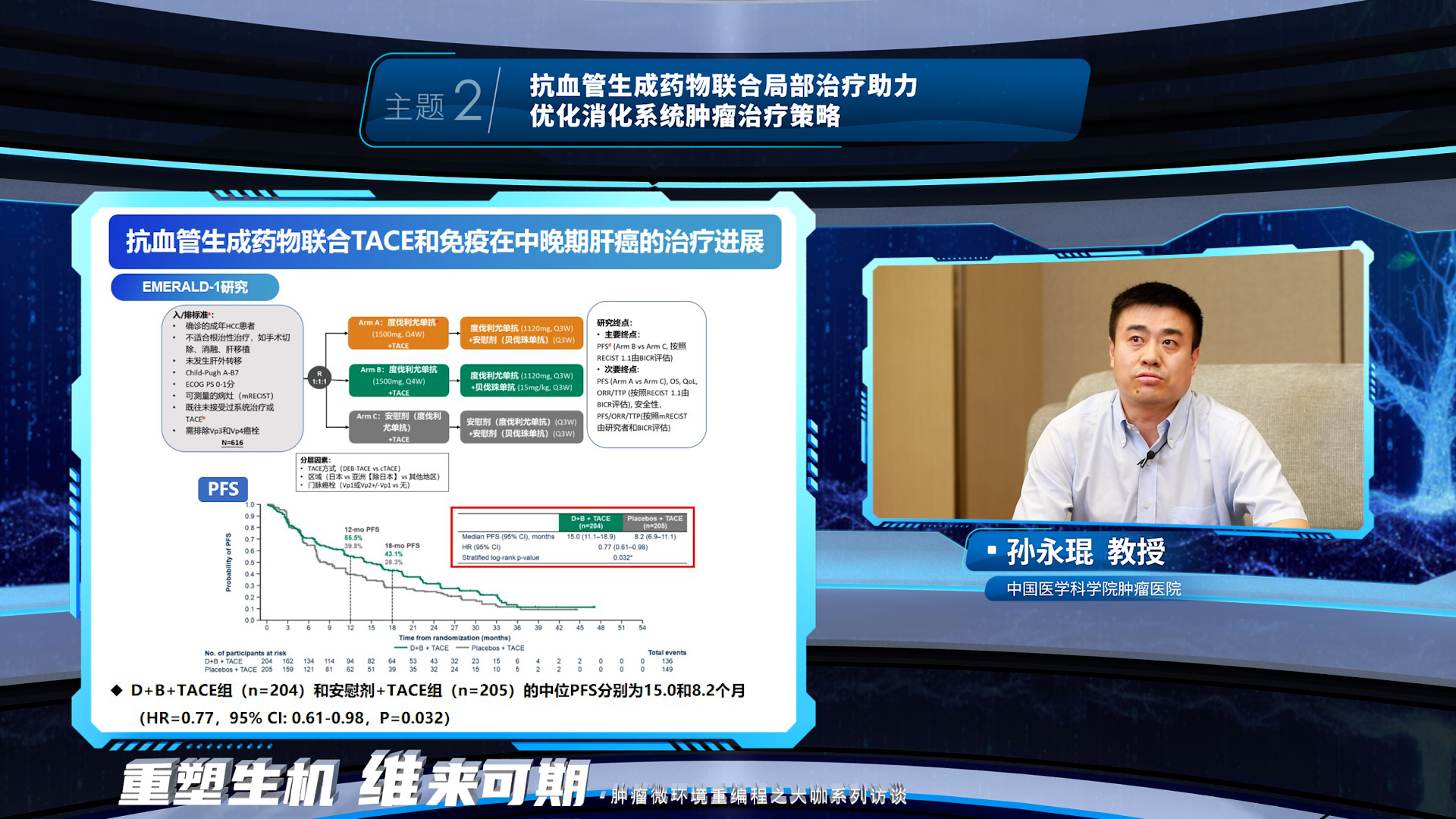
第二环节,孙永琨教授首先讲解了抗血管生成药物联合肝动脉灌注化疗 (TACE) 增强抗肿瘤免疫反应的机制基础,随后介绍了抗血管生成药物联合TACE和免疫在中晚期肝癌的治疗进展。随后,马晴教授介绍了抗血管生成药物联合TACE的这一协同增效的抗肿瘤作用,同样可以为肝癌辅助治疗带来疗效获益。 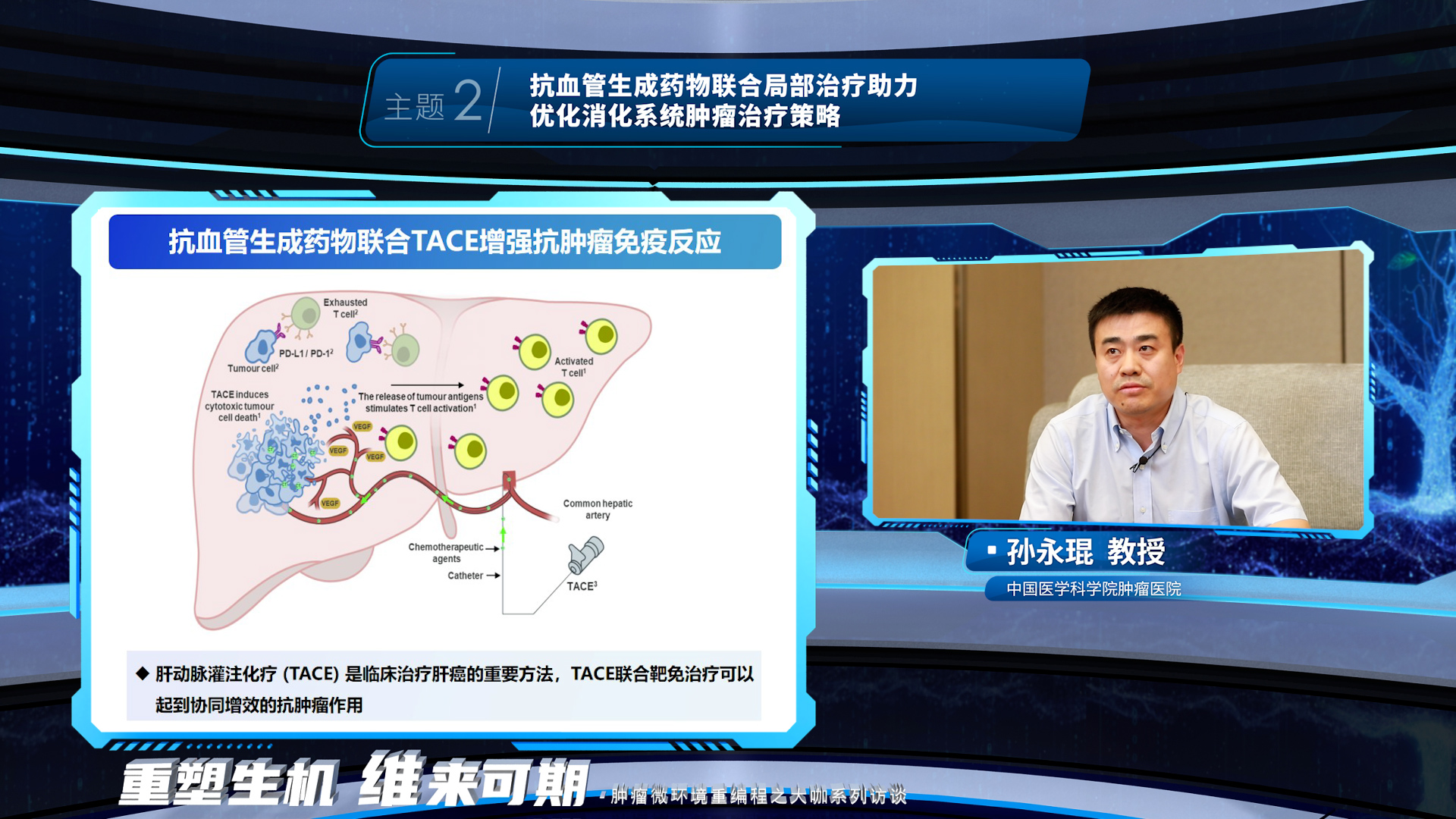

而针对伴肝转移实体瘤,刘波教授首先从实体瘤肝转移病灶微环境的特点开始讲述:血供丰富且伴血管新生导致大分子VEGF抑制剂疗效不佳;胶原沉积、细胞外基质硬化、实体压力升高,阻碍药物输送;免疫抑制微环境导致仅用免疫检查点抑制剂不敏感。随后介绍了抗血管生成药物通过调控肿瘤微环境重编程,可以单药或联合局部治疗为肠癌肝转移带来临床获益。

王凤玮教授则阐述了抗血管生成药物可以通过改善肿瘤组织的缺氧情况增敏放疗,且两者均能杀伤肿瘤细胞,起到协同增效的作用。这一作用也在临床研究中得到证实,抗血管生成药物联合放疗治疗食管鳞癌协同增效,有望提升临床获益。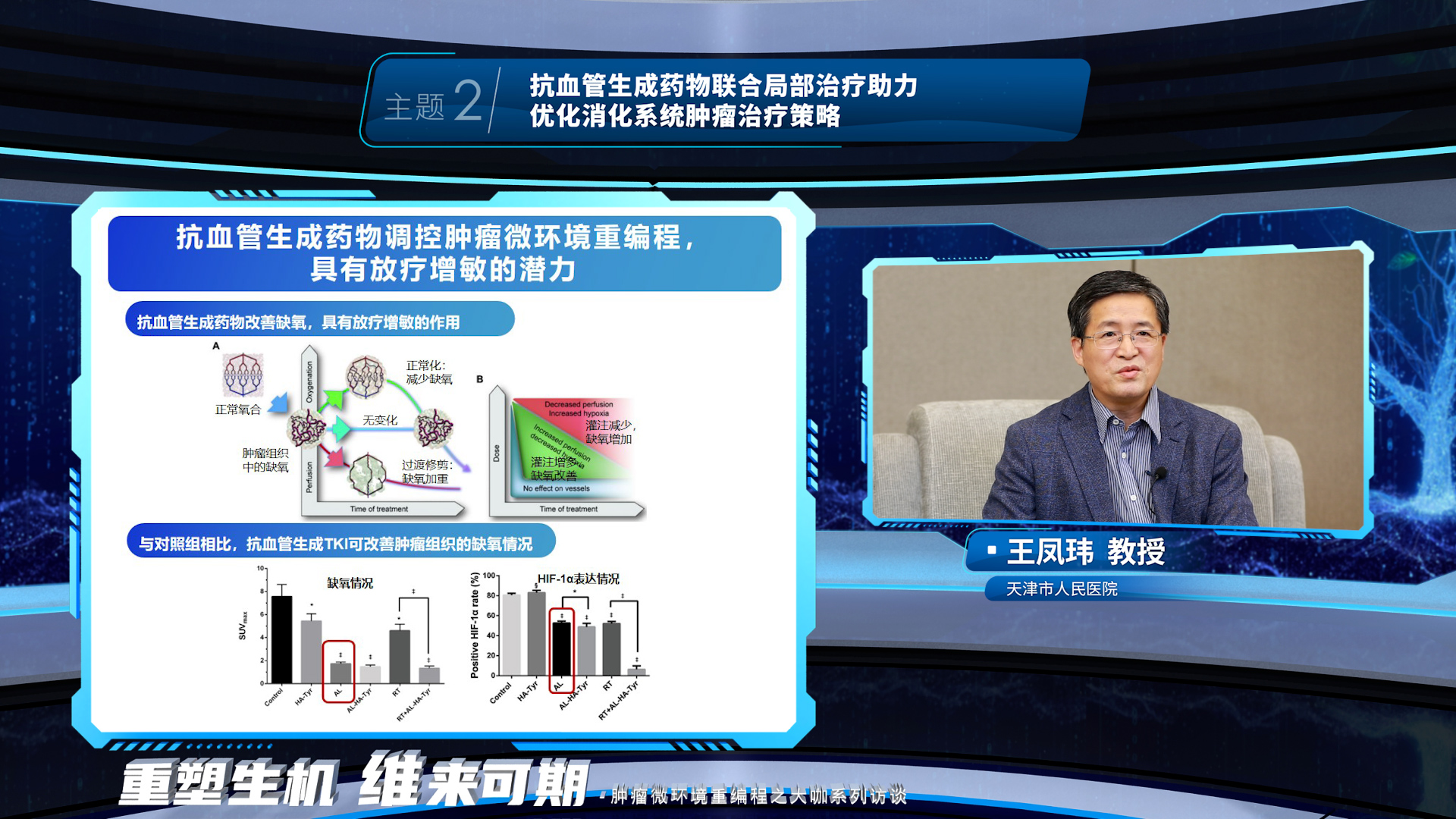

最后,王俊教授对本次访谈的讨论内容进行了总结,抗血管生成药物从肿瘤细胞重编程、肿瘤血管基质重编程和肿瘤免疫微环境重编程等方面全面调控肿瘤微环境,是单药治疗有效、联合化疗/免疫治疗/局部治疗协同增效的机制基础。深入地认识这些机制,并从机制到临床,去指导临床用药和临床实践,以更好地优化肿瘤治疗策略,提高消化系统肿瘤的治疗疗效,造福广大患者。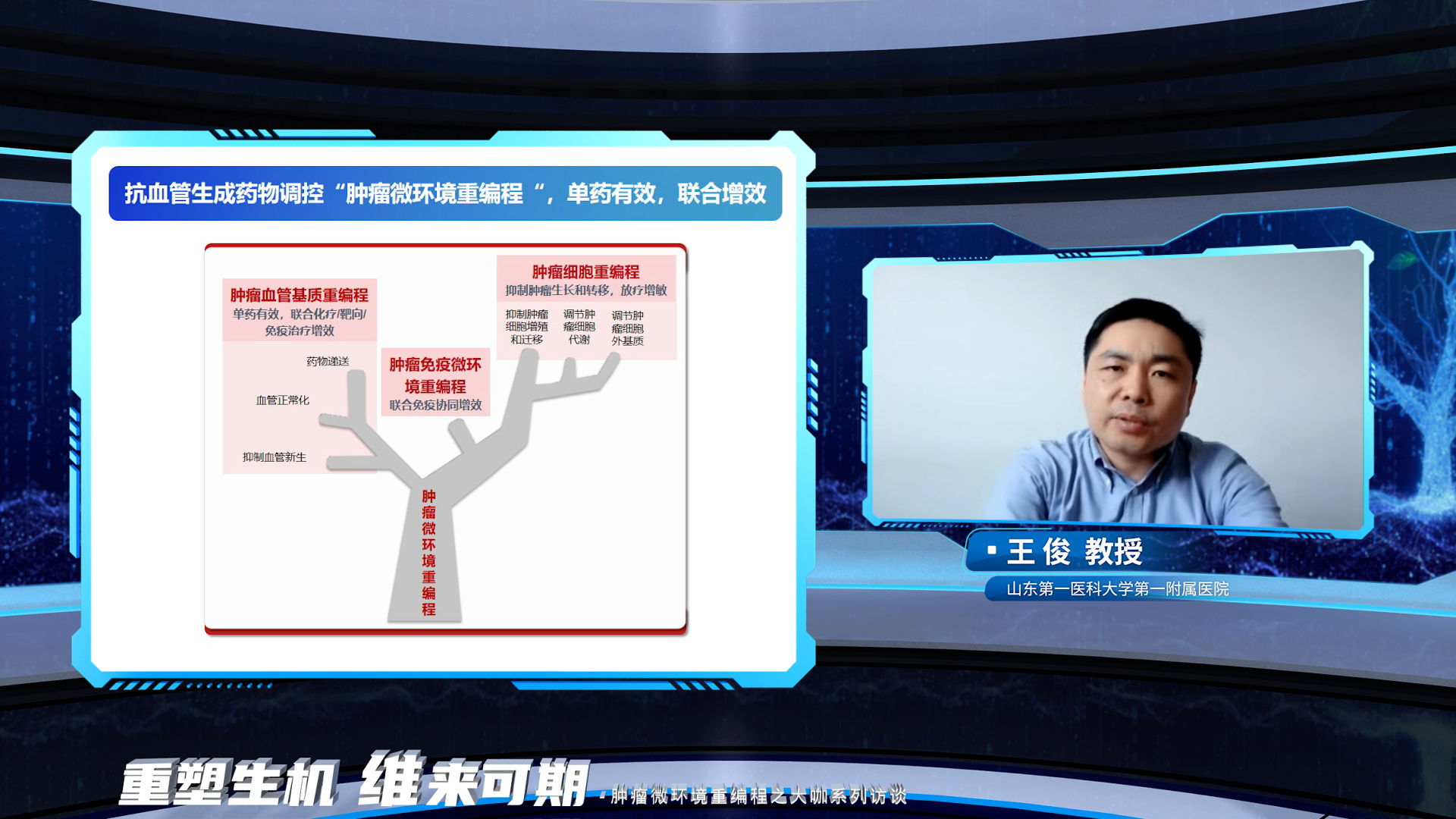
本次访谈由消化系统肿瘤的知名专家,详细梳理了抗血管生成药物通过全面调控肿瘤微环境重编程发挥联合增效的机制基础和临床进展。结合结直肠癌、肝胆胰肿瘤、食管癌和胃癌的临床研究进展及治疗难点,深入探讨了抗血管生成药物的联合方案及临床应用方向,为优化消化系统肿瘤的治疗策略,指导临床实践,提供了新的思路和方法。我们期待未来在消化系统肿瘤治疗领域能够有更多突破性的进展,为更多患者带来福音。