中国抗癌协会
立即下载App《中国恶性肿瘤学科发展报告(2023)》——神经肿瘤研究进展篇

1.概述
为了梳理2023年度我国神经系统肿瘤的研究进展,推动神经肿瘤学科建设,更好的服务神经肿瘤临床工作,助力神经肿瘤科技创新,中国抗癌协会神经肿瘤专业委员会在中国抗癌协会总会的领导和组织下,对神经系统中肿瘤领域在过去的一年中的研究进展进行总结。在肿瘤治疗的实践过程中,出现了很多新的治疗技术和术语,如术中快速分子病理检测、患者报告结局等,将在后续章节中详细介绍。本报告总结神经系统肿瘤所属胶质瘤、垂体瘤、脊髓肿瘤、原发性中枢神经系统淋巴瘤、脑转移瘤等亚专业领域在各自领域2023年的新进展进行阐述。
 2.我国神经肿瘤学科研究进展
2.我国神经肿瘤学科研究进展
2.1
本学科研究新进展
2.1.1 胶质瘤学科发展现状
WHO CNS5对脑脊髓肿瘤分类进行了第六次修订,引入了更加丰富的分子分型,以及更加完善的与组织学类型相结合的整合病理诊断与分级。临床常见的胶质瘤病理类型有:星形细胞瘤,IDH突变型(IDH1,IDH2,ATRX,TP53,CDKN2A/B);少突胶质瘤,IDH突变+1p19q共缺失(IDH1,IDH2,1p/19q,TERT,CIC,FUBP1,NOTCH1);胶质母细胞瘤,IDH野生型(IDH野生型,TERT,7/10染色体改变,EGFR)等。不同分型意味着不同的治疗策略和预后,所以提供实时的分子突变信息,将允许外科医生根据每个患者的基因图谱调整手术策略。在大多数神经病理学实验室中,1p/19q共缺失是通过荧光原位杂交(FISH)检测,IDH突变(IDH1 R132H)则通过免疫组化(IHC)方法进行检测。其他更详细和精确的分子突变信息将会根据患者需求进一步进行基因测序分析。然而,基于下一代测序技术(NGS)的基因检测不仅价格较高,而且检测周期较长(5-14天),无法应用于术中检测。随着神经外科的发展,人工智能的融合,研究人员开发了基于MRI的影像组学技术,可用于术前无创预测IDH突变状态。然而大部分影像组学模型尚缺乏外部验证集,不能很好解释模型构建原理,影响了临床的应用和转化。与此同时,科学家们也在尝试对组织标本的术中检测技术。下文总结了近年来胶质瘤术中分子检测技术的研究进展。
直接分子检测技术:基因测序技术正在快速发展,分子检测已经从选择性使用标准PCR发展到常规使用实时定量PCR (Real Time-PCR),再到最近的下一代测序或高通量测序。在整个演变过程中,桑格(Sanger)DNA测序一直是测定核酸序列的金标准,但每次反应只能检测少量的序列,且对检测标本要求较高(目标序列含量不少于20%)。NGS则可在大规模并行高通量测序时单次进行数百万到数十亿个的测序反应,明显缩短了检测时间和成本,增加了输出的序列,对科学研究和临床实践有重要意义。然而这些技术仍然耗时较长,操作复杂,只能用于对术后标本的检测。我们在临床实践中,主要是想通过术中检测获取少数已知关键分子的突变状态(如IDH、TERT等)。为此,科学家开发了一系列点突变检测的技术,使术中分子检测成为可能。

(1)IDH1和IDH2的突变主要为4号外显子132密码子和172密码子的改变。有多种方法可检测这些突变,包括焦磷酸测序、免疫组化、低温变性共扩增PCR(CO-amplification at Lower Denaturation temperature PCR, COLD-PCR)等。单个核苷酸位点的突变会使双链DNA溶解的温度发生改变,COLD-PCR利用这一特征,在PCR过程中通过精确控制温度,使突变频率很低的目的片段呈指数级扩增。科学家对COLD-PCR继续优化,将扩增产物进行荧光溶解曲线分析(FMCA),实现了快速、灵敏、特异的术中检测IDH1和IDH2突变。该技术灵敏度高特异性好,即使突变频率低至2.5%也能准确进行检测,从取下标本到得出突变结果仅耗时约60min,结果准确可靠。该技术的难点在于对不同突变片段临界温度的确定,暂且只能进行IDH1和IDH2的突变检测,大规模的临床应用也尚缺乏可靠的前瞻性研究证据。
(2)实验室常用的DNA提取步骤一般都需要裂解、反复多次离心和洗涤,操作比较耗时费力。科学家建立了一种简单的DNA提取方法,仅需将少许胶质瘤标本用Tris-EDTA缓冲液在95℃条件下孵育5min,收集上清即可。作者进一步整合已开发的IDH荧光探针(all-in-one),进行了后续的测序检测,整体流程需要90-100min,在保证检测结果准确性的同时大大提升了检测效率,可用于术中的分子检测。该技术可检测肿瘤细胞含量高于10%的组织,目前只能检测IDH突变状态,其他分子指标有待进一步开发。
(3)扩增阻滞突变系统(Amplification Refractory Mutation System-PCR,ARMS-PCR)是基于PCR技术建立的用于检测已知点突变的方法。其原理是在PCR过程中引入2条引物,使其3’端碱基分别与突变和野生型模板碱基互补,随着DNA链的延申就可以将突变状态检测出来。但在实际过程中单个错配碱基有时也可以进行DNA链的延伸,造成假阳性。Timucin等人提出了包含3个错配碱基的系统(3m-ARMS),即在野生型引物3’端加入3个错配碱基,明显减弱非特异性延伸,总耗时1个小时,操作方便,非常适合术中使用。该技术对于引物设计要求较高,目前只能进行IDH1/2的检测。
(4)锁核酸(Locked Nucleic Acid,LNA)是一种特殊的核酸衍生物,可与相应DNA单链片段互补结合形成杂交体。相比与普通双链DNA,杂交体具有更高的溶解温度(Tm)。基于该原理,阎海教授团队将LNA技术用于分子检测的qPCR中开发了GliomaDx技术,可明显增强突变位点与引物的特异性结合,促进突变片段的指数扩增,从而提高了目的基因的检测效率。GliomaDx技术的敏感性是Sanger测序的200多倍(最低可检测密度为0.2%),可识别出其他技术可能漏诊的病例,并且可在1个小时内完成对组织样本IDH及TERT突变状态的检测。另外,该技术操作简单,如果能够扩大检测范围,将可以大大提升术中分子检测的实用性。
其他检测技术:分子病理的重要性日益凸显,科学家们提出了对术中分子分型的渴求,也一直在研发不同的检测新技术。IDH状态是胶质瘤分型和预后的重要指标,IDH突变后可形成2-羟基戊二酸(2-HG)的堆积,有学者建立了一系列检测2-HG的方法,可间接反应IDH的突变状态。质谱分析是一种测量物质质荷比的方法,已被广泛用于医疗领域。近几年来有许多经研究聚焦于质谱技术实现术中对2-HG的快速检测,比如高效液相色谱-电喷雾串联质谱法(Liquid Chromatography/Electrospray Ionization tandem Mass Spectrometry, LC/ESI-MS/MS)、解吸电喷雾电离质谱(Desorption Electrospray Ionization-Mass Spectrometry, DESI-MS)、气相色谱-质谱联用(Gas Chromatography Mass Spectrometry,GC-MS)等等,这些技术不仅可以间接判断IDH状态,还可以评估肿瘤细胞百分比,时效性和准确性都很好,但目前仅能作为一种辅助技术,也许未来随着技术的发展可以大规模应用于临床,整合入胶质瘤治疗管理,术中评估多种分子突变状态,甚至可用来评估肿瘤边界。
其他可快速检测分子突变状态的技术还包括拉曼光谱、快速免疫组化、微流控技术等。术中分子检测相比常规术后的分子检测要求较高,必须具备高灵敏度、高特异度、高时效性,且操作流程简捷。所以目前大部分的检测技术还需更新迭代,不断发展,以适应时代发展需求,转化成临床实践成果。各类技术的优缺点详见表1。目前,国内参与术中快速分子病理检测的平台和团队主要有复旦大学附属还是医院神经外科吴劲松教授团队、山东大学齐鲁医院神经外科李刚教授团队。
脑胶质瘤的弥漫性生长意味着外科医生很难完全切除肿瘤,胶质瘤的切除范围(Extent Of Resection,EOR)也一直是神经外科领域的研究热点。2008年时Berger教授团队研究低级别胶质瘤的EOR时发现,EOR大于90%的患者会有相对较好的5年OS(97%)、5年PFS(75%)、8年OS(91%)、8年PFS(43%)。他们还发现当EOR阈值在80%以上时,低级别胶质瘤患者的OS会随着EOR的提升而提高。在精准医疗时代,针对不同分子亚型的脑胶质瘤患者进行个体化治疗是未来趋势。WHO CNS5对不同分子亚型(如IDH突变、1p19q共缺失、TERT启动子突变等)给出了比较明确的诊断分类,不同诊断分类的胶质瘤对应不同的术后辅助治疗策略及预后预期,而其对胶质瘤手术的指导尚不明确。神经外科医生在术中实时了解肿瘤的分子病理,及时调整手术策略,并在最大化肿瘤切除与最小化功能损伤之间取得平衡,将变得越来越重要。研究发现胶质瘤患者IDH突变率为46%,TERT启动子的突变率为45%,包含IDH和/或TERT的突变率达到了91%。我们以IDH和TERT突变状态为线索,结合WHO CNS5,对不同分子亚型患者预后与手术切除程度的相关性总结如下(如图1)。
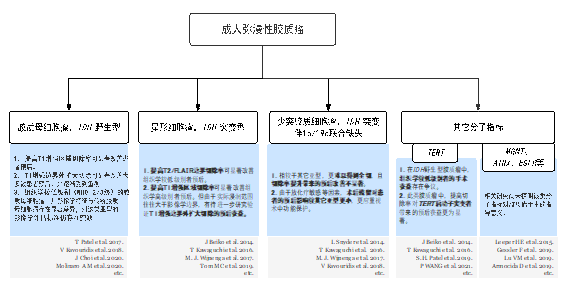
1. IDH突变型(IDHmut)+TERT突变型(TERTmut)
诸多研究发现,成人胶质瘤中IDH和TERT的双突变几乎与1p19q共缺失是一致的,这里我们认为IDHmut+TERTmut的分子分型是少突细胞胶质瘤。
江涛教授团队利用中国胶质瘤基因组图谱数据库(Chinese Glioma Genome Atlas database, CCGA)对449例胶质瘤患者的临床及病理信息分析发现,对于KPS>80,年龄>45岁的少突细胞胶质瘤患者,与次全切(Subtotal Resection, STR)相比,肿瘤的完全切除(Gross Total Resection, GTR)不能使患者受益。也就是说对于该分子分型的胶质瘤在手术切除时不必太过激进,少许残留不会影响患者预后。这可能是由于少突胶质细胞瘤呈惰性生长,且对常规术后辅助治疗(放疗及替莫唑胺化疗)较为敏感,即使不能完全切除肿瘤,患者仍可存活较长时间。该团队还提出对于这些肿瘤应该进行“有效的安全切除”,即在保留功能的前提下最大化切除肿瘤。Daniel等人也发现,少突胶质细胞瘤的肿瘤是否完全切除(GRT)对患者的总体生存影响不大。所以结合Berger教授对低级别胶质瘤的研究,对于分子分型为IDHmut+TERTmut的胶质瘤,可在保留功能前提下有效切除(EOR>80%)。
2.IDH突变型(IDHmut)+TERT野生型(TERTwt)
依据最新的胶质瘤分类指南WHO CNS5,IDHmut胶质瘤应诊断为:星形细胞瘤,IDH突变型,组织学等级分为2-4级,其中以低级别胶质瘤为主。低级别星形细胞瘤是一种生长相对缓慢的浸润性脑肿瘤,指南推荐低级别胶质瘤的影像学切除边界则为T2WI/FLAIR的高信号区域。Wijnenga等人研究分析发现,对于低级别IDHmut星形细胞瘤(WHO 2级),任何术后残留都会影响生存预后,甚至提出在确保患者安全的情况下进行二次手术,切除残余肿瘤,以达到肿瘤全切(GTR)的目的。江涛教授团队的研究也指出,对于低级别星形细胞瘤(IDHmut),提升切除范围(Extent Of Resection, EOR)可改善患者的生存预后。另外对于2021版指南中高级别IDHmut星形细胞瘤(WHO 3-4级),即2016版《WHO中枢神经系统肿瘤分类标准》(2016 CNS WHO)分类中IDH突变的间变星形细胞瘤和胶质母细胞瘤,并不是所有肿瘤在术前影像上都有T1WI增强序列的强化灶,关于切除范围的研究较少。Daniel等人发现,对有强化灶的患者进行影像学边界(强化灶)切除,可明显改善生存预后,而强化灶以外的切除尚有争议。对于无强化灶的患者,切除范围对预后的影响也需要进一步研究。所以总体来说,这部分患者应尽可能做到影像学边界全切。
3.IDH野生型(IDHwt)+TERT突变型(TERTmut)
依据最新的胶质瘤分类指南WHO CNS5,该类型突变应诊断“胶质母细胞瘤,IDH野生型,WHO 4级”,预后较差。目前高级别胶质瘤手术切除的共识是,按照其影像学边界,即磁共振T1WI的增强区进行切除。然而,由于胶质母细胞瘤具有很强的浸润性,肿瘤细胞常出现在增强区域之外的瘤周区,即T2WI/FLAIR的高信号区(非增强区)。2020年发表在JAMA Oncology上一项多中心回顾性的研究提出,对于胶质母细胞瘤,同时切除高级别胶质瘤的增强区和非增强区可明显改善年龄小于65岁患者的预后,对于65岁以上的患者,扩大切除非增强区可能获益不明显。Debraj等人通过的荟萃分析也发现,相比于影像学边界的全切(GTR),扩大切除非增强区可明显提高胶质母细胞瘤患者的生存时间。目前的观点基本支持对非增强进行扩大切除,但对于应达到怎样的切除阈值对患者预后获益最显著仍有争议。对于少部分IDHwt+TERTmut分子分型的胶质瘤,组织病理表现为较低级别胶质瘤,影像学上并无T1WI增强区,有关手术切除范围的研究较少。我们团队的一项回顾性研究发现,对于此类型的胶质瘤,基于T2WI/FLAIR高信号区的最大化安全切除可使患者明显受益。
4.IDH野生型(IDHwt)+TERT野生型(TERTwt)
对于分子分型为IDHwt+TERTwt的胶质瘤,如果其组织病理为高级别胶质瘤(合并微血管增生/坏死等恶性特征),则可诊断为胶质母细胞瘤(符合2016 CNS WHO分类标准和WHO CNS5分类标准)或儿童弥漫性高级别胶质瘤(主要分子特征为组蛋白H3改变,包括H3 K27改变及H3 G34突变,以及其他分子改变)。胶质母细胞瘤手术切除范围的研究如前文所述,建议进行增强区+T2/FLAIR高信号区(非增强区)切除的手术策略。而儿童弥漫性高级别胶质瘤多数侵犯功能区或中线部位,手术完全切除难度大,研究发现只有对肿瘤的完全切除(GTR)才会有明显的生存获益,而次全切(STR)与活检相比则无明显的生存差异。这就要求术者在术前对肿瘤类型及切除程度有所判断,或者通过活检取样,对相关分子指标进行术中检测,术中明确其病理诊断,再决定是否进行GTR或手术以外其他辅助治疗。所以对于儿童高级别胶质瘤的相关手术策略研究,可能还需要更为可靠的术中分子检测技术的支持。IDHwt+TERTwt分子分型中组织病理为低级别的胶质瘤,准确的分子病理诊断需要结合相关分子的测序结果,其中少数具有特定分子特征:TERT启动子突变(TERTmut,该分子分型前文已阐述)、EGFR 基因扩增或7号染色体扩增/10号染色体缺失三者之一,纳入胶质母细胞瘤的诊断,暂无与EOR相关的详细分子分层研究,可依据指南进行T2/FLAIR高信号区(影像学边界)切除的手术策略。其余主要考虑诊断为儿童弥漫性低级别胶质瘤,包括“弥漫性星形细胞瘤,伴MYB/MYBL1改变”、“血管中心型胶质瘤”及“弥漫性低级别胶质瘤,伴MAPK信号通路改变”等。既往对所有IDHwt的低级别胶质瘤的研究发现,提升T2WI/FLAIR高信号区(影像学边界)的切除率可明显改善生存预后。在后续的研究中我们会更多关注不同分子分型与手术切除范围对患者预后获益的影响。另外,局限性星形细胞瘤的分子分型也为IDHwt+TERTwt,包括毛细胞型星形细胞瘤、多形性黄色细胞瘤等,影像学可表现为强化灶,如果术中检测出它们具有的特定分子特征(如BRAF、NF1、ATRX等突变),可帮助明确诊断,进行影像学边界切除即可达到很好的治疗效果。
2.1.2 垂体瘤学科进展
世界卫生组织(WHO)第5版与垂体相关的内分泌和神经内分泌肿瘤分类提供了基于肿瘤细胞谱系、细胞类型和相关特征的PitNET的详细组织学分型,脑垂体转录因子(PIT1, TPIT, SF1, GATA3和ERα)的免疫组织化学常规应用在这一分类中得到认可。
体细胞突变常发生在少数已知基因,40%垂体GH腺瘤发生GNAS激活突变,35%ACTH腺瘤发生USP8激活突变。拷贝数变异、DNA甲基化改变、肿瘤抑制因子下调和cyclin D1、PTTG过表达等,通过表观遗传机制促进细胞增殖。多组学研究通过分析不同谱系PitNETs发生的遗传特征,发现不同肿瘤簇具有不同的免疫微环境和间质特征,为免疫检查点抑制剂治疗此类垂体神经内分泌肿瘤提供重要的理论依据。
3D-SGE/3D-GRE增强序列、dMRI、CISS、FLAIR增强序列、各向同性3D快速自旋回波序列,超高场(7T)MRI、13N-Ammonia成像、影像组学模型可提高微腺瘤(< 3-4 mm)的检出效能。11C-MET PET联合容积MRI、18F?FET PET有利于检出异位垂体神经内分泌肿瘤。FLAIR增强序列、GRASP MRI肿瘤延迟廓清可鉴别无功能腺瘤与ACTH腺瘤。分子成像可作为判断术后残留/复发的补充。
2.1.3 脊柱脊髓肿瘤研究进展
脊髓肿瘤作为一类影响中枢神经系统的罕见疾病,其研究和治疗历经数十年仍面临巨大挑战。近年来,随着分子生物学、精准医疗和新兴技术的快速发展,针对脊髓肿瘤的研究取得了显著进展。从靶向药物的开发、基因编辑技术的应用,到先进成像技术的创新应用,这些进展不仅拓宽了我们对脊髓肿瘤生物学特性的理解,也为患者提供了更为个性化和有效的治疗方案。本报告依据最近的研究文献,旨在综合评述脊髓肿瘤研究的最新进展,包括治疗策略、诊断技术以及未来研究方向,为科研人员和临床医生提供一个全面的研究和治疗脊髓肿瘤的最新视角。
Carl Koschmann博士领导的密歇根大学安娜堡分校的团队在2023年发表,标题为“ONC201在H3K27M突变型弥漫性中线胶质瘤中的临床疗效是通过破坏整合的代谢和表观遗传途径驱动的”该研究集中在ONC201对H3K27M突变型弥漫性中线胶质瘤(DMG)的治疗效果。研究团队通过两项多中心临床研究,评估了接受ONC201治疗的患者的临床结果、肿瘤序列以及组织/脑脊液样本。结果显示,在初次放疗后接受ONC201治疗的患者中位总生存期为21.7个月,而在复发后接受治疗的患者中位总生存期为9.3个月。放射学响应与基线肿瘤序列中关键三羧酸循环相关基因表达增加相关。ONC201治疗在体外培养的H3K27M-DMG细胞和患者脑脊液样本中增加了2-羟基戊二酸水平,这与H3K27me3的增加以及细胞周期调控和神经胶质分化基因的表观遗传下调相对应。整体而言,ONC201通过干扰整合的代谢和表观遗传途径以及逆转H3K27me3的降低,显示出对H3K27M-DMG的疗效,为H3K27M突变DMG的治疗提供了新的方向。
Julio C. Furlan等人发表于《Neuro-Oncology》上的综述文章探讨了2000年到2020年间,针对原发性和转移性脊髓肿瘤治疗的注册临床研究进展。研究团队通过ClinicalTrials.gov网站收集了174项研究,主要集中在治疗策略上,包括立体定向放射外科、放疗、化疗和手术技术。这项综述强调了转移性肿瘤相对于原发性肿瘤在临床试验中的偏重,反映了原发性脊髓肿瘤的稀有性及其临床研究面临的挑战,同时强调了加强脊髓肿瘤转化研究的必要性,特别是针对原发性肿瘤的研究。
清华大学附属北京清华长庚医院神经中心主任王贵怀团队,在2023年以《基于多模态的机器学习策略实现精准无创预测脊髓胶质瘤分子标志物状态和分级》为题在BMC Medicine上发表研究论文。该研究表明,通过基于术前磁共振的人工智能方法,可在无创的情况下,准确地预测脊髓胶质瘤的分级以及分子标记的突变状态。这一发现或改变脊髓胶质瘤的诊断和治疗方式,将深度学习技术的应用推向新的领域。在研究中,王贵怀团队运用了一种基于多模态特征的深度学习模型,以无创方式预测髓内胶质瘤的等级和分子标记的突变状态。这一策略包括对来自两个机构、包含461例患者的大规模数据集进行深度学习,且均是在手术前获取的横断面和矢状面的T2加权磁共振成像扫描图像和临床数据。通过这种深度学习模型,研究者们可以自动分割出肿瘤并提取其放射性特征。这些特征的表现形式,被输入到提出的神经网络中,与其他主流模型进行比较。研究结果表明,研究团队提出的基于多模态融合特征的神经网络在预测髓内胶质瘤的分级、分子标记突变状态等方面的性能,优于其他主流模型。通过这项研究,研究者们首次基于多模态特征预测了ATRX和P53突变状态以及脊髓胶质瘤的等级,这或将无创地提供更多肿瘤特异性病理信息,以确定脊髓胶质瘤的治疗和预后。
德国癌症中心的Sham团队设计并对H3K27M突变型弥漫性中线胶质瘤(DMG)成人患者进行了首次特异性疫苗(H3K27M-vac)治疗的研究发表在《Nature Medicine》杂志上。研究表明,这种疫苗能够安全地诱导出针对H3K27M突变的特异性免疫反应,有5名患者接受了H3K27M-vac联合抗PD-1治疗。结果显示,接种疫苗后的中位无进展生存期为6.2个月,中位总生存期为12.8个月。这项研究证实了H3K27M-vac疫苗在治疗进展期H3K27M+ DMG患者中的安全性和免疫原性,为这一棘手疾病的治疗提供了新的方向。
Konstantin Okonechnikov团队,利用全基因组染色体构象捕获(Hi-C)技术,结合CTCF和H3K27ac的ChIP-seq以及基因表达和DNA甲基化分析,在脊髓和脑部的室管膜瘤(ependymoma)中识别了与异常基因表达相关的染色体构象和调控机制。特别地,研究发现由结构变异引起的新的拓扑关联域('neo-TADs'),特定于分组的3D染色质环和CTCF绝缘体被DNA高甲基化所取代。通过抑制实验,研究验证了这些3D基因组构象所暗示的基因对于患者来源的室管膜瘤模型的生存至关重要,这种方法甚至适用于缺乏可靶向遗传改变的肿瘤,为缺乏可靶向遗传改变的肿瘤提供了揭示肿瘤依赖性基因的新方法。
北京天坛医院贾文清团队,2023年的研究,利用H3 K27M突变脊髓弥漫性胶质瘤的基因组分析,深入探讨了H3 K27M突变脊髓弥漫性胶质瘤的临床病理学和分子特征,揭示了其与脑中线胶质瘤的差异性。研究表明,这类脊髓肿瘤在分子水平上表现出显著的异质性,如TP53突变的频繁发生以及与PPM1D和NF1突变的相互排斥性。此外,研究识别了影响患者预后的关键分子标志物和路径,例如拷贝数变异、特定染色体臂的缺失或扩增。组织学类型被证实是H3 K27M突变脊髓胶质瘤预后的独立因素,为临床治疗提供了重要信息。该研究为改善这种肿瘤的诊断和治疗策略提供了新的见解。
瑞典的Karolinska Institutet的研究团队,利用单细胞和空间多组学数据分析方法,创建了人类发育中脊髓的全面发育细胞图谱。研究团队采集了16个胚胎和胎儿脊髓样本,覆盖了怀孕后5至12周的时间段,通过单细胞RNA测序(scRNA-seq)、空间转录组学(ST)和基于杂交的原位测序(HybISS)技术,分析了这些样本。他们揭示了神经祖细胞的细胞命运承诺是如何被特定基因集在时空上调控的,识别了人类和啮齿动物脊髓发育中的独特事件,包括神经干细胞的早期休眠、细胞分化的差异调控以及细胞命运选择的独特时空遗传调控。此外,通过将他们的图谱与儿童室管膜瘤数据集成,他们识别了癌症干细胞特有的分子标志和谱系特异性基因。这项研究为理解人类脊髓发育的时空遗传调控提供了新见解,并利用这些数据来深入了解疾病。
2.1.4 PCNSL学科研究进展
PCNSL的预后较前有了显著的改善,目前治疗的基石仍是以HD-MTX 为基础的单药或多种药物联合化疗。免疫化疗、低剂量 WBRT的产生了极好的疾病应答率。目前PCNSL治疗中尚未解决的问题主要体现在:更好的一线治疗方案、巩固WBRT的必要性以及HDC/ASCT的确切作用。
2.1.5 脑转移瘤学科研究进展
当前脑转移瘤的治疗模式充分体现了综合治疗和个体化治疗的理念。针对不同原发灶病理和分子标志物的靶向药、免疫制剂在脑转移瘤方面均取得了较大的进展,尤其在EGFR、ALK等基因突变的NSCLC脑转移及Her-2阳性乳腺癌脑转移方面,新药层出不穷,近年来发表了多项成果。
此外,在放射治疗方面,立体定向放疗(SRT)的适应征不断扩大,在小细胞肺癌及脑转移瘤术前放疗中均进行了回顾和前瞻性研究探索,整体治疗趋于精准化,强调正常脑组织的保护及神经认知功能保全。全脑放疗(WBRT)的地位继续受到挑战,且WBRT的方式亦有所改进。
目前脑转移瘤治疗中尚未解决的问题主要体现在:1、对于大体积脑转移瘤的放疗分割方式上仍有待改进,以在进一步提高局控率的基础上尽量降低毒副反应;2、对于小体积脑转移瘤,国内外SRT的常用分割方式不完全相同,尚无头对头比较;3、对于多发性脑转移瘤,真实世界中治疗方式较为混乱,SRT与WBRT的选择、WBRT同步加量与序贯加量的选择等尚无高级别证据推荐;4、放疗与分子靶向药、免疫制剂等全身治疗联合应用的时机、放疗剂量和方式是否需要调整,以及如何减轻联合治疗后增加的放射性脑坏死毒性等仍需进一步探索;5、术前SRT仍处于探索阶段,其与术后SRT的优劣尚无定论,在国内开展较少;6、放疗后假性进展和复发的鉴别仍为临床难题,缺乏有效的鉴别手段及预测模型;7、放射性脑坏死的剂量限制及治疗方法仍需进一步明确和探索。
2.2
国内相关重大计划和研究项目
2.2.1胶质瘤:
(1)患者自报告结局(PRO)在临床试验中的应用
胶质瘤的治疗手段主要依赖肿瘤的手术切除、放化疗和辅助治疗,肿瘤本身及相关治疗都会使患者承受一系列的症状负担。无论是对脑损伤的评估还是对治疗效果的评价,患者神经功能状态的测试都是重要的参考信息;此外,在干预性的临床研究中,患者症状及生活质量的检测及不良事件的评价也是必要的研究数据。但在评估以上信息时,医务人员常造成评估结果的误差,尤其是对不良事件的低估。
患者报告结局(PRO)是完全由患者本人报告的,不经医护人员及其他人员解释的原始信息,有助于医务人员准确评估患者的相关信息,并促进患者参与共同决策。目前已广泛应用于临床试验和公共卫生领域,其相关标准也在逐渐完善。但在我国胶质瘤领域,PRO在患者报告结局测量工具(PROM)的研发、PRO评估的伦理规范、PRO数据的处理等方面都明显不足。
吴劲松教授团队联合17所医院的相关专家基于NCI的不良事件通用术语患者自我报告版本(PRO-CTCAE ®)条目库,针对中国成人型弥漫性胶质瘤患者在术后治疗相关的不良事件评价制定了“定制化PRO-CTCAE ®量表”。目前,应用该量表的一项前瞻性、非干预性、多中心的真实世界临床研究正在进行,以检验其效度、信度和反应度。
(2)溶瘤病毒在脑胶质瘤治疗中的研究进展
脑胶质瘤作为最常见的颅内原发恶性肿瘤,是原发性脑肿瘤死亡的主要原因。而胶质母细胞瘤(Glioblastoma, GBM)是其中恶性程度最高、预后最差的一种类型,手术切除加术后放化疗的中位总生存期(Overall Survival, OS)仅为14个月,5年生存率仍不足5%。随着贝伐珠单抗以及电场治疗的应用,给GBM患者带来了一定的获益,但总体生存期仍较短。针对脑胶质瘤,各种临床前和临床试验正在不断探索新的治疗方法。2021年,日本加速批准了基于单纯疱疹病毒1型的溶瘤病毒G47Δ,用以治疗恶性脑胶质瘤,这为脑胶质瘤的临床治疗带来了新的模式。本文将对溶瘤病毒的主要临床试验结果和面临的问题进行梳理。
溶瘤病毒治疗,通常使用经过改造的病毒或野生型病毒,利用不同的给药方式进入体内。通过对病毒基因进行改造和利用肿瘤细胞本身的特征,可使病毒在肿瘤细胞内进行选择性复制。溶瘤病毒的抗肿瘤效应分为直接效应和间接效应。直接效应表现为肿瘤细胞内先天性免疫反应的激活,病毒在肿瘤细胞内大量复制,最终导致肿瘤细胞裂解死亡。肿瘤细胞裂解后,释放出肿瘤相关抗原、病原体相关分子模式(Pathogen-associated Molecular Patterns, PAMPs)和细胞危险相关分子模式信号(cellular danger-associated molecular pattern signals, DAMPs),诱导机体产生对肿瘤的适应性免疫反应,使得未感染病毒的肿瘤细胞也被识别,从而减轻肿瘤负荷、重建系统对肿瘤的免疫监视,把“冷”肿瘤变“热”肿瘤,而这也是溶瘤病毒治疗与其他免疫疗法结合的理论基础之一。
溶瘤病毒有多种类型(表2)。溶瘤病毒的自然宿主多为人类,新城疫病毒来自鸟类,细小病毒来自鼠类。DNA病毒主要包括疱疹病毒、腺病毒和细小病毒,它们一般都在细胞核和细胞质中复制,遗传物质较多且较稳定,更容易进行基因改造。除细小病毒外的DNA病毒,基因组较大,不容易透过血脑屏障,静脉注射给药时有困难。RNA病毒主要包括呼吸道肠道病毒、脊髓灰质炎病毒和新城疫病毒,它们一般都在细胞质中复制,且基因组较小,更容易透过血脑屏障,显示出比DNA病毒更好的溶瘤能力。在实际的临床研究中,应根据安全性和治疗目的选择病毒种类。
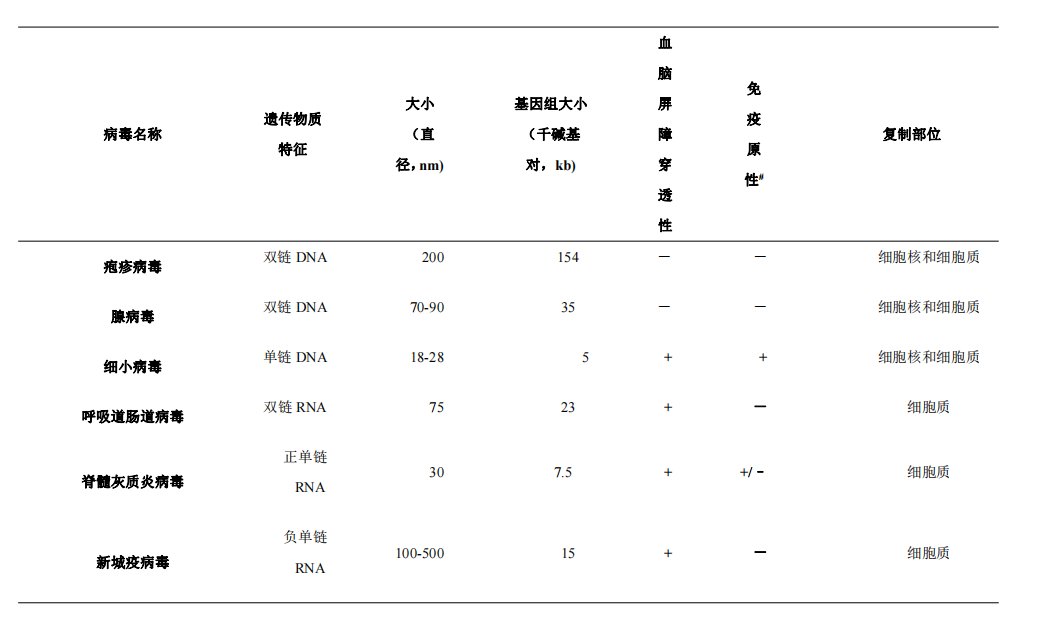 #对比于未暴露者。
#对比于未暴露者。溶瘤病毒治疗脑胶质瘤的临床试验,已有多项研究正在进行或已经完成。本文将重点对单纯疱疹病毒、脊髓灰质炎病毒和腺病毒进行详述。
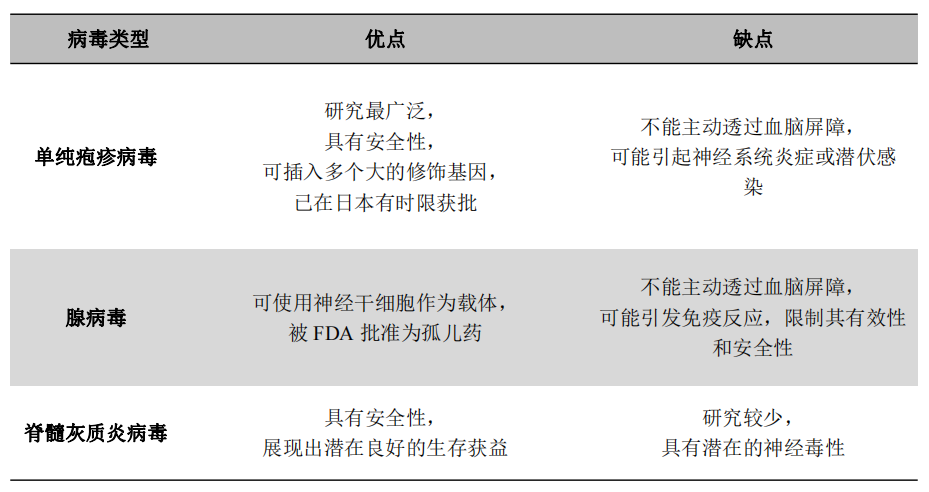
(一)单纯疱疹病毒(herpes simplex virus, HSV-1)
HSV-1是最常用于溶瘤病毒治疗的病毒。早在2015年,表达人粒细胞-巨噬细胞集落刺激因子(granulocyte macrophage colony stimulating factor, GM-CSF)的基因工程病毒HSV-1获批,称为T-VEC,被美国、欧洲和澳大利亚批准用于治疗晚期黑色素瘤。2021年,日本批准HSV-1用于治疗脑胶质瘤。随之,其病毒突变体G47Δ进入临床视野。G47Δ是一种具有γ134.5基因两个拷贝缺失、α47基因缺失和ICP6位点lacZ插入的三突变载体,是第三代HSV-1溶瘤病毒。G47Δ具有前两代病毒的特征,病毒在肿瘤细胞中的复制得到增强。G47Δ中的α47缺失导致病毒在正常细胞中进一步衰减,但增强了抗肿瘤免疫反应的刺激。无论在体内还是体外,G47Δ都比G207表现出更高的细胞杀伤活性和抗肿瘤功效,同时保持了较高的安全性。Tomoki Todo等在2022年发表了G47Δ的一项Ⅱ期临床试验结果,对19例患者分多次立体定向肿瘤内注射G47Δ,每次剂量为1×109 PFU(表3),该试验证明了G47Δ治疗残留或复发性胶质母细胞瘤的有效性和安全性。G47Δ治疗后的1年生存率为84.2%(95%CI,60.4-96.6),中位OS和无进展生存期(Progression-free Survival, PFS)分别为20.2个月和4.7个月,优于其他治疗。作者提出,在病程中更早进行G47Δ治疗,可能会取得更高的疗效,并有可能获得治愈。值得注意的是,所有患者在第一次注射G47Δ后在MRI上几乎立即显示注射部位的造影剂增强,整个增强病灶增大。这种“爆炸坑样”(Explosion Crater-like)现象是G47Δ治疗的胶质母细胞瘤的MRI特征,此前并未在其他溶瘤病毒中观察到。作者推测这很可能反映了活化的淋巴细胞对肿瘤细胞的浸润。
(二)脊髓灰质炎病毒 (Poliovirus)
重组脊髓灰质炎病毒是由非致病性脊髓灰质炎病毒与鼻病毒组成的嵌合体减毒活病毒(表3),它含有人类鼻病毒2型的外源性内部核糖体进入位点(Internal Ribosomal Entry Site, IRES),两者嵌合以后导致病毒基因组无法在宿主神经细胞中表达以及在神经元中繁殖,使得重组脊髓灰质炎病毒不能引发脊髓灰质炎或脑膜/脑脊髓炎。重组脊髓灰质炎病毒除了毒性减弱外,另一个特点就是对CD155的趋向性(CD155是一种普遍表达于恶性实体瘤细胞中的蛋白质),这使重组病毒对肿瘤细胞的选择性大大提高。该嵌合体感染肿瘤后,能够诱导肿瘤细胞凋亡,导致大量免疫细胞的激活,与其他溶瘤病毒作用机制类似。重组脊髓灰质炎病毒的Ⅰ期临床试验结果于2018年发表,该研究纳入了61例复发性WHO IV级恶性脑胶质瘤患者。这些患者通过对流增强给药(Convection Enhanced Delivery, CED),即通过导管将重组脊髓灰质炎病毒以一定压力梯度定向输送到肿瘤内(表3)。患者的生存率在24个月开始达到平台期,24个月和36个月的生存率均为21%(95% CI, 11 - 33个月),61例患者接受治疗后的中位OS为12.5个月(95% CI, 9.9 - 15.2个月)。这一生存数据好于历史预期,但仍需进一步随机对照临床试验验证。3例患者在输注后存活时间超过50个月,分别为:70个月,69个月和57个月。所有接受重组脊髓灰质炎病毒治疗的患者中,69%的患者出现了1级或2级不良事件,19%的患者出现3级或更高级别的病毒治疗相关不良事件。1例患者发生4级颅内出血。这被认为是重组脊髓灰质炎病毒剂量达到1010 TCID50 时的剂量限制毒性。1例发生4级脑水肿和5级癫痫发作,尸检证实这可能与肿瘤进展有关。由于不能判断该类事件与重组脊髓灰质炎病毒之间的因果关系,所以将此事件归因于病毒治疗。该临床试验首次展示了重组脊髓灰质炎病毒治疗脑胶质瘤安全性和有效性,目前进一步的临床试验正在进行。值得一提的是,该试验首次用到较低剂量(7.5 mg/kg,每3周静脉给药一次)的贝伐珠单抗来控制病毒注射后的局部炎症反应,起到了良好的协同作用。
表3. 三种溶瘤病毒治疗脑胶质瘤的临床试验

HSV:单纯疱疹病毒;GBM:多形性胶质母细胞瘤;OS:总生存期;PFS:无进展生存期;PFU:噬菌斑形成单位;TCID50:组织培养感染剂量;CED:对流增强给药;VP: 病毒颗粒。
(三)腺病毒 (Adenovirus)
DNX-2401是第二代溶瘤腺病毒,具有肿瘤选择性和传染性。由于腺病毒E1A基因中24对碱基的缺失,使得病毒无法在正常细胞中复制,但在肿瘤细胞中能完全复制。同时,研究者在纤维H环中插入RGD-4C多肽以增加病毒在肿瘤细胞中的复制能力。DNX-2401通过直接溶瘤和诱导针对肿瘤抗原的免疫反应杀死胶质瘤细胞,导致持续的抗肿瘤免疫。Farshad Nassiri等在2023年发表了DNX-2401的一项Ⅰ/Ⅱ期临床试验结果,该实验纳入了49例复发性GBM患者,对这些患者进行立体定向肿瘤内注射不同剂量的DNX-2401(表3),并在溶瘤病毒治疗后静脉注射抗PD-1抗体帕博利珠单抗(Pembrolizumab)。该试验达到了主要安全性终点,与治疗相关的不良事件最常见的是脑水肿(37%)、头痛(31%)和疲劳(29%),无剂量限制毒性。治疗后中位OS为12.5个月(95% CI, 10.7-13.5个月),12个月生存率为52.7%(95% CI, 40.1%-69.2%),客观缓解率为10.4%(90% CI, 4.2%-20.7%),达到了12个月生存率的次要终点,比客观缓解率更具有临床意义,显示出了良好的生存效益。值得一提的是,这是首次报道溶瘤病毒联合免疫检查点抑制剂治疗脑胶质瘤,并确定了该联合疗法的安全性。在这项试验中,作者发现客观缓解只发生在肿瘤微环境具有中度PD-1表达和中度炎症微环境的患者中,有这些肿瘤微环境特征的患者临床获益率和总生存期也更长。除了直接溶瘤作用外,将病毒注入肿瘤会诱导免疫原性环境,增加T细胞浸润,并改变免疫检查点蛋白的表达。这些探索增加了对治疗反应的潜在生物标记物的理解,表明了患者内在因素和肿瘤因素的变异可能与患者溶瘤病毒治疗预后有关。
表4.不同溶瘤病毒的优缺点
(四)溶瘤病毒治疗脑胶质瘤研究中的问题
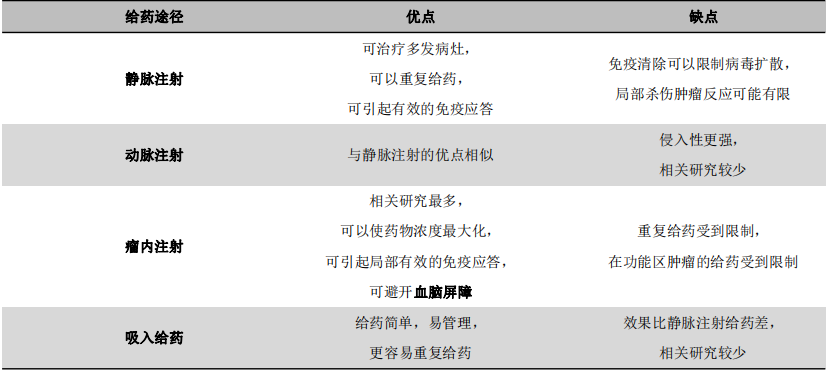
(1)给药途径是否需要开放血脑屏障?
在众多溶瘤病毒治疗脑胶质瘤的研究中,已经尝试了多种给药途径(表5)。主要包括:静脉注射、动脉注射、瘤内注射以及吸入给药。其中,瘤内注射是应用最广泛的给药方式,属于局部给药,可直达肿瘤病灶,不需要开放血脑屏障。而静脉注射、动脉注射和吸入给药等方式都属于全身性给药,需要通过血液循环到达颅内病灶,而是否需要辅助开放血脑屏障,则因病毒种类而异。本身具有血脑屏障穿透性的病毒,如新城疫病毒、细小病毒和呼吸道肠道病毒等,皆具有血脑屏障穿透性,通过直接全身给药便可以到达颅内肿瘤病灶,亦可视为血脑屏障的被动开放。而不具有血脑屏障穿透性的病毒,如单纯疱疹病毒和腺病毒,则需要辅助手段主动开放血脑屏障,如使用甘露醇静滴、聚焦超声和微泡介导的药物递送系统等。然而,在溶瘤病毒治疗胶质瘤的临床试验中,暂未有辅助开放血脑屏障相关方法的应用报道。
(2)病毒是否会自我复制以延续治疗效果?一次给药后,治疗效果可以持续多久?
在本综述中归纳的三种类型的溶瘤病毒(疱疹病毒、腺病毒、脊髓灰质炎病毒),均在临床试验中找到了病毒复制的证据。肿瘤标本的来源包括:溶瘤病毒注射后的手术切除,以及死亡病人的尸检样本。通过对这些样本的检测分析,证明了溶瘤病毒给药以后,病毒会在肿瘤细胞中自我复制,以延续治疗效果。但是,目前尚无可用于预测相关病毒剂量与体内复制潜力和治疗反应的标志物。因此,应在临床前模型和临床试验中,对病毒复制和临床抗肿瘤应答进行深入研究。
表5.不同溶瘤病毒给药途径的优缺点
溶瘤病毒的治疗效果异质性较大,在目前已发表的溶瘤病毒治疗脑胶质瘤的临床研究中,一次给药后治疗效果的持续时间从1个月到7.5年不等。值得一提的是,在一例使用混合病毒治疗(包括新城疫病毒、细小病毒和牛痘病毒)的病例报告中,该复发GBM患者接受了每2-3周一次的静脉注射给药,总用药时间为8年,患者在诊断后14.5年仍然保持良好的生活状态。Chiocca等的一项研究显示,与接受非病毒治疗的患者相比,接受溶瘤病毒治疗的GBM患者的长生存期比率增加,24个月生存率由12%提高至15%,36个月生存率则由6%提升为9%。而大多数长生存期患者往往具有预后的有利因素,如:IDH1/2突变、MGMT启动子甲基化、年轻和良好状态。这一研究在一定程度上解释了溶瘤病毒治疗效果异质性的原因。
(五)溶瘤病毒治疗恶性胶质瘤的挑战及前景
近20年来,溶瘤病毒在脑胶质瘤的治疗研究中取得了令人欣喜的结果。一系列基因工程技术的应用,也使得溶瘤病毒在治疗方面具有更高的特异性、有效性及安全性。越来越多溶瘤病毒研究进入Ⅰ、Ⅱ期甚至Ⅲ期临床试验。
然而,目前溶瘤病毒治疗脑胶质瘤仍存在诸多挑战。首先,是安全性问题。虽然目前已发表的临床试验未报道重大的安全问题,但是仍有脱靶的可能性。此外,基因修饰后的病毒虽然提高了对肿瘤细胞的选择性,但老年人或免疫系统受损的患者仍可能会因此发生病毒感染,并产生严重后果。其次,是给药途径问题。现在,大多数溶瘤病毒在脑胶质瘤的治疗中都以直接瘤内注射的方式局部给药,降低了病毒在非靶细胞复制的风险。但存在出血、感染、深部病变难给药等问题,应不断改进定向引导技术和提高瘤内给药的技术标准。而静脉给药与直接瘤内注射相比具有较大的便利性和安全性,但由于全身血液的稀释、抗体的快速中和以及非靶器官和血脑屏障的隔离,静脉给药的应用被极大地限制。增加静脉注射所用病毒剂量、改进溶瘤病毒载体、利用新型超声打开血脑屏障等方法或许可以提高静脉给药的效果。另一方面,如何提升溶瘤病毒的治疗效果也是重要难题。在溶瘤病毒治疗中应重视对联合疗法的应用以增加抗肿瘤协同作用。溶瘤病毒联合其他治疗(如化疗、放疗、免疫治疗)的策略在多项研究中展现出良好的疗效。尤其是溶瘤病毒联合免疫检查点抑制剂的临床研究进展最快,初步数据表明该联合用药具有应用前景。
总之,提升溶瘤病毒治疗脑胶质瘤的效果,需要进一步优化联合治疗策略,提高病毒的生物利用度,利用辅助手段增强溶瘤病毒的抗肿瘤免疫应答,平衡好机体的抗肿瘤免疫反应和抗病毒免疫反应。另外,探索溶瘤病毒治疗的生物标记物和影像学上的疗效评价标准具有重要意义。生物标记物可以精准指导溶瘤病毒治疗的患者选择及预后预测,并为联合治疗策略提供新思路。建立健全溶瘤病毒治疗后影像学上出现真性进展和假性进展的评价标准,并在大规模队列中进行验证,将有利于溶瘤病毒治疗效果的精准评估。
2.1.2 脊髓肿瘤的新进展
脊髓恶性肿瘤一直是神经外科领域中备受关注的领域,而国内对脊髓肿瘤的研究计划和资助项目也逐渐呈现出全面的发展。近年来,一系列项目在脊髓肿瘤的分子基础研究、治疗策略、康复手段等方面取得了显著进展。
首先,在分子基础方面,自上世纪九十年代初,脊髓恶性肿瘤的研究就受到国家自然科学基金委的关注与资助,中国医科大学团队面上项目《神经母细胞瘤特殊生物学行为--自行消退逆转机理的探索》,揭示了N-myc基因在小儿脊髓神经母细胞瘤自行消退逆转机制中的关键作用。近年来,一系列新的研究项目得到重点资助。四川大学科研团队的青年科学基金项目和国家自然科学基金面上项目提出《基于多模态MRI和基因组学构建“弥漫中线胶质瘤,H3 K27-改变”的分子病理预测体系并探索其癌基因驱动机制的研究》、《结合空间转录组分析探究FAM20C在H3K27M突变型弥漫中线胶质瘤中的机制及临床价值》,旨在通过多组学数据,深入挖掘癌基因驱动机制,揭示了肿瘤发展的内在机制,为个体化治疗提供了理论依据。另外,北京神经外科研究所的面上项目《METTL3通过m6A修饰调控MALAT1/EZH2/NFκB环路参与脊髓胶质瘤原发性化疗抵抗的机制研究》为脊髓胶质瘤原发性化疗抵抗机制提供了转录组修饰介导的新观点。
在治疗策略方面,中国人民解放军第二军医大学《脊髓纳米载药分时控释支架在脊髓胶质瘤治疗中的实验研究》为脊髓胶质瘤治疗开辟了医工结合新的途径。该项目通过纳米支架技术实现精准的药物释放,提高了脊髓交直流的治疗效果。另一方面,清华大学长庚医院《miRNA-34a在髓内星形细胞瘤术中治疗中的应用及作用机制研究》、《术中移植miRNA-34a修饰的脂肪来源干细胞治疗髓内星形细胞瘤的作用及机制研究》通过组织工程技术,探究了髓内星形细胞瘤的小干扰RNA治疗,为克服治疗难题提供了新思路。
此外,康复手段方面,青年科学基金资助的《BMSCs对儿童放射性脊髓炎的治疗作用及部分机制实验研究》项目对儿童脊髓肿瘤放疗后放射性脊髓炎的治疗提供了新的理论依据,为儿童患者的康复提供了希望。
总体而言,国内对脊髓肿瘤已经形成了一个多领域、多角度的研究体系,为深入了解脊髓肿瘤的发病机制、提高治疗效果以及开发新的治疗策略奠定了坚实的基础。这些项目的成果将有望为临床提供更为有效的治疗手段,提升患者的生存质量。
2.1.3 PCNSL的研究进展
1.中国患者原发性中枢神经系统淋巴瘤基因组图谱分析:钱文斌团队描绘中国PCNSLs的遗传图谱,对68个新诊断的中国PCNSL样本进行全基因组测序,并分析其基因组特征和临床病理特征。全面揭示了新诊断的中国PCNSL的基因组图景,从而丰富了目前对PCNSL遗传机制的理解。2.C反应蛋白水平、预后营养指数和乳酸脱氢酶与淋巴细胞比率是原发性中枢神经系统淋巴瘤的重要预后因素:越来越多的证据表明,炎症和营养标志物是决定肿瘤预后的因素。因此,为了确定和验证 PCNSL 的新预后因素。从 223 例 PCNSL 患者中收集临床信息。18岁以下的患者被排除在外。以无进展生存期(PFS)和总生存期(OS)为终点,进行受试者工作特征(ROC)曲线分析,确定炎症指标的临界值。采用单因素和多因素分析评估变量与PFS或OS之间的相关性,并选择阳性指标进行生存分析。预后营养指数(PNI)<49.38与PFS较差相关(P=0.003),PNI≥49.38和<49.38 的患者结局差异显著(P<0.001)。年龄<60岁(P<0.001) 和C反应蛋白(CRP)水平<3.14(P=0.001)与更好的OS相关。在老年患者(≥60岁)中,乳酸脱氢酶与淋巴细胞比值(LLR)<95.69(P=0.021) 与更好的OS相关,并且LLR≥95.69和LLR<95.69 的患者之间的结局差异显著(P=0.015)。PNI和 CRP水平是PCNSL的预后因素,CRP首次被证明是 PCNSL的预后因素。在老年PCNSL患者中,LLR 可以预测预后。3.甲氨蝶呤通路的种系遗传变异与原发性中枢神经系统淋巴瘤患者的药代动力学、结局和毒性相关:基于甲氨蝶呤 (HD-MTX) 的大剂量方案是PCNSL患者的标准治疗方案;然而,MTX在药代动力学和临床结局方面具有广泛的患者间变异性,遗传变异是影响药物反应变异性的重要因素。结果发现ABCB1 rs2032582和GGH rs2305558与MTX的药代动力学密切相关。这些变异可作为生物标志物来预测MTX的药代动力学、临床结果和肝毒性,并有助于 PCNSL 患者的个性化治疗。4.高剂量甲氨蝶呤与替尼泊苷一线诱导化疗治疗新诊断的原发性中枢神经系统淋巴瘤患者:研究纳入了2007年至2016年在中国22个中心新诊断的PCNSL的免疫功能正常的成年患者。患者接受HD-MTX或TEN作为一线诱导治疗。分析每个患者队列的客观缓解率、无进展生存期和总生存期。结论:这是第一项使用TEN作为主要药物与HD-MTX比较新诊断的原发性中枢神经系统淋巴瘤的多中心研究。基于TEN的方案不劣于基于HD-MTX的方案,总体反应相似。
2.1.4 脑转移瘤的研究进展
国内研究项目:1、阿美替尼联合安罗替尼一线治疗NSCLC脑转移的单中心II期研究。其结果在2023年世界肺癌大会(WCLC)上进行了报道。纳入未接受系统治疗的EGFR突变阳性NSCLC脑转移患者,探讨阿美替尼联合安罗替尼治疗EGFR突变阳性NSCLC脑转移患者的有效性及安全性。所有患者均接受阿美替尼(110mg,口服,1次/天)+ 安罗替尼(12mg BSA≥1.6m2、10mg BSA<1.6m2,口服,1次/天,服用2周停1周),直至病情进展或出现不可耐受的毒性反应。主要研究终点是颅内无进展生存期(iPFS)。次要研究终点包括颅内客观缓解率(iORR)、颅内疾病控制率(iDCR)、总体无进展生存期(PFS)、总生存期(OS)、生活质量评分(QOL)。研究结果:截至2023年3月28日,共招募了40例患者,其中39例可进行颅内评估。中位随访时间为8.8个月(3.0个月~30.2个月),中位年龄为61岁,22例为女性。iORR和iDCR分别为74.4%(29/39)和100%(39/39);ORR和DCR分别为62.5%(25/40)和97.5%(39/40)。颅内病变的中位肿瘤缓解深度(DepOR)为42.86%。其中,多发性脑转移患者的iORR为77.4%(24/31),寡转移患者的iORR为62.5%(5/8);伴有脑水肿患者的iORR为86.7%(13/15),不伴有脑水肿患者的iORR为66.7%(16/24)。根据基因类型将所有患者分为两个亚组:19del组的iORR为88.9%(16/18),21L858R组为61.9%(13/21)。此外,还对27例患者进行了NGS检测,在共突变组(TP53、EGFR扩增,MET扩增,PIK3CA、CCND1扩增等),iORR为74.1%(20/27)。TP53突变患者的iORR为77.8%(14/18)。尚未达到中位PFS。安全性方面,总计19例患者(47.5%)出现了任意等级不良事件(AEs),其中仅2例患者出现≥3级AEs,皆为高血压。整体发生率>10%的AEs分别为高血压(20%)、口腔溃疡(17.5%)与皮疹(17.5%)研究结论:阿美替尼联合安罗替尼一线治疗基线存在脑转移的EGFR突变NSCLC患者显示了初步的疗效。而在19del、多发转移、伴有脑水肿亚组中疗效更为突出。共突变患者初步看来也可从该方案中获益,但仍需进一步观察。据悉,这是首个前瞻性探索第三代EGFR-TKI联合安罗替尼治疗基线存在脑转移的NSCLC患者的研究报告。未来研究将继续入组并探索更多数据。2、卡瑞利珠单抗联合化疗一线治疗非鳞NSCLC脑转移患者的前瞻性多中心II期研究,于2023年2月在线发表在Journal of Thoracic Oncology杂志上。该纳入既往未接受系统治疗,脑部靶病灶未接受放疗的驱动基因阴性、非鳞非小细胞肺癌脑转移患者,探讨卡瑞利珠单抗联合培美曲塞/卡铂一线治疗的有效性和安全性。符合入排标准的患者接受卡瑞利珠单抗200mg q3w+卡铂 AUC 5+培美曲塞500mg/m2 q3w治疗4个周期后,继续卡瑞利珠单抗200mg q3w+培美曲塞500mg/m2 q3w维持治疗,直至疾病进展、不可耐受的毒性或死亡。主要终点为可评估人群(治疗后有至少一次影像学评估)颅内客观缓解率,次要终点包括PFS, OS和安全性,探索性终点包括生活质量和神经认知功能评估,以及PD-L1表达水平与疗效的相关性。2020年4月至2022年5月,该研究共纳入45例非鳞NSCLC脑转移患者,中位年龄59岁,13例(28.9%)基线有脑转移症状。截至2022年8月30日,中位随访时间12.5个月,13例患者(28.9%)仍在接受治疗。40例可评估人群中,5例 (12.5%) CR,16例 (40.0%) PR,14例 (35.0%) SD,iORR为52.5%,iDCR为87.5%。颅外ORR为47.5%,颅外DCR为90.0%。该研究为首个PD-1抑制剂联合化疗一线治疗非鳞NSCLC脑转移患者的前瞻性多中心研究,显示出该方案良好的颅内抗肿瘤活性和耐受性,以及对生活质量和认知功能在一定程度上的改善。与既往免疫单药用于肺癌脑转移的研究对比,该研究方案在PD-L1阴性人群同样展示出一定疗效。3、吉非替尼联合化疗对比吉非替尼单药一线治疗EGFR突变NSCLC脑转移的多中心3期随机对照研究,于2023年2月在线发表于JAMA Network Open杂志。该研究以既往未接受治疗的EGFR敏感突变非小细胞肺癌脑转移患者为研究对象,随机分配到EGFR-TKI联合化疗组(接受吉非替尼联合培美曲塞/铂类化疗4-6周期后,吉非替尼联合培美曲塞维持治疗直至疾病进展)和EGFR-TKI组(吉非替尼单药治疗直至疾病进展),以患者的颅内无进展生存期为主要研究终点。2016年1月至2021年8月,161例EGFR突变非小细胞肺癌脑转移患者纳入研究。结果显示,吉非替尼联合化疗组的中位颅内无进展生存期明显高于吉非替尼单药组。事后亚组分析显示,无论EGFR突变类型、脑转移多寡、最大脑转移直径以及是否存在颅外转移,联合治疗的颅内无进展生存期均明显优于TKI单药,在合并TP53突变的患者也存在具有统计学意义的获益。联合治疗组的总体无进展生存期和总生存期也显著高于吉非替尼单药组。该研究是首个在EGFR突变非小细胞肺癌脑转移患者比较TKI联合化疗和单纯TKI的颅内疗效的随机对照研究,结果证实吉非替尼联合化疗较单纯吉非替尼能明显提高EGFR突变肺癌脑转移患者的颅内无进展生存期和总生存期,并且在绝大部分亚组均存在颅内疗效的优势。4、AZD3759一线治疗EGFR突变伴脑/脑膜转移晚期NSCLC患者的多中心单臂2期研究(CTONG1702-Arm 8),于2023年9月在Lancet子刊EClinicalMedicine上发表。AZD3759 是一种新型的 EGFR-TKI,具有显著的 CNS 穿透能力。研究结果显示,在未经治疗的EGFR突变NSCLC患者中,AZD3759 表现出了良好的疗效和可接受的安全性,ORR 为 70%,PFS 和 OS 分别是 12.9 个月和 33.7 个月,最常见的不良反应包括皮疹、腹泻、AST 和 ALT 升高等。特别值得注意的是,200 mg 剂量组相比于 300 mg 剂量组,更为高效低毒:表现在更高的客观反应率(ORR, 80% vs. 60%),更长的无进展生存时间(PFS, 15.8 vs. 10.7 个月),以及更低的不良反应发生率(60% vs. 87%)。这些发现突破了传统的研究模式,为低剂量治疗提供了有力的科学依据。此外,研究还发现,EGFR T790M 突变是 AZD3759 最主要的耐药机制,占到了 59%。在病情进展时出现 EGFR T790M 突变的患者,均接受了奥希替尼作为二线治疗,这一治疗策略与患者总生存期(OS)的显著延长相关(34.1 vs. 25.3 个月)。5、一线AZD3759与吉非替尼/厄洛替尼治疗EGFR突变NSCLC中枢神经系统转移的多中心3期随机对照研究,其结果发布在2023年ASCO年会上。试验共有439名患者参加,所有成年患者以1:1的比例随机接受Zorifertinib (200 mg,BID)或第一代EGFR TKIs(对照组,吉非替尼250 mg/厄洛替尼150 mg,QD)治疗。主要终点是无进展生存期(PFS)。Zorifertinib组的中位PFS明显优于对照组,疾病进展或死亡风险降低28%(9.6个月[95% CI 8.2-9.7] vs. 6.9个月[95% CI 6.3-8.0];HR 0.719,95% CI 0.580-0.893;P=0.0024)。客观缓解率(ORR)在佐利替尼组为68.6%,在对照组为58.4%(P=0.027)。佐利替尼组的中位缓解持续时间(DoR)有延长的趋势(8.2个月 vs. 6.8个月;P=0.0997)。总生存期数据尚不成熟。两组之间任何级别治疗相关不良事件(TRAEs)的发生率相似(97.7% vs 94.0%)。其中3级TRAEs发生率分别为65.9% (Zorifertinib)和18.3%(对照组),主要TRAEs包括皮肤和皮下组织类疾病、胃肠道反应和肝功能异常,并没有出现新的不良安全事件。6、脑部放疗联合吡咯替尼及卡培他滨治疗HER2阳性乳腺癌脑转移的单中心II期研究(BROPTIMA),发布于2023年ASTRO会议。ROPTIMA研究是一项单中心、单臂、Ⅱ期临床研究(NCT04582968)。入组HER2阳性经磁共振成像(MRI)证实的脑转移患者。患者入组后根据方案接受放疗联合吡咯替尼(400 mg,qd)和卡培他滨(1000 mg/m2,bid,d1-14,q3w)治疗。其中放射治疗的方案由研究者根据脑转移灶的大小、数量以及脑实质病变的位置选择全脑放疗(WBRT 30 Gy/10fx)或分次立体定向放疗(FSRT 8 Gy*3-5fx)。吡咯替尼和卡培他滨在放疗第一天至放射治疗疗程结束后7天内开始都是被允许的。研究的主要终点是1年CNS-PFS率,颅内病灶采用RANO-BM评估标准,颅外病灶采用RECIST 1.1评估标准。次要终点包括CNS-ORR、PFS、总生存期(OS)、安全性和认知功能评分。从2020年1月-2022年8月,研究共入组40例患者,包括3例安全导入期的患者。截至2023年2月1日,中位随访时间17.3个月(IQR 10.3-26.9)。主要研究终点一年CNS-PFS率达74.9%(95% CI,61.9-90.7),超过预设,达到主要研究终点。中位CNS-PFS达18.0个月(95% CI,15.5-NA),显示出局部治疗+系统治疗联合方案的惊喜结果。CNS-ORR达85%,分别有17例患者(42.5%)达到完全缓解(CR)和部分缓解(PR)。中位CNS反应时间为3.6个月(IQR 2.5-6.8)。在颅内病灶得到有效控制的同时,吡咯替尼依然展现出对于颅外病灶的有效缓解,整体的中位PFS达到17.6个月(95% CI, 12.8-34.1)。在安全性方面,与放疗的联合治疗并未显著增加吡咯替尼和卡培他滨的不良反应,整体的安全性与既往的研究数据保持一致。在29例接受分次立体定向放疗的患者中,仅4例患者观察到放射性坏死(14%),且均为无症状的放射性坏死,发生比例和程度可接受。28例患者在基线接受了简易精神状态检查表(MMSE)以专门评估神经认知功能,在治疗期间的随访中,大部分患者的神经认知功能保持稳定。表明这一联合治疗方案并不会引起显著的中枢神经系统功能损伤。
脑转移瘤国内研究计划:1、分次立体定向放疗治疗颅内小转移瘤的II期临床研究。中国医学科学院肿瘤医院易俊林/张烨教授团队拟针对<2cm的颅内寡转移瘤,进行6Gy×5f的FSRT,主要研究终点为1年无症状性脑坏死颅内无进展生存率。2、基于迁移学习的肺癌脑转移瘤MRI在线自适应放疗解决方案研究。中国医学科学院肿瘤医院毕楠教授团队拟针对肺癌脑转移瘤基于磁共振加速器及迁移学习的方法,解决在线自适应放疗中勾画准确性及效率的问题。3、危及器官保护和肿瘤同步加量的全脑调强放疗对比立体定向放疗治疗非小细胞肺癌脑转移瘤的前瞻性、随机对照临床研究(ChiCTR2400080236)。中山大学肿瘤防治中心陈媛媛教授团队拟研究海马保护的WBRT对比SRT治疗1-10个NSCLC脑转移,主要研究终点为1年肿瘤局部控制率。4、术前新辅助立体定向放射外科治疗大型脑转移瘤的临床研究(ChiCTR2000038995)。浙江大学医学院附属第一医院童鹰教授团队于国内首批开展术前SRT治疗研究。拟入组30例脑转移瘤术前SRT治疗患者,主要研究终点为1年症状性脑坏死率。5、阿美替尼联合早期介入放疗对比延迟放疗治疗EGFR突变NSCLC脑转移瘤的随机对照研究(NCT05768490)。中山大学肿瘤防治中心陈丽昆教授团队开展了EGFR-TKI与放疗联合治疗时机的随机研究。主要终点为3年总生存。6、斯鲁利单抗联合贝伐单抗及化疗治疗NSCLC脑转移(SUPER BRAIN研究)(NCT05807893)中山大学肿瘤防治中心陈丽昆教授团队开展NSCLC脑转移化靶免联合研究,主要终点为iPFS。7、法莫替尼治疗EGFR突变NSCLC脑转移的单中心2期研究(iFORCE)(NCT05465343)。中国医学科学院肿瘤医院李峻岭教授团队开展了此项研究,拟入组36例患者,主要研究终点为颅内客观缓解率(iORR)和颅内无进展生存率(iPFS)。8、T-DXd联合SRT治疗HER-2阳性乳腺癌脑转移的II期研究(NCT06088056)。复旦大学附属肿瘤医院俞晓立教授团队开展此项单臂II期研究,主要终点为iORR。9、SRS治疗3代EGFR-TKI治疗后颅内寡转移瘤的多中心III期随机对照研究。(NCT06020066)。复旦大学附属肿瘤医院朱正飞教授团队联合国内多中心,拟针对采用3代EGFR-TKI治疗中的脑转移患者加或不加局部SRS放疗,主要终点为2年PFS。10、SHR-A1811治疗HER-2阳性乳腺癌脑转移的研究(NCT05769010)。河南省肿瘤医院闫敏教授团队拟针对HER-2阳性乳腺癌脑转移患者进行SHR-A1811药物联合或部联合其他药物的探索性研究。拟入组100例患者,主要研究终点为iORR。11、阿美替尼加或不加SRT治疗EGFR突变NSCLC脑转移的多中心III期随机对照研究(NCT05800223)。复旦大学附属肿瘤医院樊旼教授团队联合国内多中心开展RCT研究,主要终点为iPFS。12、阿美替尼对比奥希替尼治疗EGFR突变肺癌脑转移(ATTACK研究,NCT04870190)。上海胸科医院陆舜教授牵头多中心3期双盲RCT。拟入组232例患者,主要研究为iPFS。13、卡瑞丽珠单抗联合SRT/WBRT及化疗治疗驱动基因阴性NSCLC脑转移的多中心3期RCT(CTONG2003,NCT04768075)。吴一龙/杨衿记教授团队牵头开展,拟入组200例患者,主要终点为iPFS。
2.3
国内重要研究平台与研究团队
脊柱脊髓肿瘤:北京清华长庚医院王贵怀教授团队:王贵怀教授团队致力于脊髓肿瘤的外科手术及多学科治疗,近年来聚焦于脊髓肿瘤免疫治疗、脊髓肿瘤术中OCT边界识别技术的探索研究并取得可喜成果。北京天坛医院贾文清教授团队:贾文清教授团队致力于肿瘤相关巨噬细胞及微环境层面揭示脊髓恶性肿瘤的相关表征,在弥漫中线胶质瘤的分子特征、室管膜瘤微环境细胞类群和基因表达谱、星形细胞瘤的病理特征等方面获得了较大的进展。上海华山医院车晓明团队:车晓明教授团队致力于微创通道切除髓内肿瘤,脊髓胶质瘤的病理及预后的研究。北京宣武医院菅凤增教授团队:菅凤增教授团队擅长原发性脊髓肿瘤的临床研究,近年来在原发性脊髓星形胶质细胞瘤基因组学研究方面也取得了进展。北京三博脑科医院范涛教授团队:范涛教授团队在脊髓胶质瘤、脊髓星形细胞瘤、脊髓室管膜瘤的分子病理方面有突出的研究成果。北京大学附属第三医院王振宇教授团队:王振宇教授团队擅长脊髓肿瘤的手术显微外科治疗、髓内胶质瘤的临床研究。 解放军医学中心余新光教授团队:余新光教授团队擅长胶质瘤免疫治疗,外泌体的促肿瘤转化,脊髓小细胞星形瘤的临床特征等方面。天津医科大学总医院张建宁教授团队:张建宁教授团队在哑铃型肿瘤的手术策略,脊髓胶质瘤的基因治疗方面研究成果突出。
脑转移瘤:目前,我国参与脑转移研究与治疗的平台和团队主要有中山大学肿瘤防治中心陈丽昆/牟永告教授团队、复旦大学附属肿瘤医院俞晓立/郭小毛/杨昭志教授团队、中国医学科学院肿瘤医院肖建平/易俊林/毕楠/张烨/王洁/李峻岭教授团队、广东省人民医院吴一龙教授团队、山东省肿瘤医院于金明/邢力刚/朱慧教授团队等。
3.国内外研究进展比较
3.1
国际胶质瘤学科发展现状
3.1.1 RANO工作组对胶质瘤切除分类标准、肿瘤组织取样及样本处理标准、治疗反应评价标准的更新
手术切除是胶质瘤治疗的主要方法,最大程度的安全切除一直是胶质瘤手术切除范围(EOR)的标准,但随着胶质瘤进入分子诊断及治疗的时代,基于分子的免疫、靶向等新型治疗方法的不断出现,手术切除的风险与获益需要重新衡量,切除范围应根据分子分型重新决策。
为了便于进行既往临床研究的队列比较分析,RANO工作组根据肿瘤的切除及残留量对手术切除程度制定了统一的分类标准(“活检”、“部分切除”、“次全切除”、“近全切除”、“完全切除 ”和 “超大切除”)。基于这一标准,他们展开了一系列回顾性研究,并最终制定了简化版的RANO切除分类标准(1-4级:“超大CE切除”、“最大CE切除”、“亚最大CE切除”、“活检”),再应用简化版的RANO切除分类标准探讨再切除范围的预后作用。
在肿瘤组织取样及样本处理方面,RANO工作组制定了标准化工作流程,依据术前磁共振影像数据,针对低级别与高级别、新确诊与复发患者,制定了相应的肿瘤样本的取样区域和取样量的建议。
为了提高临床试验中治疗反应评估的可靠性和可比性,在治疗效果评价方面,RANO工作组在原有的RANO-HGG、RANO-LGG、mRANO和iRANO标准的基础上,制定了RANO2.0标准。RANO2.0是适用于2021年WHO的CNS肿瘤分类标准的胶质瘤治疗反应评价标准,其未来可能会将灌注成像、弥散成像、磁共振波谱、氨基酸正电子发射断层扫描以及神经功能评估(NANO)纳入评估体系,RANO2.0也在自动化评估工具开发方面有一定的进展。
3.1.2 手术切除辅助新技术发展与评估
为了在术中区分肿瘤边界,保护患者神经功能。最近的一项多中心倾向得分匹配分析研究(GLIOMAP)进一步证实了清醒开颅手术与术中刺激绘图技术(intraoperative stimulation brain mapping)可以为患者带来更长的PFS、OS和更少的神经功能缺损。
DeepGlioma是一种基于人工智能和受激拉曼组织学(SRH)的手术组织显微成像系统,可以实现对新鲜胶质瘤标本的快速分子筛查(IDH、ATRX突变等)。
利用触觉传感技术,通过组织硬度区分肿瘤组织与周围脑实质。一项动物实验,评估一种带有触觉技术的显微手术钳在通过组织硬度鉴别胶质母细胞瘤、恶性脑膜瘤与正常脑组织的实用性。目前实验数据已成功证明组织硬度可作为显微手术中区分脑肿瘤和正常脑组织的标志物,且脑肿瘤较正常脑组织更硬。
高光谱成像(HSI)和实时快速蒸发电离质谱(REIMS)也是两种新型的术中辅助切除技术。其中,高光谱成像仪与显微镜相结合,可以对胶质瘤与正常脑组织的高光谱数据进行分析和处理,通过二者之间的光谱差异以实现对胶质瘤与正常脑组织的区分。实时快速蒸发电离质谱(REIMS)是将质谱仪与电外科设备相连,利用该系统,获取电切除时产生的气溶胶,通过质谱仪在数秒内间接确定组织的分子特征。目前能够实现较为准确地探测低级别胶质瘤区域。
3.1.3 放疗增敏方案(提高标准治疗疗效)
在过去的15年中,胶质瘤领域进行了1500多项临床研究,但是取得阳性成果的临床试验屈指可数,尤其是胶质母细胞瘤,目前标准治疗方案仍然是同步放化疗联合辅助化疗的STUPP方案,如何进一步提高标准治疗的疗效,是胶质瘤领域研究的热点。
一项随机、开放标签、多中心的Ⅱ期临床试验研究了在新诊断的高级别胶质瘤患者的同步放化疗阶段联合BMX-001用药的效果和安全性。BMX-001是一类具有氧化还原活性的新型小分子,其活性中心模拟超氧化物歧化酶的活性中心,抑制NFKb,既可以作为放疗增敏剂增强放疗对肿瘤的杀伤作用并通过阻断促生存因子和促血管生成因子来抑制肿瘤再生,又可以作为放疗保护剂,通过抑制抑制NFkB和阻断炎症级联反应,保护正常脑组织。这项研究表明,接受BMX-001治疗的患者的中位总生存期延长6.6个月,改善了放疗后的认知功能,可以保护白质束,并且安全性和耐受性良好。FDA已经批准了BMX-001孤儿药、快速通道和突破性认定资格,但同时要求其在更大规模的临床试验中确认结果。
放疗能够通过诱导肿瘤细胞中的DNA双链断裂(DNA DSB)发挥抗肿瘤作用,但细胞的DNA修复(DDR)途径在肿瘤中经常上调,从而导致肿瘤产生对DNA损伤疗法的抗性。
细胞周期调节蛋白(WEE1)激酶抑制剂,该抑制剂可以通过阻断S期和G2/M期的DNA修复途径,允许无DNA修复的有丝分裂,导致有丝分裂灾难和随后的细胞死亡。Debio0123是口服,脑渗透性,高选择性,小分子WEE1抑制剂;在临床前试验中,显示其可以有效穿透大脑,并与WEE1靶点结合;在体外试验和小鼠模型中,与TMZ和/或RT联合显示疗效,但其可靠性仍有待验证。
Peposertib(M3814)是一种口服、小分子、选择性DNA依赖性蛋白激酶(DNA-PK)抑制剂,阻断DNA-PK 活性,抑制其在DNA 修复过程中的作用,导致DNA DSB 持续存在和随后的细胞死亡。在Ⅰ期试验中,Peposertib(M3814)联合RT显示了有利的安全性数据,并且可能增强了RT的敏感性。
3.1.4 靶向治疗进展
随着胶质瘤的分子定义越来越明确,胶质瘤治疗越来越朝着靶向分子通路的方向发展,目前,已经完成的和进行着的临床试验和实验室研究中,研究最多的靶向治疗方向分别是蛋白酶激通路、血管生成/微环境通路以及细胞周期通路等。
靶向人滋养细胞表面糖蛋白抗原2(Trop-2)的抗体偶联药物戈沙妥珠单抗(SG),一项前瞻性、单中心、机会窗试验(NCT03995706)验证了戈沙妥珠单抗(SG)递送细胞毒性药物SN-38(伊立替康的活性代谢物)的有效性和耐受性。试验表明,在复发胶质母细胞瘤的患者中,戈沙妥珠单抗(SG)具有良好的耐受性,能充分渗透到颅内肿瘤中,并在中枢神经系统中显示出初步的活性。
靶向白细胞介素-4(IL-4)受体的靶向毒素Bizaxofusp(MDNA55),一项临床研究采用对流增强给药技术(CED),向初次诊断或复发的且未行手术治疗的胶质母细胞瘤患者瘤内和瘤周输注MDNA55,与历史标准治疗(OS=6-9个月)或利用倾向评分平衡的外部对照组ECA(OS=7.2个月)相比,接受单剂MDNA55治疗患者的中位OS为12.4个月,且试验组无系统性或临床显著实验室异常报告,该药物目前已被FDA批准进行3期临床研究。
靶向趋化因子CXCL12的核酸适配体药物olaptesed pegol (NOX-A12),Gloria试验是一项针对治疗新诊断的MGMT启动子非甲基化的未完全切除的胶质母细胞瘤患者的I/II期试验,NOX-A12是一种静脉给药的的聚乙二醇化的核酸适配体药物,能够靶向趋化因子CXCL-12,通过阻断CXCL-12来抑制血管形成,阻止肿瘤修复。在一项关于NOX-A12与放疗和贝伐珠单抗联用的中期分析中,其治疗效果和安全得到了验证。
表皮生长因子受体(EGFR)抑制剂尼妥珠单抗,尼妥珠单抗的一项Ⅱ期研究表示该药物可使进展期DIPG儿童患者获益,一项由中国专家发起的单臂、前瞻性、多中心研究的Ⅲ期临床研究,来评估尼妥珠单抗联合同步放化疗治疗新诊断儿童弥漫性内生型脑桥胶质瘤 DIPG患者的疗效和安全性,该研究表明尼妥珠单抗联合同步放化疗治疗新诊断儿童弥漫性内生型脑桥胶质瘤患者具有生存获益,且耐受性良好。
E3泛素连接酶(MDM2)抑制剂KRT-232,其采用阻断MDM2-p53相互作用来恢复恢复p53功能的治疗策略。在机会窗试验中显示出血脑屏障渗透,并激活p53通路,其联合TMZ治疗可以提高GBM患者衍生模型中的细胞死亡率。
拉罗替尼是具有中枢活性的高选择性神经营养酪氨酸受体激酶(NTRK)抑制剂,目前在成人或儿童非中枢神经系统肿瘤中显示疗效,并已在48个国家批准上市。但由于NTRK融合的罕见性和迄今为止接受治疗的患者数量相对较少(NTRK基因融合的发生率在成人原发脑肿瘤中为1%,在儿童HGG中为5.3%,在儿童LGG中为2.5%),其安全性仍有待验证。
3.1.5 免疫治疗进展
一般认为,脑肿瘤微环境所呈现出免疫抑制状态,即胶质瘤组织中浸润T细胞数量较少,T细胞功能也常常处于耗竭状态。因此,胶质瘤的免疫治疗效果不佳,目前主要的研究方向是自体γ-δT细胞疗法、免疫激活疗法、自杀基因疗法。
γ-δT细胞是一种固有免疫细胞,通过识别癌细胞表达的自然杀伤细胞D组配体(NKG2D-L)直接识别和杀伤恶性组织。但是,烷化剂化疗(如,替莫唑胺)可以上调NKG2D-L的表达,并增强肿瘤细胞对γ-δT细胞介导杀伤的易感性(对甲基鸟嘌呤-DNA甲基转移酶(MGMT)非甲基化的GBM细胞也是如此)。IN8bio公司的DeltEx耐药免疫疗法(DRl),用MGMT化疗耐药基因对γ-δT细胞进行遗传修饰,保护γ-δT细胞免受烷化剂化疗的损伤。初步研究显示DRl γ-δ T细胞可为治疗GBM提供选择,并被FDA认定为孤儿药。目前,验证自体和同种异体DRl γ-δT细胞治疗新诊断和复发性胶质母细胞瘤的疗效安全性和疗效的Ⅰb/Ⅱ期临床研究正在进行。
IGV-001是一种细胞免疫疗法联合药物产品,从切除的GBM肿瘤组织中分离出肿瘤细胞,与针对胰岛素样生长因子1型受体(IGF-1R)设计的反义核苷酸lMV-001(一种单链18聚体反义寡核苷酸,对应于lGF-1R编码序列的起始蛋氨酸密码子下游的6个密码子)共同孵育后灌装入生物扩散室,植入腹部一段时间后取出。lGV-001将通过下调IGF-IR功能来抑制肿瘤活性,这种方法已在临床前研究中得到验证,Ⅰb期临床研究(NCT02507583)的数据表明lGV-001对新诊断胶质母细胞瘤患者的获益和耐受性以及中性粒细胞与淋巴细胞比值(NLR)可以作为良好结局的潜在标志。一项正在进行的Ⅱb期随机、多中心、双盲、安慰剂对照研究将进一步评估IGV-001在新诊断胶质母细胞瘤患者中的安全性和疗效。
自杀基因疗法是通过表达一种酶,将无毒化合物转化为活性有毒化合物,从而导致转染的细胞死亡。这种方法只对正在复制的细胞(即肿瘤细胞)具有杀伤力,而不会伤害非分裂的脑细胞。目前有利用腺病毒载体和基于间充质干细胞的两项自杀基因疗法的研究在进行。
一项高级别胶质瘤I期研究(NCT01811992)是将表达单纯疱疹病毒胸苷激酶(HSV1-TK)和Fms相关酪氨酸激酶3配体(Flt3l)的腺病毒载体注入手术切除后的肿瘤腔,并在随后接受伐昔洛韦治疗和标准的放化疗。在这项研究中,观察到腺病毒载体在患者体内持续感染并长期留存的现象,其介导的转基因表达HSV1-TK可持续长达29.1个月,即便是复发的肿瘤(治疗后17个月)中,也能发现HSV1-TK mRNA的存在。在此期间治疗耐受性良好,没有观察到剂量限制性毒性,而且没有达到它的最大耐受剂量。
另一项自杀式基因疗法是利用基因工程技术使间充质干细胞表达编码非人类胞嘧啶脱氨酶(CD)的自杀基因,并利用这个酶将口服的抗真菌药物5-氟胞嘧啶(5-FC)脱氨基为抗肿瘤药物5-氟尿嘧啶(5-FU),从而实现对肿瘤细胞的杀伤效果。一项单臂、开放标签、研究者发起的Ⅰ/Ⅱa期临床试验,以研究间充质干细胞(MSC11FCD)在复发性胶质母细胞瘤(rGBM)患者中的最大耐受剂量、安全性和疗效。其结果表明,该基因工程改造的间充质干细胞(MSC11FCD)治疗复发性胶母患者是安全有效的。
3.1.6 免疫检查点抑制剂联合治疗进展
近些年来,多个免疫治疗三期临床试验相继失败,多样化的免疫联合治疗方案可能是更具前景的探索方向。分别介绍溶瘤病毒、靶向治疗方案和治疗性疫苗与免疫检查点抑制剂联合应用的治疗方案。
DNX-2401是一种溶瘤腺病毒,其不能在正常细胞中复制,但在肿瘤细胞中具有复制能力,能够通过整合素进入到肿瘤细胞中;在临床前模型中,DNX-2401通过直接溶瘤和诱导针对肿瘤抗原的免疫反应杀死胶质瘤细胞,从而导致持续的抗肿瘤免疫和肿瘤消退。相关的Ⅰ期研究显示,DNX-2401可诱导肿瘤细胞死亡并激活复发性胶质母细胞瘤免疫反应。一项开放标签、多中心的Ⅰ/Ⅱ期的临床试验(KEYNOTE-192)评价DNX-2401联合帕博利珠单抗治疗复发性胶质母细胞瘤的安全性和客观缓解率(ORR),相关数据表明DNX-2401给药后静脉注射帕博利珠单抗耐受性良好,当肿瘤免疫微环境处于中度肿瘤突变负荷(TMB)且PD-1表达升高时,患者的客观缓解率及生存获益较高。
卡博替尼是一种口服酪氨酸激酶抑制剂,能够调节骨髓细胞群,克服抗PD-1/PD-L1治疗的耐药,将其与PD-L1/PD-1抑制剂(阿替利珠单抗)联合用药,可能产生协同作用。一项针对接受过放疗和TMZ化疗、但未接受抗血管生成治疗的复发性胶质母细胞瘤患者的I/II期研究评估了阿替利珠单抗联合卡博替尼治疗的疗效和安全性,将Ⅰ期研究结果与历史数据对照表明:与卡博替尼单药治疗相比,阿替利珠单抗联合卡博替尼可以改善患者PFS,且未发现新的安全性信号,目前本试验的II期部分正在进行。
EO2401是由3个微生物来源的抗原组成的多肽疫苗,这些多肽模拟了在胶质母细胞瘤中表达上调的肿瘤相关抗原IL13Ra2、BIRC5和FOXM1,以及辅助CD4+T功能的多肽UCP2。纳武利尤单抗能够促进T细胞扩增和肿瘤浸润,贝伐珠单抗具有抗水肿特性,也可对抗VEGF的免疫抑制作用,两者可被联合使用来治疗复发性胶质母细胞瘤。ROSALIE研究是一项治疗首次复发的胶质母细胞瘤患者的开放标签、多中心的Ⅰ/Ⅱ期临床试验。其试验结果初步检验了EO2401+纳武利尤单抗+/-贝伐珠单抗联合治疗的疗效和安全性,EO2401+纳武利尤单抗针对靶向的肿瘤相关抗原IL13Rα2、BIRC5和FOXM1产生了快速、强效和持久的全身免疫应答,贝伐珠单抗可以克服EO2401+纳武利尤单抗因神经系统症状导致的治疗持续时间较短的缺点,首次复发胶质母细胞瘤患者的中位生存期为14.5个月,18个月生存率为43%,耐受性良好,除增加了局部给药部位反应外,安全性特征与纳武利尤单抗和贝伐珠单抗的安全性特征一致。
3.2
国际脊髓肿瘤学科发展现状
脊髓肿瘤基础研究进展:斯坦福大学Michelle Monje教授团队发现,胶质瘤细胞会利用神经可塑性过程,神经电活动不仅会促进肿瘤的生长,而且还会加强肿瘤与神经系统之间的关系。肿瘤利用神经电信号促进它自身的生长。此项研究提供了开发治疗胶质瘤药物的新思路。此外,脊髓组织与脊髓肿瘤类器官培养、溶瘤病毒(如腺病毒、脊髓灰质炎病毒等)的研究亦取得了一定的进展,这为日后的脊髓肿瘤个体化综合治疗奠定了基础,亦为未来的研究提供了更多的可能性和方向。
3.2.1 脊髓肿瘤免疫治疗进展
德国癌症中心的Sham团队设计一款针对弥漫性中线胶质瘤的一款疫苗。给DMG患者带去免疫治疗的曙光。此外,斯坦福大学教授Crystal L. Mackall团队发现患者来源的H3-K27M突变的胶质瘤细胞培养显示出唾液神经节苷脂2(GD2)均匀高表达,抗GD2-CAR-T细胞在体外表现出强大的对DMG细胞的杀伤作用。同时,浸润性T细胞免疫疗法、DC疫苗、肿瘤免疫微环境的研究均取得一定的突破,然而,目前免疫治疗在脊髓肿瘤领域的应用仍处于探索阶段,还需要更多的临床数据来验证其疗效和安全性。
3.2.2 脊髓肿瘤精准诊疗的进展
剑桥大学儿童脑肿瘤中心的研究人员开发了16种儿童高级别胶质瘤(pHGG)亚型的模型,并用这些模型来识别特定的药物靶点。有望利用这些模型来评估常规放化疗、靶向治疗、免疫疗法等,以确定个性化的组合。此外,脊髓肿瘤的精准手术治疗亦取得进展,术中OCT、术中DCI、术中超声、术前VR等应用,能更好地指导手术决策,提高肿瘤安全前提下全切除率,最大程度提升患者预后。各类不同的手术入路的临床研究亦取得相应的进展,最大程度地缩短患者的术后康复期限。
3.2.3 脊髓肿瘤的靶向治疗进展
芝加哥大学医学院的儿科Carl Koschmann教授团队发表研究证明了小分子靶向新药ONC201对H3K27M-DMG的疗效,成为首个超越放射治疗、改善H3K27M-DMG预后的单一疗法。除此之外,帕比司他目前也已经进入了Ⅱ期临床试验阶段。还有部分药物如BRAF抑制剂、哺乳动物雷帕霉素靶蛋白(mTOR)抑制剂等进入临床试验阶段,在深入探讨肿瘤发生发展分子生物学机制的基础上,开展针对性的转化研究仍是突破胶质瘤治疗“瓶颈”的重要方向。
3.3
国际PCNSL发展现状
国际PCNSL学科的研究方向与国内相似,主要聚焦于新型靶向药物、免疫治疗的应用等。
3.4
国际脑转移瘤发展现状
国际脑转移瘤学科的研究方向与国内相似,主要聚焦于以下几个方面:1、新型靶向药物、免疫治疗与放射治疗联用治疗脑转移瘤;2、术前SRT的研究;3、人工智能(AI) 辅助放射治疗方式及流程优化的研究;4、海马保护WBRT研究;5、小细胞肺癌(SCLC)SRT探索研究等。
随着新型靶点与免疫治疗制剂的不断开发,多种药物均可透过血脑屏障,对脑转移瘤发挥杀伤作用,但依靠单一药物治疗颅内控制时间仍有限,需结合局部放疗。多项研究结果表明,放疗联合靶向、免疫治疗后,放射性脑坏死风险明显增加,故国际学者目前针对联用药物后放疗剂量、范围的调整正在进行研究。
术前SRT为近几年国际上较为关注的话题。多项研究结果提示,脑转移瘤局部切除术后可能增加脑膜播散的概率,因此有学者提出术前SRT的概念,应用放疗对周围组织的辐射作用以期减少术后脑膜播散率及降低放疗毒性。目前已有一些回顾性数据发表,多项前瞻性研究在研。
AI与放疗联用也是当前的研究热点之一。主要研究方向包括:1、基于深度学习进行脑转移瘤及颅内正常结构的自动勾画;2、AI辅助放疗计划优化;3、与磁共振加速器等联合应用,实现在线治疗流程的优化;4、整合多种临床与生物学数据,建立预后预测模型,协助鉴别放射性脑坏死与肿瘤复发等。
海马保护WBRT的概念已经提出多年,2014年的RTOG 0933研究及2020年的NRG Oncology CC001研究奠定了其在脑转移瘤放疗中的地位。但神经认知功能的保护仍为脑转移瘤治疗的重点关注方向,针对海马保护WBRT仍有很多临床研究正在开展,继续探索单/双侧海马保护的差别、全脑放疗剂量调整、海马限量标准等。
小细胞肺癌因其颅内转移率高且多发生多发性脑转移,故既往指南中均推荐WBRT作为初始治疗手段,但随着免疫治疗等新型全身治疗手段在SCLC中应用的进展,SCLC患者存活时间明显延长,且免疫治疗可延长颅内进展时间。因此,不少学者开始在SCLC中探索SRT适应征的扩展。2020年发表的FIRE-SCLC研究分析了1994-2018年治疗的710例SCLC脑转移患者,接受一线SRS对比WBRT,配对后结果发现,SRS与WBRT组中位生存时间SRS组更优,但累计颅内进展发生率也更高。亚组分析中1个,2-4个,5-10个转移瘤总生存与颅内进展率均无统计学差异,但明显优于11个以上转移瘤患者。因此目前国际上有众多研究探索SCLC的SRT治疗对比WBRT。
国际新技术发展现状:质子治疗由于粒子在组织中精确深度沉积剂量的特性,使入射剂量最小化,并几乎没有出射剂量。与传统光子治疗相比,质子治疗大大减少了正常组织的低剂量照射,并允许治疗紧邻关键器官的病灶。因此,质子治疗在中枢神经系统肿瘤及儿童肿瘤中均占据相当重要的地位。然而脑转移瘤质子治疗的相关研究较少,可能是因为既往认为脑转移瘤为姑息治疗,患者整体生存时间短,质子治疗带来的获益有限,而其昂贵的价格限制了其广泛开展。随着脑转移瘤患者整体生存时间的延长及对认知功能要求的提高,以及质子治疗成本的下降,质子治疗在脑转移中的价值应当被充分发掘。
3.5
国际重大研究计划与研究项目
脊柱脊髓肿瘤:脊柱肿瘤因其诊治的复杂性,一直都是全球脊柱外科关注的焦点问题。原发性脊柱肿瘤的总体发生率约为0.4%,原发性良性脊柱肿瘤一般进展慢,病程长,而恶性脊柱肿瘤则进展快,病程短,临床症状出现较快。脊柱恶性肿瘤一直是神经外科领域重点关注的领域。然而对脊柱肿瘤的治疗手段除去手术切除,国际上也在寻找新的突破口。脊索瘤是一种罕见的脊柱恶性肿瘤,有效可用的治疗方法除去手术便是放射治疗。确定可用药物的靶点一直是一个未满足的关键需求。由美国国立卫生研究院提供资金支持,北卡罗莱纳大学进行的项目《Bivalent degraders of the understudied transcription factor TBXT for the rare cancer chordoma 罕见癌症脊索瘤转录因子 TBXT 的二价降解剂》地成功完成将使正在研究的蛋白质brachyury(基因名称 TBXT)成为脊索瘤的药物靶标,并为旨在识别可用于治疗这种毁灭性罕见癌症的蛋白水解靶向嵌合体PROTAC的更大项目奠定基础。放射和手术疗法之外,国际上对脊柱肿瘤的治疗方法也在深入研究和探索。由日本爱媛大学医学部医院提出的《基于氧环境控制的侵袭微环境来源的胶质母细胞瘤干细胞破坏疗法的建立》项目使针对荧光肿瘤细胞的聚焦超声(FUS)治疗装置临床应用的可能性得到关注。由日本金泽大学提出的《建立脊髓肿瘤冷冻解冻坏死治疗的安全性和保护脊髓的措施》项目旨在通过冷冻和解冻组织技术对放射治疗耐药的脊柱肿瘤治疗,建立安全有效的脊柱疾病冷冻消融方法。同时,医共结合,多领域学科共同发展将有助于脊柱肿瘤的诊断。影像技术的进步将对脊柱肿瘤的精准预测提供极大的帮助。由美国国家科学转化促进中心提供资金支持,美国范德比尔特大学医疗中心的提出的《Development of clinically translatable MRI methodologies for the thoracic spinal cord 胸脊髓临床可转化MRI方法的开发》项目旨在通过系统地优化胸脊髓的解剖和扩散 MRI 序列,弥补当前胸段脊髓MRI 覆盖范围的和脑颈脊髓的重大差距,更好地预测和诊治胸段疾病。总体而言,国际上对脊髓肿瘤的治疗手段正字进行着越来越多地技术革新,医工交叉领域地全面崛起也将为脊柱肿瘤的治疗带来翻天覆地的变化,这些项目的成果将有望为临床提供更为有效的治疗手段,提升患者的生存质量。
PCNSL:原发性中枢神经系统淋巴瘤老年患者:美国20个癌症中心的生存和预后。该研究回顾性分析了美国20个学术中心的 539 名年龄在≥60 岁新诊断的 PCNSL 患者。中位年龄为70岁(范围60-88岁);46%的患者至少存在一种老年综合征;累积指数评级量表-老年病学(CIRS-G)评分的中位数为6(范围,0-27);36%的人有日常生活活动障碍(ADL)。最常见的诱导方案是大剂量甲氨蝶呤(HD-MTX)±利妥昔单抗;甲氨蝶呤、替莫唑胺、利妥昔单抗(MTR);和利妥昔单抗、甲氨蝶呤、丙卡巴肼、长春新碱 (R-MPV)。总体而言,70%的患者达到缓解,其中14%的患者接受了巩固的自体干细胞移植(ASCT),24%的患者接受了维持治疗。中位随访58个月时,中位无进展生存期(PFS)和总生存期(OS)分别为17个月(95%CI [13-22个月])和43个月(95%CI [31-56个月])。MTR 组的 3 年 PFS 和 OS 最高(分别为 55% 和 74%)。使用甲氨蝶呤单药±利妥昔单抗组,3 年 PFS 和 OS 分别为 30% (p= .0002) 和 47% (p= .0072)。在多因素分析中,诊断年龄和肿瘤合作组(ECOG)体能状态(PS) 的增加与较差的 PFS 相关;年龄、低白蛋白血症、较高的 CIRS-G 评分和 ECOG PS 对 OS 产生不利影响。在接受维持治疗的患者中,3年PFS为65%和45% (p=0.02),3年OS分别为84%和61% (p=.0003)。总而言之,老年 PCNSL 患者的结局似乎通过 HD-MTX 联合诱导方案和维持治疗得到了优化。此外,一些预后因素,包括老年测量,与较差的结局有关。新诊断的原发性中枢神经系统淋巴瘤患者的脑部放疗:19个法国中心的专业实践评估。随着时间的推移,接受脑放疗的患者数量逐渐减少。放疗方案的异质性很大,其中 55% 的放疗方案在照射剂量和/或放疗量方面不符合已发表的建议。接受减剂量放疗的诱导化疗完全缓解者的比例随着时间的推移而增加。在单因素分析中,部分脑放疗与总生存期显著降低相关。在诱导化疗的部分反应者中,增加脑部总剂量>30 Gy并增加 WBRT 的增强诱导了无进展生存期和总生存期改善的趋势。5例复发 (13%) 仅发生在眼睛中,均发生在眼睛被排除在照射目标体积之外的患者中,包括 2 例诊断时未眼部受累的患者。CD19定向嵌合抗原受体T细胞过继免疫治疗后原发性和继发性中枢神经系统淋巴瘤的神经毒性和治疗。靶向CD19的嵌合抗原受体(CAR)T细胞已被确立为治疗 B 细胞淋巴瘤的领先工程化T细胞疗法;然而,中枢神经系统 (CNS) 受累患者的数据有限。该研究包括17 例原发性中枢神经系统淋巴瘤患者(PCNSL;1 例接受 2 次 CAR T 细胞输注)和 27例继发性中枢神经系统淋巴瘤 (SCNSL) 患者。19/45 次输血后观察到轻度 ICANS(1-2级)(42.2%),7/45 次输血后观察到重度免疫效应细胞相关神经毒性综合征 (ICANS)(3-4级)(15.6%)。在SCNSL中检测到 C 反应蛋白(CRP)水平增加幅度更大,ICANS 发生率更高。早发和基线 C 反应蛋白水平与 ICANS 发生相关。31例(68.9%)出现中枢神经系统缓解,其中18例(40.0%)中枢神经系统疾病完全缓解,中位持续时间为11.4个月±4.5个月。如果需要桥接治疗,使用伊布替尼可转化为良好的中枢神经系统无进展生存期(5vs1 个月,HR 0.28,CI 0.1-0.7:P=.010)。结论: CAR T 细胞在中枢神经系统淋巴瘤中表现出有希望的抗肿瘤作用和良好的安全性。有必要进一步评估桥接方案和皮质类固醇的作用。
脑转移瘤:国际脑转移瘤学科的研究方向与国内相似,主要聚焦于以下几个方面:1、新型靶向药物、免疫治疗与放射治疗联用治疗脑转移瘤;2、术前SRT的研究;3、人工智能(AI) 辅助放射治疗方式及流程优化的研究;4、海马保护WBRT研究;5、小细胞肺癌(SCLC)SRT探索研究等。随着新型靶点与免疫治疗制剂的不断开发,多种药物均可透过血脑屏障,对脑转移瘤发挥杀伤作用,但依靠单一药物治疗颅内控制时间仍有限,需结合局部放疗。多项研究结果表明,放疗联合靶向、免疫治疗后,放射性脑坏死风险明显增加,故国际学者目前针对联用药物后放疗剂量、范围的调整正在进行研究。术前SRT为近几年国际上较为关注的话题。多项研究结果提示,脑转移瘤局部切除术后可能增加脑膜播散的概率,因此有学者提出术前SRT的概念,应用放疗对周围组织的辐射作用以期减少术后脑膜播散率及降低放疗毒性。目前已有一些回顾性数据发表,多项前瞻性研究在研。AI与放疗联用也是当前的研究热点之一。主要研究方向包括:1、基于深度学习进行脑转移瘤及颅内正常结构的自动勾画;2、AI辅助放疗计划优化;3、与磁共振加速器等联合应用,实现在线治疗流程的优化;4、整合多种临床与生物学数据,建立预后预测模型,协助鉴别放射性脑坏死与肿瘤复发等。海马保护WBRT的概念已经提出多年,2014年的RTOG 0933研究及2020年的NRG Oncology CC001研究奠定了其在脑转移瘤放疗中的地位。但神经认知功能的保护仍为脑转移瘤治疗的重点关注方向,针对海马保护WBRT仍有很多临床研究正在开展,继续探索单/双侧海马保护的差别、全脑放疗剂量调整、海马限量标准等。小细胞肺癌因其颅内转移率高且多发生多发性脑转移,故既往指南中均推荐WBRT作为初始治疗手段,但随着免疫治疗等新型全身治疗手段在SCLC中应用的进展,SCLC患者存活时间明显延长,且免疫治疗可延长颅内进展时间。因此,不少学者开始在SCLC中探索SRT适应征的扩展。2020年发表的FIRE-SCLC研究分析了1994-2018年治疗的710例SCLC脑转移患者,接受一线SRS对比WBRT,配对后结果发现,SRS与WBRT组中位生存时间SRS组更优,但累计颅内进展发生率也更高。亚组分析中1个,2-4个,5-10个转移瘤总生存与颅内进展率均无统计学差异,但明显优于11个以上转移瘤患者。因此目前国际上有众多研究探索SCLC的SRT治疗对比WBRT。脑转移瘤国际新技术发展现状:质子治疗由于粒子在组织中精确深度沉积剂量的特性,使入射剂量最小化,并几乎没有出射剂量。与传统光子治疗相比,质子治疗大大减少了正常组织的低剂量照射,并允许治疗紧邻关键器官的病灶。因此,质子治疗在中枢神经系统肿瘤及儿童肿瘤中均占据相当重要的地位。然而脑转移瘤质子治疗的相关研究较少,可能是因为既往认为脑转移瘤为姑息治疗,患者整体生存时间短,质子治疗带来的获益有限,而其昂贵的价格限制了其广泛开展。随着脑转移瘤患者整体生存时间的延长及对认知功能要求的提高,以及质子治疗成本的下降,质子治疗在脑转移中的价值应当被充分发掘。
3.6
我国研究现存优势与不足
3.6.1 胶质瘤
脑胶质瘤虽然是一种罕见肿瘤,但由于我们巨大的人口基数,患者群体庞大。这一方面为我们研究脑胶质瘤的诊疗提供了丰富的临床资源,另一方面,由于地区医疗水平差异,脑胶质瘤患者的标准化诊疗并没有很好的推广普及,严重影响患者预后。此外,目前我国针对脑胶质瘤的诊疗主要以传统手段为主,无法及时更新、使用国际前沿诊疗观念。
3.6.2 脊髓肿瘤
存在的优势:(1)分子基础研究的深入。中国的脊髓肿瘤研究逐渐注重分子水平的深入探索,可以更准确地预测疾病的发展趋势,并制定个性化的治疗方案。目前通过国家自然科学基金等资助,相关研究团队不断揭示了肿瘤发展的内在机制,特别是在癌基因驱动机制和肿瘤细胞生物学行为方面取得了显著进展。例如,针对H3K27M突变型胶质瘤等特定亚型的研究模型的建立和利用,为相关治疗提供了理论依据。(2)多学科交叉融合。脊髓肿瘤研究已涉足多个学科领域,如医学、生物学和工程学等,形成了多学科交叉融合的模式。例如,利用生物材料学修复肿瘤引起的脊髓损伤,通过纳米载药实现药物精准递送;与物理学合作,应用高精度神经活体成像技术识别术中肿瘤血管与边界,提高全切率;与影像组学合作,对患者基因模型进行个体化精准治疗预测分析;与工程学交叉的脊髓电刺激实现瘫痪病人再次行走等。(3)康复手段的创新。康复手段的研究在中国也得到了一定程度的关注。特别是对儿童脊髓肿瘤患者放疗后放射性脊髓炎的治疗,研究团队提出了新的理论依据,为患者的康复提供了希望。
存在的不足:(1)临床转化应用缺乏。虽然分子基础研究取得了一定进展,但临床转化应用相对滞后。目前,尚缺乏足够的临床数据支持新治疗策略的推广和应用,这限制了研究成果的实际效果。需要加强基础研究与临床实践的结合,推动研究成果尽快转化为临床应用,提高治疗效果和患者生存率。(2)人才培养亟待加强。脊髓肿瘤领域的研究需要具备跨学科背景和丰富经验的专业人才,而目前人才培养尚未跟上需求。需要加强相关专业的人才培养和团队建设,以推动领域的长期发展。(3)数据共享和标准化问题。在脊髓肿瘤研究中,我国数据共享和标准化仍然存在一定程度的问题。不同研究团队之间数据的共享和交流不够充分,而且缺乏统一的研究标准和方法,这限制了研究成果的复用和推广。
3.6.3 PCNSL
存在的优势:我国在PCNSL学科上存在的优势主要在于:1、患者群体相对较大,因此开展临床研究入组速度较快;2、很多国产药物疗效及毒性不劣于国外同类型药物,为临床研究的开展提供了丰富的选择,最终为病人带来获益。
存在的不足:1、中国各省市地区医疗资源匹配不均衡,导致PCNSL的治疗模式参差不齐,部分先进技术在基层医院尚未开展,或存在不规范治疗,导致难以开展高质量的多中心临床研究,研究结果难以推广;2、多中心合作与数据共享尚未建立平台,造成数据无法统筹分析,难以形成大样本、多中心的研究。
3.6.4 脑转移瘤
存在的优势:我国在脑转移瘤学科上存在的优势主要在于:1、患者群体庞大,病源充足,因此开展临床研究入组速度较快;2、中国立体定向放疗医保政策不同于国外,可以采用5次以上的分割方式,因此可以探索其他更优的放疗剂量与分割模式;3、很多国产药物疗效及毒性不劣于国外同类型药物,为临床研究的开展提供了丰富的选择,最终为病人带来获益。
存在的不足:1、中国各省市地区医疗资源匹配不均衡,导致脑转移瘤的治疗模式参差不齐,部分先进技术在基层医院尚未开展,或存在不规范治疗,导致难以开展高质量的多中心临床研究,研究结果难以推广;2、患者及临床医生对于脑转移瘤放射性脑坏死的接受度过低,导致整体放疗剂量偏保守,难以与国际数据进行有效对比;3、术前SRT开展困难,入组缓慢,与国外在此方向差距较大;4、多中心合作与数据共享尚未建立平台,造成数据无法统筹分析,难以形成大样本、多中心的研究;5、缺乏中国适用的神经认知功能评价量表,对神经功能方面的随访数据缺乏及评估不足造成研究难以发表在高质量期刊上。
【主编】
朴浩哲 辽宁省肿瘤医院
陈忠平 中山大学肿瘤防治中心
杨学军 北京清华长庚医院
【副主编】
吴劲松 复旦大学附属华山医院
张俊平 首都医科大学三博脑科医院
马 军 北京天坛医院
高献书 北京大学第一医院
【编委】(按姓氏拼音排序)
刘丕楠 北京天坛医院
徐建国 四川大学华西医院
林志雄 福建三博福能脑科医院
王贵怀 北京清华长庚医院
肖建平 中国医学科学院肿瘤医院
张 烨 辽宁省肿瘤医院
陈 一 辽宁省肿瘤医院
马玉超 中国医学科学院肿瘤医院
刘志勇 四川大学华西医院
荆林凯 北京清华长庚医院
陈思源 北京天坛医院
吴赞艺 福建医科大学附属第一医院
参考文献(References)
1.Louis DN, Perry A, Wesseling P, Brat DJ, Cree IA, Figarella-Branger D, et al. The 2021 WHO Classification of Tumors of the Central Nervous System: a summary. Neuro Oncol. 2021;23(8):1231-51.
2.Duffau H. Long-term outcomes after supratotal resection of diffuse low-grade gliomas: a consecutive series with 11-year follow-up. Acta Neurochir (Wien). 2016;158(1):51-8.
3.Hervey-Jumper SL, Berger MS. Maximizing safe resection of low- and high-grade glioma. J Neurooncol. 2016;130(2):269-82.
4.Policicchio D, Ticca S, Dipellegrini G, Doda A, Muggianu G, Boccaletti R. Multimodal Surgical Management of Cerebral Lesions in Motor-Eloquent Areas Combining Intraoperative 3D Ultrasound with Neurophysiological Mapping. J Neurol Surg A Cent Eur Neurosurg. 2021;82(4):344-56.
5.Smith JS, Chang EF, Lamborn KR, Chang SM, Prados MD, Cha S, et al. Role of extent of resection in the long-term outcome of low-grade hemispheric gliomas. J Clin Oncol. 2008;26(8):1338-45.
6.Ceccarelli M, Barthel FP, Malta TM, Sabedot TS, Salama SR, Murray BA, et al. Molecular Profiling Reveals Biologically Discrete Subsets and Pathways of Progression in Diffuse Glioma. Cell. 2016;164(3):550-63.
7.Eckel-Passow JE, Lachance DH, Molinaro AM, Walsh KM, Decker PA, Sicotte H, et al. Glioma Groups Based on 1p/19q, IDH, and TERT Promoter Mutations in Tumors. N Engl J Med. 2015;372(26):2499-508.
8.Hou Z, Zhang K, Liu X, Fang S, Li L, Wang Y, et al. Molecular subtype impacts surgical resection in low-grade gliomas: A Chinese Glioma Genome Atlas database analysis. Cancer Lett. 2021;522:14-21.
9.Delev D, Heiland DH, Franco P, Reinacher P, Mader I, Staszewski O, et al. Surgical management of lower-grade glioma in the spotlight of the 2016 WHO classification system. J Neurooncol. 2019;141(1):223-33.
10.van den Bent MJ, Wefel JS, Schiff D, Taphoorn MJ, Jaeckle K, Junck L, et al. Response assessment in neuro-oncology (a report of the RANO group): assessment of outcome in trials of diffuse low-grade gliomas. Lancet Oncol. 2011;12(6):583-93.
11.Wijnenga MMJ, French PJ, Dubbink HJ, Dinjens WNM, Atmodimedjo PN, Kros JM, et al. The impact of surgery in molecularly defined low-grade glioma: an integrated clinical, radiological, and molecular analysis. Neuro Oncol. 2018;20(1):103-12.
12.Beiko J, Suki D, Hess KR, Fox BD, Cheung V, Cabral M, et al. IDH1 mutant malignant astrocytomas are more amenable to surgical resection and have a survival benefit associated with maximal surgical resection. Neuro Oncol. 2014;16(1):81-91.
13.McGirt MJ, Chaichana KL, Gathinji M, Attenello FJ, Than K, Olivi A, et al. Independent association of extent of resection with survival in patients with malignant brain astrocytoma. J Neurosurg. 2009;110(1):156-62.
14.Molinaro AM, Hervey-Jumper S, Morshed RA, Young J, Han SJ, Chunduru P, et al. Association of Maximal Extent of Resection of Contrast-Enhanced and Non-Contrast-Enhanced Tumor With Survival Within Molecular Subgroups of Patients With Newly Diagnosed Glioblastoma. JAMA Oncol. 2020;6(4):495-503.
15.Wang P, Luo C, Hong PJ, Rui WT, Wu S. The Role of Surgery in IDH-Wild-Type Lower-Grade Gliomas: Threshold at a High Extent of Resection Should be Pursued. Neurosurgery. 2021;88(6):1136-44.
16.Hatoum R, Chen JS, Lavergne P, Shlobin NA, Wang A, Elkaim LM, et al. Extent of Tumor Resection and Survival in Pediatric Patients With High-Grade Gliomas: A Systematic Review and Meta-analysis. JAMA Netw Open. 2022;5(8):e2226551.
17.Patel T, Bander ED, Venn RA, Powell T, Cederquist GY, Schaefer PM, et al. The Role of Extent of Resection in IDH1 Wild-Type or Mutant Low-Grade Gliomas. Neurosurgery. 2018;82(6):808-14.
18.Nelson AJ, Zakaria R, Jenkinson MD, Brodbelt AR. Extent of resection predicts risk of progression in adult pilocytic astrocytoma. Br J Neurosurg. 2019;33(3):343-7.
19.Kanamori M, Kikuchi A, Watanabe M, Shibahara I, Saito R, Yamashita Y, et al. Rapid and sensitive intraoperative detection of mutations in the isocitrate dehydrogenase 1 and 2 genes during surgery for glioma. J Neurosurg. 2014;120(6):1288-97.
20.Ohka F, Yamamichi A, Kurimoto M, Motomura K, Tanahashi K, Suzuki H, et al. A novel all-in-one intraoperative genotyping system for IDH1-mutant glioma. Brain Tumor Pathol. 2017;34(2):91-7.
21.Avsar T, Sursal A, Turan G, Yigit BN, Altunsu D, Cantasir K, et al. Development of a Rapid and Sensitive IDH1/2 Mutation Detection Method for Glial Tumors and a Comparative Mutation Analysis of 236 Glial Tumor Samples. Mol Diagn Ther. 2020;24(3):327-38.
22.Diplas BH, Liu H, Yang R, Hansen LJ, Zachem AL, Zhao F, et al. Sensitive and rapid detection of TERT promoter and IDH mutations in diffuse gliomas. Neuro Oncol. 2019;21(4):440-50.
23.Santagata S, Eberlin LS, Norton I, Calligaris D, Feldman DR, Ide JL, et al. Intraoperative mass spectrometry mapping of an onco-metabolite to guide brain tumor surgery. Proc Natl Acad Sci U S A. 2014;111(30):11121-6.
24.Kanamori M, Maekawa M, Shibahara I, Saito R, Chonan M, Shimada M, et al. Rapid detection of mutation in isocitrate dehydrogenase 1 and 2 genes using mass spectrometry. Brain Tumor Pathol. 2018;35(2):90-6.
25.Pirro V, Alfaro CM, Jarmusch AK, Hattab EM, Cohen-Gadol AA, Cooks RG. Intraoperative assessment of tumor margins during glioma resection by desorption electrospray ionization-mass spectrometry. Proc Natl Acad Sci U S A. 2017;114(26):6700-5.
26.Xu H, Xia YK, Li CJ, Zhang JY, Liu Y, Yi W, et al. Rapid diagnosis of IDH1-mutated gliomas by 2-HG detection with gas chromatography mass spectrometry. Lab Invest. 2019;99(4):588-98.
27.Weller, M.; Wick, W.; Aldape, K.; Brada, M.; Berger, M.; Pfister, S. M.; Nishikawa, R.; Rosenthal, M.; Wen, P. Y.; Stupp, R.; Reifenberger, G. Glioma. Nat. Rev. Dis. Primer 2015, 1 (1), 15017. https://doi.org/10.1038/nrdp.2015.17.
28.Stupp, R.; Weller, M.; Belanger, K.; Bogdahn, U.; Ludwin, S. K.; Lacombe, D.; Mirimanoff, R. O. Radiotherapy plus Concomitant and Adjuvant Temozolomide for Glioblastoma. N. Engl. J. Med. 2005.
29.Molinaro, A. M.; Taylor, J. W.; Wiencke, J. K.; Wrensch, M. R. Genetic and Molecular Epidemiology of Adult Diffuse Glioma. Nat. Rev. Neurol. 2019, 15 (7), 405–417. https://doi.org/10.1038/s41582-019-0220-2.
30.Cohen, M. H.; Shen, Y. L.; Keegan, P.; Pazdur, R. FDA Drug Approval Summary: Bevacizumab (Avastin®) as Treatment of Recurrent Glioblastoma Multiforme. The Oncologist 2009, 14 (11), 1131–1138. https://doi.org/10.1634/theoncologist.2009-0121.
31.Ornelas, A. S.; Porter, A. B.; Sharma, A.; Knox, M. G.; Marks, L. A.; Wingerchuk, D. M.; O’Carroll, C. B. What Is the Role of Tumor-Treating Fields in Newly Diagnosed Glioblastoma? The Neurologist 2019, 24 (2), 71–73. https://doi.org/10.1097/NRL.0000000000000222.
32.Rominiyi, O.; Vanderlinden, A.; Clenton, S. J.; Bridgewater, C.; Al-Tamimi, Y.; Collis, S. J. Tumour Treating Fields Therapy for Glioblastoma: Current Advances and Future Directions. Br. J. Cancer 2021, 124 (4), 697–709. https://doi.org/10.1038/s41416-020-01136-5.
33.Zeng, J.; Li, X.; Sander, M.; Zhang, H.; Yan, G.; Lin, Y. Oncolytic Viro-Immunotherapy: An Emerging Option in the Treatment of Gliomas. Front. Immunol. 2021, 12, 721830. https://doi.org/10.3389/fimmu.2021.721830.
34.Todo, T.; Ito, H.; Ino, Y.; Ohtsu, H.; Ota, Y.; Shibahara, J.; Tanaka, M. Intratumoral Oncolytic Herpes Virus G47? for Residual or Recurrent Glioblastoma: A Phase 2 Trial. Nat. Med. 2022, 28 (8), 1630–1639. https://doi.org/10.1038/s41591-022-01897-x.
35.Tian, Y.; Xie, D.; Yang, L. Engineering Strategies to Enhance Oncolytic Viruses in Cancer Immunotherapy. Signal Transduct. Target. Ther. 2022, 7 (1), 117. https://doi.org/10.1038/s41392-022-00951-x.
36.Fudaba, H.; Wakimoto, H. Oncolytic Virus Therapy for Malignant Gliomas: Entering the New Era. Expert Opin. Biol. Ther. 2023, 23 (3), 269–282. https://doi.org/10.1080/14712598.2023.2184256.
37.Maroun, J.; Muñoz-Alía, M.; Ammayappan, A.; Schulze, A.; Peng, K.-W.; Russell, S. Designing and Building Oncolytic Viruses. Future Virol. 2017, 12 (4), 193–213. https://doi.org/10.2217/fvl-2016-0129.
38.Stojdl, D. F.; Lichty, B.; Knowles, S.; Marius, R.; Atkins, H.; Sonenberg, N.; Bell, J. C. Exploiting Tumor-Specific Defects in the Interferon Pathway with a Previously Unknown Oncolytic Virus. Nat. Med. 2000, 6 (7), 821–825. https://doi.org/10.1038/77558.
39.Strong, J. E. The Molecular Basis of Viral Oncolysis: Usurpation of the Ras Signaling Pathway by Reovirus. EMBO J. 1998, 17 (12), 3351–3362. https://doi.org/10.1093/emboj/17.12.3351.
40.Chandramohan, V.; Bryant, J. D.; Piao, H.; Keir, S. T.; Lipp, E. S.; Lefaivre, M.; Perkinson, K.; Bigner, D. D.; Gromeier, M.; McLendon, R. E. Validation of an Immunohistochemistry Assay for Detection of CD155, the Poliovirus Receptor, in Malignant Gliomas. Arch. Pathol. Lab. Med. 2017, 141 (12), 1697–1704. https://doi.org/10.5858/arpa.2016-0580-OA.
41.Kaufman, H. L.; Kohlhapp, F. J.; Zloza, A. Oncolytic Viruses: A New Class of Immunotherapy Drugs. Nat. Rev. Drug Discov. 2015, 14 (9), 642–662. https://doi.org/10.1038/nrd4663.
42.Elde, N. C.; Child, S. J.; Geballe, A. P.; Malik, H. S. Protein Kinase R Reveals an Evolutionary Model for Defeating Viral Mimicry. Nature 2009, 457 (7228), 485–489. https://doi.org/10.1038/nature07529.
43.Zamarin, D.; Holmgaard, R. B.; Subudhi, S. K.; Park, J. S.; Mansour, M.; Palese, P.; Merghoub, T.; Wolchok, J. D.; Allison, J. P. Localized Oncolytic Virotherapy Overcomes Systemic Tumor Resistance to Immune Checkpoint Blockade Immunotherapy. Sci. Transl. Med. 2014, 6 (226). https://doi.org/10.1126/scitranslmed.3008095.
44.De Graaf, J. F.; De Vor, L.; Fouchier, R. A. M.; Van Den Hoogen, B. G. Armed Oncolytic Viruses: A Kick-Start for Anti-Tumor Immunity. Cytokine Growth Factor Rev. 2018, 41, 28–39. https://doi.org/10.1016/j.cytogfr.2018.03.006.
45.Carpenter, A. B.; Carpenter, A. M.; Aiken, R.; Hanft, S. Oncolytic Virus in Gliomas: A Review of Human Clinical Investigations. Ann. Oncol. 2021, 32 (8), 968–982. https://doi.org/10.1016/j.annonc.2021.03.197.
46.Lauer, U. M.; Beil, J. Oncolytic Viruses: Challenges and Considerations in an Evolving Clinical Landscape. Future Oncol. Lond. Engl. 2022. https://doi.org/10.2217/fon-2022-0440.
47.Masemann, D.; Boergeling, Y.; Ludwig, S. Employing RNA Viruses to Fight Cancer: Novel Insights into Oncolytic Virotherapy. Biol. Chem. 2017, 398 (8), 891–909. https://doi.org/10.1515/hsz-2017-0103.
48.Durham, N. M.; Mulgrew, K.; McGlinchey, K.; Monks, N. R.; Ji, H.; Herbst, R.; Suzich, J.; Hammond, S. A.; Kelly, E. J. Oncolytic VSV Primes Differential Responses to Immuno-Oncology Therapy. Mol. Ther. J. Am. Soc. Gene Ther. 2017, 25 (8), 1917–1932. https://doi.org/10.1016/j.ymthe.2017.05.006.
49.Rehman, H.; Silk, A. W.; Kane, M. P.; Kaufman, H. L. Into the Clinic: Talimogene Laherparepvec (T-VEC), a First-in-Class Intratumoral Oncolytic Viral Therapy. J. Immunother. Cancer 2016, 4 (1), 53. https://doi.org/10.1186/s40425-016-0158-5.
50.Andtbacka, R. H. I.; Kaufman, H. L.; Collichio, F.; Amatruda, T.; Senzer, N.; Chesney, J.; Delman, K. A.; Spitler, L. E.; Puzanov, I.; Agarwala, S. S.; Milhem, M.; Cranmer, L.; Curti, B.; Lewis, K.; Ross, M.; Guthrie, T.; Linette, G. P.; Daniels, G. A.; Harrington, K.; Middleton, M. R.; Miller, W. H.; Zager, J. S.; Ye, Y.; Yao, B.; Li, A.; Doleman, S.; VanderWalde, A.; Gansert, J.; Coffin, R. S. Talimogene Laherparepvec Improves Durable Response Rate in Patients With Advanced Melanoma. J. Clin. Oncol. 2015, 33 (25), 2780–2788. https://doi.org/10.1200/JCO.2014.58.3377.
51.He, B.; Chou, J.; Brandimarti, R.; Mohr, I.; Gluzman, Y.; Roizman, B. Suppression of the Phenotype of Gamma(1)34.5- Herpes Simplex Virus 1: Failure of Activated RNA-Dependent Protein Kinase to Shut off Protein Synthesis Is Associated with a Deletion in the Domain of the Alpha47 Gene. J. Virol. 1997, 71 (8), 6049–6054. https://doi.org/10.1128/jvi.71.8.6049-6054.1997.
52.York, I. A.; Roop, C.; Andrews, D. W.; Riddell, S. R.; Graham, F. L.; Johnson, D. C. A Cytosolic Herpes Simplex Virus Protein Inhibits Antigen Presentation to CD8+ T Lymphocytes. Cell 1994, 77 (4), 525–535. https://doi.org/10.1016/0092-8674(94)90215-1.
53.Todo, T.; Martuza, R. L.; Rabkin, S. D.; Johnson, P. A. Oncolytic Herpes Simplex Virus Vector with Enhanced MHC Class I Presentation and Tumor Cell Killing. Proc. Natl. Acad. Sci. 2001, 98 (11), 6396–6401. https://doi.org/10.1073/pnas.101136398.
54.Kolte, D. Understanding the Association between Hypertensive Disorders of Pregnancy and Peripartum Cardiomyopathy: Understanding the Association between Hypertensive Disorders of Pregnancy and Peripartum Cardiomyopathy. Eur. J. Heart Fail. 2017, 19 (12), 1721–1722. https://doi.org/10.1002/ejhf.941.
55.Gromeier, M.; Alexander, L.; Wimmer, E. Internal Ribosomal Entry Site Substitution Eliminates Neurovirulence in Intergeneric Poliovirus Recombinants. Proc. Natl. Acad. Sci. 1996, 93 (6), 2370–2375. https://doi.org/10.1073/pnas.93.6.2370.
56.Gromeier, M.; Nair, S. K. Recombinant Poliovirus for Cancer Immunotherapy. 2017.
57.Merrill, M. K.; Dobrikova, E. Y.; Gromeier, M. Cell-Type-Specific Repression of Internal Ribosome Entry Site Activity by Double-Stranded RNA-Binding Protein 76. J. Virol. 2006, 80 (7), 3147–3156. https://doi.org/10.1128/JVI.80.7.3147-3156.2006.
58.VENNETI S, KAWAKIBI A R, JI S, et al. Clinical Efficacy of ONC201 in H3K27M-Mutant Diffuse Midline Gliomas Is Driven by Disruption of Integrated Metabolic and Epigenetic Pathways [J]. Cancer Discovery, 2023, 13(11): 2370-2393.
59.MA C, WANG L, SONG D, et al. Multimodal-based machine learning strategy for accurate and non-invasive prediction of intramedullary glioma grade and mutation status of molecular markers: a retrospective study [J]. BMC Medicine, 2023, 21(1):
60.GRASSL N, POSCHKE I, LINDNER K, et al. A H3K27M-targeted vaccine in adults with diffuse midline glioma [J]. Nature Medicine, 2023, 29(10): 2586-2592.
61.OKONECHNIKOV K, CAMGÖZ A, CHAPMAN O, et al. 3D genome mapping identifies subgroup-specific chromosome conformations and tumor-dependency genes in ependymoma [J]. Nature Communications, 2023, 14(1):
62.CHAI R C, YAN H, AN S Y, et al. Genomic profiling and prognostic factors of H3 K27M‐mutant spinal cord diffuse glioma [J]. Brain Pathology, 2023, 33(4):
63.LI X, ANDRUSIVOVA Z, CZARNEWSKI P, et al. Profiling spatiotemporal gene expression of the developing human spinal cord and implications for ependymoma origin [J]. Nature Neuroscience, 2023, 26(5): 891-901.
64.HE B, ZHANG Y X, MENG Z, et al. Optical coherence tomography angiography with adaptive multi-time interval [J]. J Biophotonics, 2023, 16(5):
65.CHENG L, ZHANG F, ZHAO X, et al. Mutational landscape of primary spinal cord astrocytoma [J]. J Pathol, 2023, 260(3): 317-328.
66.KATHRYN R. TAYLOR T B, ALEXA HUI. Glioma synapses recruit mechanisms of adaptive plasticity [J]. Nature, 2023, 623(7986): 366-374.
67.NIKLAS GRASSL L B, KRISTINE JÄHNE. A H3K27M-targeted vaccine in adults with diffuse midline glioma [J]. Nature Medicine, 2023, 29(2586-2592.
68.Asa, S.L., et al., Overview of the 2022 WHO Classification of Pituitary Tumors. Endocr Pathol, 2022. 33(1): p. 6-26.
69.Angelousi, A., et al., Immunotherapy for endocrine tumours: a clinician's perspective. Endocr Relat Cancer, 2024. 31(4).
70.Ilie, M.D., et al., Biological and Therapeutic Implications of the Tumor Microenvironment in Pituitary Adenomas. Endocr Rev, 2023. 44(2): p. 297-311.
71.Dzialach, L., et al., Prolactin-secreting pituitary adenomas: male-specific differences in pathogenesis, clinical presentation and treatment. Front Endocrinol (Lausanne), 2024. 15: p. 1338345.
72.Wang, Z., et al., Clinical application of combination [(11)C]C-methionine and [(13)N]N-ammonia PET/CT in recurrent functional pituitary adenomas with negative MRI or [(18)F]F-FDG PET/CT. BMC Endocr Disord, 2024. 24(1): p. 19.
73.Tritos, N.A., Pituitary adenomas: new insights, new therapeutic targets. Cell Res, 2023. 33(1): p. 3-4.
74.Osawa, I., et al., Utility of contrast-enhanced 3D STIR FLAIR imaging for evaluating pituitary adenomas at 3 Tesla. Eur J Radiol Open, 2023. 11: p. 100500.
75.Zhang, Y., et al., Preoperative volume of the optic chiasm is an easily obtained predictor for visual recovery of pituitary adenoma patients following endoscopic endonasal transsphenoidal surgery: a cohort study. Int J Surg, 2023. 109(4): p. 896-904.
76.Whyte, E., et al., Update on Current Evidence for the Diagnosis and Management of Nonfunctioning Pituitary Neuroendocrine Tumors. Endocrinol Metab (Seoul), 2023. 38(6): p. 631-654.
77.Wu, Z.B., The shift of therapeutic strategy for prolactinomas: surgery as the first-line option. Nat Rev Endocrinol, 2024.
78. 王雪宁,王建平.原发中枢神经系统淋巴瘤诊疗[J].中国血液流变学杂志,2022,32(4):644-653.DOI:10.3969/j.issn.1009-881X.2022.04.035.
79. Yuan X, Yu T, Zhao J, Jiang H, Hao Y, Lei W, Liang Y, Li B, Qian W. Analysis of the genomic landscape of primary central nervous system lymphoma using whole-genome sequencing in Chinese patients. Front Med. 2023 Oct;17(5):889-906. doi: 80.1007/s11684-023-0994-x. Epub 2023 Jul 7. PMID: 37418076.
81. Zuo J, Lei T, Zhong S, Zhou J, Liu R, Wu C, Li S. C-reactive protein levels, the prognostic nutritional index, and the lactate dehydrogenase-to-lymphocyte ratio are important prognostic factors in primary central nervous system lymphoma: a single-center study of 223 patients. Neurosurg Rev. 2023 Dec 19;47(1):17. doi: 10.1007/s10143-023-02248-1. PMID: 38112846; PMCID: PMC10730673.
82. Wu Z, Li Z, Qiu X, Zhong M, Ding T. Germline genetic variations in methotrexate pathway are associated with pharmacokinetics, outcome, and toxicity in patients with primary central nervous system lymphoma. Expert Rev Clin Pharmacol. 2023 Apr;16(4):371-381. doi: 10.1080/17512433.2023.2194630. Epub 2023 Mar 27. PMID: 36946320.
83. Zhong K, Shi Y, Gao Y, Zhang H, Zhang M, Zhang Q, Cen X, Xue M, Qin Y, Zhao Y, Zhang L, Liang R, Wang N, Xie Y, Yang Y, Liu A, Bao H, Wang J, Cao B, Zhang W, Zhang W. First-line induction chemotherapy with high-dose methotrexate versus teniposide in patients with newly diagnosed primary central nervous system lymphoma: a retrospective, multicenter cohort study. BMC Cancer. 2023 Aug 11;23(1):746. doi: 10.1186/s12885-023-11268-5. PMID: 37568079; PMCID: PMC10416388.
84. David KA, Sundaram S, Kim SH, Vaca R, Lin Y, Singer S, Malecek MK, Carter J, Zayac A, Kim MS, Reddy N, Ney D, Habib A, Strouse C, Graber J, Bachanova V, Salman S, Vendiola JA, Hossain N, Tsang M, Major A, Bond DA, Agrawal P, Mier-Hicks A, Torka P, Rajakumar P, Venugopal P, Berg S, Glantz M, Goldlust SA, Folstad M, Kumar P, Ollila TA, Cai J, Spurgeon S, Sieg A, Cleveland J, Chang J, Epperla N, Karmali R, Naik S, Martin P, Smith SM, Rubenstein J, Kahl B, Evens AM. Older patients with primary central nervous system lymphoma: Survival and prognostication across 20 U.S. cancer centers. Am J Hematol. 2023 Jun;98(6):900-912. doi: 10.1002/ajh.26919. Epub 2023 Apr 5. PMID: 36965007.
85. Thomas-Joulié A, Houillier C, Antoni D, Créhange G, Jouglar E, Colin P, Benchalal M, Lang P, Alfonsi M, Hamidou H, Coutte A, Ahrweiller F, Dadoun N, Pointreau Y, Ammarguellat H, Bernier-Chastagner V, Belkacemi Y, Vieillot S, Hoang-Xuan K, Soussain C, Jacob J, Feuvret L. Brain radiotherapy in patients treated for a newly diagnosed primary central nervous system lymphoma: professional practice evaluation in 19 French centers. Acta Oncol. 2023 Jun;62(6):648-656. doi: 10.1080/0284186X.2023.2225146. Epub 2023 Jun 20. PMID: 37338525.
86. Karschnia P, Arrillaga-Romany IC, Eichler A, Forst DA, Gerstner E, Jordan JT, Ly I, Plotkin SR, Wang N, Martinez-Lage M, Winter SF, Tonn JC, Rejeski K, von Baumgarten L, Cahill DP, Nahed BV, Shankar GM, Abramson JS, Barnes JA, El-Jawahri A, Hochberg EP, Johnson PC, Soumerai JD, Takvorian RW, Chen YB, Frigault MJ, Dietrich J. Neurotoxicity and management of primary and secondary central nervous system lymphoma after adoptive immunotherapy with CD19-directed chimeric antigen receptor T-cells. Neuro Oncol. 2023 Dec 8;25(12):2239-2249. doi: 10.1093/neuonc/noad118. PMID: 37402650; PMCID: PMC10708936.
87. J Chen, MC Li, LK Chen, et al. Aumolertinib Plus Anlotinib in Advanced NSCLC with Brain Metastasis: A Single-arm, Phase II Study. 2023 WCLC #OA03
88. Hou X, Zhou CZ, Wu GW, et al. Efficacy, Safety, and Health-Related Quality of Life with Camrelizumab Plus Pemetrexed and Carboplatin as First-Line treatment for Advanced Non-Squamous Non-Small-Cell Lung Cancer with Brain Metastases (CAP-BRAIN): A Multicentre, Open-Label, Single-Arm, Phase 2 Study. Journal of Thoracic Oncology. 2023; 18(6): 769-779.
89. Hou X, Li MC,Wu GW, et al. Gefitinib Plus Chemotherapy vs Gefitinib Alone in Untreated EGFR-MutantNon–Small Cell Lung Cancer in Patients With Brain MetastasesThe GAP BRAIN Open-Label, Randomized, Multicenter, Phase 3 Study. JAMA Network Open. 2023;6(2):e2255050.
90. Liu SYM, Dong XR, Wang Z, et al. Efficacy, safety and dose selection of AZD3759 in patients with untreated EGFR-mutated non-small-cell lung cancer and central nervous system metastases in China (CTONG1702-Arm 8): a multi-center, single-arm, phase 2 trial.EClinicalMedicine.2023;64: 102238.
91. Wu YL, et al. Randomized phase 3 study of first-line AZD3759 (zorifertinib) versus gefitinib or erlotinib in EGFR-mutant (EGFRm+) non–small-cell lung cancer (NSCLC) with central nervous system (CNS) metastasis. 2023 ASCO #9001.
92. Yang Z, Guo X, Yu X, et al. Stereotactic Radiotherapy or Whole Brain Radiotherapy Combined with Pyrotinib and Capecitabine in HER2-Positive Advanced Breast Cancer Patients with Brain Metastases (BROPTIMA): A Prospective, Phase II Single-arm Clinical Study. ASTRO 2023, Abstract#56165.
93. Yang Y, Deng L, Yang YF, et al. Efficacy and Safety of Combined Brain Radiotherapy and Immunotherapy in Non-Small-Cell Lung Cancer With Brain Metastases: A Systematic Review and Meta-Analysis. Clini Lung Cancer, 2021;23(2): 95-107.
94. Cagney DN, Lamba N, Sinha S, et al. Association of Neurosurgical Resection With Development of Pachymeningeal Seeding in Patients With Brain Metastases. JAMA Oncol. 2019;5(5):703-709.
95. Gondi V, Pugh SL, Tome WA, et al: Preservation of memory with conformal avoidance of the hippocampal neural stem-cell compartment during whole-brain radiotherapy for brain metastases (RTOG 0933): A phase II multi-institutional trial. J Clin Oncol. 2014;32: 3810-3816.
96. Brown PD, Gondi V, Pugh S, et al. Hippocampal Avoidance During Whole-Brain Radiotherapy Plus Memantine for Patients With Brain Metastases: Phase III Trial NRG Oncology CC001. J Clin Oncol. 2020;38(10):1019-1029.
97. Higgins KA, Curran WJ, Liu SV, et al. Patterns of Disease Progression after Carboplatin/Etoposide + Atezolizumab in Extensive-Stage Small-Cell Lung Cancer (ES-SCLC). Int J Radiat Oncol Biol Phys. 2020;108(5):1398.
98. Rusthoven CG, Yamamoto M, Bernhardt D, et al. Evaluation of First-line Radiosurgery vs Whole-Brain Radiotherapy for Small Cell Lung Cancer Brain Metastases: The FIRE-SCLC Cohort Study. JAMA Oncol. 2020;6(7):1028-1037.
99. Li BT, Smit EF, Goto Y, et al: Phase II trial of trastuzumab deruxtecan (T-DXd) in patients (Pts) with HER2-mutated (HER2m metastatic non-small cell lung cancer (NSCLC): Registrational data from DESTINY-Lung01. Ann Oncol 33, 2022 (suppl 7; abstr 976P)
100 Goto K, Goto Y, Kubo T, et al. Trastuzumab Deruxtecan in Patients With HER2-Mutant Metastatic Non-Small-Cell Lung Cancer: Primary Results From the Randomized, Phase II DESTINY-Lung02 Trial. J Clin Oncol. 2023.
101. Yu HA, Goto Y, Hayashi H, et al. HERTHENA-Lung01, a Phase II Trial of Patritumab Deruxtecan (HER3-DXd) in Epidermal Growth Factor Receptor-Mutated Non-Small-Cell Lung Cancer After Epidermal Growth Factor Receptor Tyrosine Kinase Inhibitor Therapy and Platinum-Based Chemotherapy. J Clin Oncol. 2023.
102. Planchard D, et al. FLAURA2: safety and CNS outcomes of first-line osimertinib±chemotherapy in EGFRm advanced NSCLC.2023 ESMO. LBA68.
103. Hurvitz SA, et al. A pooled analysis of trastuzumab deruxtecan (T-DXd) in patients (pts) with HER2-positive (HER2+) metastatic breast cancer (mBC) with brain metastases (BMs) from DESTINY-Breast (DB) -01, -02, and -03. ESMO 377O.
104. Prabhu RS, Akinyelu T, Vaslow ZK, et al. Risk Factors for Progression and Toxic Effects After Preoperative Stereotactic Radiosurgery for Patients With Resected Brain Metastases. JAMA oncol. 2023;9(8):1066-1073.
105. McClelland S III, et al. Radiosurgery Dose Reduction for Brain Metastases on Immunotherapy (RADREMI): One-Year Safety and Efficacy Outcomes from a Multicenter Phase I Trial. 2023 ASTRO. Abstract#1256.