中国抗癌协会
立即下载App《中国恶性肿瘤学科发展报告(2023)》——医学伦理学未来展望篇


我国肿瘤临床研究伦理审查的学科发展策略
专业的伦理审查培训和教育
2023年,医学伦理培训和教育取得了显著进展。国家卫生健康委员会发布了一系列政策文件,明确了医疗机构伦理审查委员会成员的培训要求。针对新兴医学技术的应用,伦理规范不断更新,相关部门发布了治理原则和审评要点。同时,政府部门和专业机构共同努力,中国抗癌协会医学伦理学专委会也举办了医学伦理系列培训和教育工作,为医务人员提供了系统化、专业化的培训服务,为抗癌工作提供了坚实的伦理支持。
1.1 开展临床研究伦理培训和教育的政策要求
自2023年2月起,国家卫生健康委员会开始实施《涉及人的生命科学和医学研究伦理审查办法》,对医疗机构的伦理审查委员会成员提出了明确的培训要求。这些要求包括定期接受生命科学和医学研究伦理知识及相关法律法规的培训,以及对相关人员进行生命伦理教育和培训。此外,国家卫生健康委员会医学伦理专家委员会办公室与中国医院协会于2023年6月印发了《涉及人的临床研究伦理审查委员会建设指南(2023版)》,进一步规定了伦理审查委员的培训标准和频率。在2023年9月,科技部等十部门联合印发的《科技伦理审查办法(试行)》中也明确了对科技伦理培训的要求。
1.2 关于开展新兴医学技术研究的伦理培训和教育要点
随着医学技术的发展,新兴技术如基因编辑、大数据分析、人工智能技术在医学研究中的应用带来了新的伦理挑战。为此,伦理审查委员和相关从业人员需加强对这些新兴医疗技术临床研究的伦理规范培训和教育。
1.3 关于加强临床伦理培训和教育内容实用性的策略
为提高伦理决策能力,伦理教育应注重实践应用,采用案例分析、角色扮演等教学方法。同时,建立考核与反馈机制,对教育和培训效果进行评估,并根据反馈不断改进培训内容和方法。此外,培训内容应包括肿瘤生物学、治疗方法等专业知识,以保障对整个项目有全面认识。不同角色的培训对象应接受个性化的培训,如委员应注重伦理审查要点的培训,科技工作者则应加强研究参与者保护等方面的培训。
02
推动跨学科合作
2023年,肿瘤临床研究领域在推动跨学科合作方面取得了显著进展。根据《涉及人的生命科学和医学研究伦理审查办法》和《涉及人的临床研究伦理审查委员会建设指南(2023版)》,国家卫生健康委明确要求伦理审查委员会的成员应具备多学科背景,包括肿瘤学、医学伦理学、法学等领域的专家,以及来自社会的独立委员。伦理审查会议制度进一步完善,允许不同学科背景的委员就研究相关问题进行充分讨论,并积极聘请独立顾问提供专业支持,以确保审查过程的全面性和科学性。同时,中国抗癌协会医学伦理学专委会在推动医学伦理学发展方面发挥了积极作用,为肿瘤临床研究的伦理审查提供了专业指导和支持,推动了跨学科合作的深入开展。
03
制定和推广伦理审查办法指南
2023年,我国在制定和遵循伦理指南方面取得了重要进展。随着生命科学和医学的不断进步以及法律法规的完善,《涉及人的生命科学和医学研究伦理审查办法》、《科技伦理审查办法(试行)》和《CACA技术指南-伦理审查》等一系列伦理指南的发布,为我国肿瘤临床研究伦理审查提供了更为详实的操作指南,推动了该领域的学科发展。
《涉及人的生命科学和医学研究伦理审查办法》的发布标志着我国生命伦理学和医学伦理学的进一步完善。该法规内容更加详实,扩大了管辖范围,增加了多部门协同监管的要求。对利益冲突管理、隐私权保护和数据管理等方面进行了强调,提高了操作性和可执行性。针对委托审查的需求,《办法》为此提供了指引,但仍需要进一步规范和完善。
《科技伦理审查办法(试行)》的发布突出了科技创新活动的伦理审查要求,加强了对重大突发公共事件的应急管理,并推出了科技活动清单管理制度等新举措。这一举措有助于推动科技伦理审查成为规范性力量,促进科技创新活动向着更加规范和良性的方向发展。
此外,中国抗癌协会医学伦理学专委会也在推动医学伦理学的发展方面发挥了积极作用。其牵头发布的《CACA技术指南-伦理审查》为我国肿瘤领域伦理审查提供了全方位的技术指南,突出了评估获益与风险的重要性,并强调了保障研究参与者权益的使命。这一指南的发布对我国肿瘤防控水平的提升具有重要意义。
综上所述,尽管在伦理审查工作中仍面临着一些挑战,但我国肿瘤临床研究伦理审查的学科发展已经取得了重要进展。未来,我们应继续完善伦理指南,规范管理机制,提高伦理审查能力,以推动我国肿瘤临床研究伦理审查工作的不断发展
04
实现肿瘤临床研究伦理审查结果互认
在2023年,中国为促进肿瘤临床研究伦理审查结果的互认迈出了关键一步,建立了肿瘤临床研究伦理审查互认联合体。这一联合体由各省市肿瘤医院和科研机构的伦理审查委员会组成,旨在解决肿瘤临床试验中不同伦理审查机构审查标准和能力的差异问题,促进审查结果的一致性和时效性,从而推动新药研发和国际合作。
该联合体的成立背景是我国对科技伦理治理的不断完善和加强。根据2022年《关于加强科技伦理治理的意见》和2023年10月发布的《科技伦理审查办法(试行)》,我国明确提出要探索建立专业性、区域性科技伦理审查中心,逐步建立科技伦理审查结果互认机制。肿瘤临床研究伦理审查互认联合体的建立正是贯彻落实这一重要方针的具体举措。
肿瘤临床研究伦理审查互认联合体的运作机制主要包括以下几个方面:
(1) 制定统一的伦理审查标准和指南:联合体将制定统一的肿瘤临床研究伦理审查标准和指南,以确保各伦理审查委员会在审查过程中遵循相同的规范和程序。
(2) 加强伦理审查委员会之间的交流与合作:联合体将促进各省市肿瘤医院和科研机构之间的伦理审查委员会之间的交流与合作,共同探讨解决伦理审查中的难题和争议。
(3) 提升审查质量的一致性:通过共享经验和资源,联合体将努力提升各伦理审查委员会的审查质量和水平,确保审查结果的一致性和时效性。
(4) 促进国际合作与跨国试验:联合体将积极促进与国际肿瘤临床研究伦理审查机构的合作,推动跨国试验项目在伦理审查方面的顺利开展。
肿瘤临床研究伦理审查互认联合体的成立标志着我国肿瘤临床研究伦理审查工作迈向了一个新的阶段,将为我国肿瘤临床试验的高效开展、研究参与者权益和安全的保障、国际合作和科学交流的促进等方面带来重要影响和推动作用。
05
拓展可持续的学科发展方向
肿瘤临床研究伦理审查在伦理审查领域具有普遍性和特殊性。其特殊性主要源于肿瘤本身的复杂性和抗肿瘤药物的独特治疗方式,以及参与临床研究的患者迫切期望通过新药挽救生命。因此,肿瘤临床研究伦理审查面临着更高的要求和更大的挑战。
在过去几年,中国的临床研究伦理审查能力已经取得了长足的进步,但仍存在一些问题和不足,如审查委员会的组成不够合理、审查程序不够规范、审查内容不够全面等。
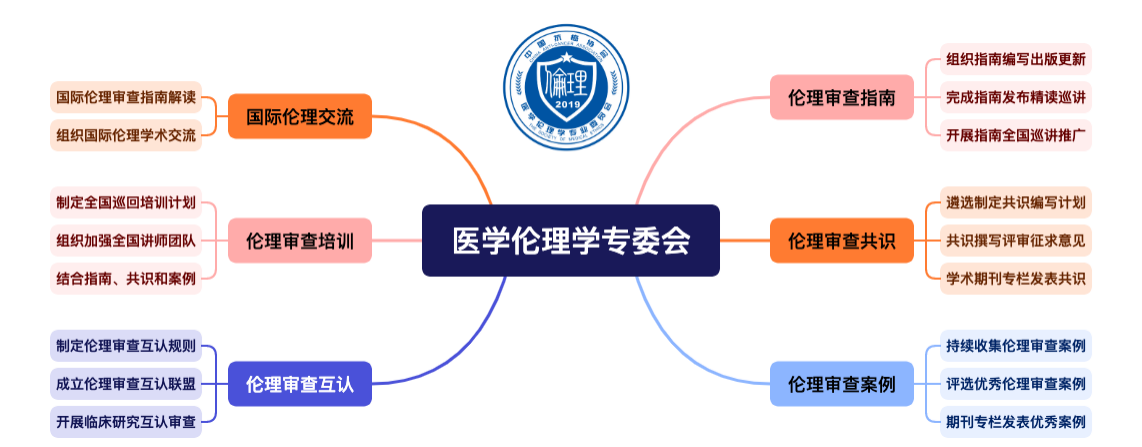
图1 中国抗癌协会医学伦理学专委会工作规划
(1) 多样化的培训与技能提升:伦理从业人员需要不断提升自己的职业素养、知识技能、沟通咨询能力和持续学习与培训能力,以适应行业的发展和变化。
(2) 学术研究与创新支持:鼓励伦理审查从业人员开展临床研究伦理审查相关的学术研究,提高伦理审查专业水平,促进行业的发展。
(3) 知识共享与交流平台:建立有效的知识共享和交流机制,促进从业人员之间的相互学习,加强跨学科、跨机构乃至跨国界的合作,推动行业的进步和发展。
通过以上努力,可以推动肿瘤临床研究伦理审查工作的健康发展,确保研究的伦理性,保障参与者的权益,推动科学研究的持续发展。
06
参与国际合作
我国临床研究伦理审查学科的发展策略应坚决贯彻党中央、国务院的决策部署要求,促进科技向善,前瞻性地评估科技发展可能带来的规则冲突、社会风险和伦理挑战。通过积极参与国际合作,推动我国临床研究伦理审查学科的发展繁荣,提升我国在肿瘤伦理审查学科的国际地位和影响力。
6.1 持续关注国际临床研究伦理审查指南和标准的进展
学科发展应充分关注国际权威机构发布的官方伦理准则,如《世界医学会赫尔辛基宣言》和《涉及人的健康相关研究国际伦理准则》。这些准则是我国临床研究伦理审查学科的基本参考,随着医学技术的发展,这些准则也在不断修订。我们需要持续关注这些标准的发展,并结合不同国家和地区的文化背景和法律法规,采取切实可行的方式保护研究参与者的权益,增进人类福祉。
6.2 打造国际平台,加强学术交流
鼓励临床研究伦理审查学科与国际知名学者和专家进行交流,邀请他们来我国参加学术研讨会和大会。借助中国抗癌协会的学术平台,加强国际学术交流,为临床研究伦理审查工作提供更便捷的沟通渠道。通过多元观点的交流与合作,推动我国临床研究伦理审查学科的跨领域发展。
6.3 依托CACA英文期刊,提升学科国际影响力
利用中国抗癌协会CACA英文期刊《Holistic Integrative Oncology》的平台和影响力,与国际顶尖同行建立联系。鼓励我国临床研究领域的专家在该期刊上发表高质量的学术成果,同时,该期刊也可为临床研究伦理审查专业人士提供学术信息,共享全球最佳实践经验。
6.4 参与国际性研究项目
通过与其他国家和地区的科研机构、防治中心等合作,开展前沿、多学科协作的临床医学研究项目,加强国际经验交流。鼓励我国临床研究者积极参与高质量的国际多中心临床研究项目,促进临床资源的共享与合作研究。结合国内外先进的区域伦理审查模式,探索符合我国国情的伦理审查机制。建立高效的临床研究工作组,开展伦理协作审查,推动临床研究伦理审查学科的研究深度和广度。
【主编】
洪明晃 中山大学附属肿瘤医院
阎 昭 中国抗癌协会
【副主编】
鲍 军 江苏省卫生健康委员会
陈 震 复旦大学附属肿瘤医院
曹 烨 中山大学附属肿瘤医院
范 贞 北京市百瑞律师事务所
李 洁 北京大学肿瘤医院
李 宁 中国医学科学院肿瘤医院
梁茂植 四川大学华西医院
刘云鹏 中国医科大学附属第一医院
刘志敏 云南省肿瘤医院
罗素霞 河南省肿瘤医院
李坤艳 湖南省肿瘤医院
孙 健 中山大学附属肿瘤医院
唐 健 天津医科大学
王贵英 河北医科大学第三医院
王晓稼 浙江省肿瘤医院
周 宏 重庆大学附属肿瘤医院
朱 骥 浙江省肿瘤医院
【编委】(按姓氏拼音排序)
丁 晶 河南省肿瘤医院
韩 珂 中山大学附属肿瘤医院
黄 怡 北京诺诚健华医药科技有限公司
姜 琳 拜耳医药保健有限公司
廖红舞 北京大学肿瘤医院
刘小玲 浙江省肿瘤医院
曲 雁 河北医科大学第三医院
佟建华 中国医科大学附属第一医院
王雨萌 中国抗癌协会
吴大维 中国医学科学院肿瘤医院
徐伟珍 浙江省肿瘤医院
叶联华 云南省肿瘤医院
张玮静 复旦大学附属肿瘤医院
赵 青 江苏省肿瘤医院
参考文献(References)
[1]中华人民共和国卫生部, 《关于临床药理基地工作指导原则》, 1995.
[2]国家药品监督管理局, 《药品临床试验管理规范》, 1999.
[3]全国人大常委会, 《药品管理法》, 2019.
[4]中华人民共和国卫生部, 国家药品监督管理局, 《药物临床试验质量管理规范》, 2003.
[5]中华人民共和国卫生部, 国家药品监督管理局, 《药物临床试验质量管理规范》, 2020.
[6]中华人民共和国卫生部, 国家药品监督管理局, 《医疗器械临床试验质量管理规范》,2022.
[7]国家药品监督管理局, 《药物临床试验伦理审查工作指导原则》, 2010.
[8]国家卫生健康委员会, 《涉及人的生物医学研究伦理审查办法》, 2016.
[9]国家卫生健康委员会, 《涉及人的临床研究伦理审查委员会建设指南》, 2023.
[10]国家卫生健康委员会, 《医疗卫生机构开展临床研究项目管理办法》, 2014.
[11]国家卫生健康委员会, 《医疗卫生机构开展研究者发起的临床研究管理办法》, 2020.
[12]国家科技部等十部委, 《科技伦理审查办法(试行)》, 2023.
[13]刘艺迪;何辉;周刚;美国FDA药物临床试验研发主体合规检查信息公开情况的介绍和启示[J];中国新药杂志;2024年02期.
[14]李长青;张彦彦;姚佩颖;肖瑶;王雪云;高语晨;杨建红;关于国外伦理委员会管理制度研究[J];药学进展;2021年09期.
[15]NMPA. 国家药监局药审中心关于发布 《组织患者参与药物研发的一般考虑指导原则(试行)》的通告 (2022年第46号) [EB/OL]. (2022).
[16]FDA. Patient-Focused Drug Development Guidance: Methods to Identify What is Important to Patients and Select, Develop or Modify Fit-for-Purpose Clinical Outcome Assessments [EB/OL]. (2022).
[17]FDA. Patient-Focused Drug Development: Collecting Comprehensive and Representative Input [EB/OL]. (2020).
[18]FDA. Patient-Focused Drug Development: Selecting, Developing, or Modifying Fit-for-Purpose Clinical Outcome Assessments Guidance for Industry, Food and Drug Administration Staff, and Other Stakeholders [EB/OL]. (2022).
[19]ICH. ICH E8(R1): GENERAL CONSIDERATIONS FOR CLINICAL STUDIES [M].
[20]NMPA. 国家药监局药审中心关于发布《以临床价值为导向的抗肿瘤药物临床研发指导原则》的通告(2021年第46号) [EB/OL]. (2021).
[21]NMPA. 国家药监局药审中心关于发布 《以患者为中心的药物临床试验设计技术指导原则(试行)》《以患者为中心的药物临床试验实施技术指导原则(试行)》《以患者为中心的药物获益-风险评估技术指导原则(试行)》的通告(2023年第44号) [EB/OL]. (2023).
[22]Dawei W, Shuangman M, Huiyao H, et al. Unblinding at disease progression in double-blinded randomized controlled cancer drug clinical trials: A controversy requires more attention [J]. Frontiers in Medicine, 2022, 9.
[23]Hobbs G S, Landrum M B, Arora N K, et al. The role of families in decisions regarding cancer treatments [J]. Cancer, 2015, 121(7): 1079–1087.
[24]洪明晃, 阎昭. 伦理审查-中国肿瘤整合诊治技术指南(CACA)[M].
[25]Zhou H, Yao M, Gu X, et al. Application of Patient-Reported Outcome Measurements in Clinical Trials in China [J]. JAMA Network Open, 2022, 5(5): e2211644.
[26]FDA. Placebos and Blinding in Randomized Controlled Cancer Clinical Trials for Drug and Biological Products Guidance for Industry [EB/OL]. (2019).
[27]李宪辰,康玫,邱燕,等.研究者发起的临床研究中研究参与者个人隐私保护探讨[J].中国医学伦理学, 33(12):1459-1462.
[28]药物临床试验 研究参与者隐私保护广东共识(2020年版).
[29]黄樱硕,张子龙,吴小芳,等.药物临床试验研究参与者隐私保护的有关伦理问题及其研究进展[J].中国医学伦理学, 33(9):1046-1052.
[30]李雪迎,王熙诚,沙若琪,等.真实世界数据研究的信息安全挑战[J].中国食品药品监管, 10(225):46-53.
[31]刘丹,周吉银.临床科研项目研究参与者隐私保护的伦理审查[J].中国医学伦理学,34(10):1306-1310.
[32]科技教育司. 关于印发涉及人的生命科学和医学研究伦理审查办法的通知[EB/OL].(2023-02-27).
[33]中国医院协会. 涉及人的临床研究伦理审查委员会建设指南(2023版)[EB/OL].(2023-06-28).
[34]国家科技部. 科技伦理审查办法(试行)[EB/OL]. (2023-09-07).
[35]巩琦凡,郑晓飞,付汉江.CRISPR基因编辑技术的发展及应用[J].中国生物化学与分子生物学报,2023,39(03):332-340.
[36]孙海波.基因编辑的法哲学辨思[J].比较法研究,2019(06):105-120.
[37]王浩东.基因编辑技术伦理风险的法律治理[J].锦州医科大学学报(社会科学版),2021,19(05):10-14.
[38]中国科学院.人类基因编辑研究报告全球发布提出科学、伦理与监管基本原则[EB/OL].(2017-02-15).
[39]孙那,王雅洁.生殖系细胞基因编辑的法律规制进路[J].中国医学伦理学,2023,36(12):1342-1349.
[40]陶林.论医学人工智能的运用、伦理风险与规制[J].青岛科技大学学报(社会科学版),2022,38(02):63-69.
[41]叶卓俊, 沈艳丽, 江晓, 袁蕙芸. 医学人工智能领域伦理治理重点研究[J]. 中国医学伦理学, 2024, 37 (01): 39-44.
[42]国家药品监督管理局医疗器械技术审评中心. 国家药监局器审中心关于发布影像超声人工智能软件(流程优化类功能)技术审评要点等4个审评要点的通告. [EB/OL]. (2023-07-10).
[43]丁瑜. 案例分析法在医学伦理学课程中的运用[C]//榆林市医学会.第二届全国医药研究论坛论文集(一),2023:6.
[44]张新庆.临床伦理学:新时代呼唤新作为[J].协和医学杂志,2020,11(05):638-640.
[45]王晓敏,刘星,周岚等.新医科视域下医学伦理学教学改革思考[J].中国医学伦理学,2021,34(10):1371-1375.
[46]袁曦.恶性肿瘤治疗中的伦理问题与确证[J].肿瘤代谢与营养电子杂志,2014,1(02):11-14.
[47]Cheng, N, Cui, X, Chen, C, et al. Exploration of Lung Cancer-Related Genetic Factors via Mendelian Randomization Method Based on Genomic and Transcriptomic Summarized Data. Front Cell Dev Biol. 2021; 9 800756.
[48]何玲玉,王玥,李闪闪等.临床研究之伦理治理框架: Emanuel八个“伦理原则”的审辨[J].医学与哲学,2019,40(16):1-5.
[49]田野,刘霞.基因编辑的良法善治:在谦抑与开放之间[J].深圳大学学报(人文社会科学版),2018,35(04):106-115.
[50]国家卫生健康委,教育部,科技部,国家中医药局,《涉及人的生命科学和医学研究伦理审查办法》,2023.