中国抗癌协会
立即下载App《中国恶性肿瘤学科发展报告(2023)》——肿瘤内分泌研究进展篇

内分泌学是肿瘤学的基础学科之一,对与肿瘤相关的内分泌学进行深入研究,对了解肿瘤病因,指导肿瘤诊疗具有极其重大的意义。近年来,肿瘤内分泌学科研究取得了大量的进展,产生了大量的转化医学成果,包括激素、生长因子及糖脂代谢相关信号途径与肿瘤发生发展的因果关系;各种内分泌及激素相关性肿瘤的诊断治疗;针对肿瘤细胞受体、激酶和分子结构等特异性靶点;直接或间接阻断信号途径调控细胞周期和生命的靶向治疗药物;根据肿瘤的激素依赖性设计的肿瘤内分泌治疗;肿瘤相关治疗产生的内分泌代谢相关不良反应等。未来的肿瘤学不仅与传统内分泌学结合,而且将在此基础上与分子内分泌学结合,从分子机制上阐述肿瘤的病因和发病机制,规划肿瘤的防治策略。

1.概述
激素受体阳性乳腺癌是最常见的乳腺癌类型,目前以内分泌药物为代表的激素治疗是此类肿瘤治疗的基石,可降低早期乳腺癌的复发转移几率,延长晚期乳腺癌的生存获益时间。随着靶向药物的研发和问世,使得HR阳性乳腺癌进入“内分泌+”时代,新型靶向药物的研发成功,例如CDK4/6抑制剂、mTOR抑制剂、PI3K抑制剂、AKT抑制剂、HDAC抑制剂等,进一步改善了HR阳性乳腺癌的预后,同时新的药物研发和新的临床研究探索层出不穷,如何为患者选择最合理的治疗方案,做到个体化、精准化的全程治疗管理,仍是目前临床医生所面临的问题。需辩证性地比较数据,结合患者的一般状况、基因突变位点、不良反应谱等因素综合判断。
02 国内外发展现状-乳腺肿瘤研究进展
2.1 早期乳腺癌研究新进展
2.1.1 内分泌联合CDK4/6抑制剂治疗进展
目前关于内分泌联合CDK4/6抑制剂辅助治疗的四项研究在入组患者、药物、给药方式以及治疗时长等方面均有差异,四项研究中仅有MonarchE研究和NATALEE研究得出了阳性结果。
MonarchE研究是首个在HR阳性、HER-2阴性高复发风险早期乳腺癌辅助治疗中获得阳性结果的Ⅲ期临床研究,证实了CDK4/6抑制剂阿贝西利联合内分泌疗法对于HR阳性、HER-2阴性、淋巴结阳性的高危型早期乳腺癌患者的辅助治疗显示出了在iDFS时间的持续获益和可耐受的安全性。MonarchE研究针对II-III期高危患者给予了2年阿贝西利联合内分泌治疗,结果发现,随着随访的延长,患者能够获得持续的iDFS率获益。2023年ESMO年会上进一步公布了其5年随访的里程碑式结果,相较内分泌治疗,接受阿贝西利联合内分泌治疗的患者5年iDFS率绝对获益达到7.6%,iDFS事件风险显著降低32%。该结果显示出了阿贝西利联合内分泌治疗带来的持续获益,进一步夯实了阿贝西利的标准辅助治疗地位,为这部分患者带来更多临床治愈的机会。在2023年SABCS上公布了MonarchE的转化研究,转录组学方面,在所有内在分子亚型中,阿贝西利的治疗获益是一致的。基因组学方面,除了MYC扩增患者,阿贝西利的治疗获益也是一致的。而MYC扩增与阿贝西利获益减少相关,这可能是因为MYC可诱导许多不依赖于CDK4/6的基因复制,同时MYC可以使肿瘤能够逃避免疫监视,抵消CDK4/6抑制剂的免疫原性作用。除此以外,对于ctDNA持续动态的监测发现24个月时ctDNA为阳性的患者,其预后以及从强化内分泌辅助治疗中的获益均相对较差,且与疾病复发高度相关。
NATALEE研究评价了在早期HR阳性、HER-2阴性乳腺癌中使用瑞波西利联合NSAI的疗效和安全性,共纳入5101例具有复发风险的Ⅱ期或Ⅲ期乳腺癌患者,2023年,NATALEE研究公布了3年的随访数据,结果发现无论是II期还是III期患者,瑞波西利均可显著延长iDFS期。与单独使用内分泌治疗相比,瑞波西利联合内分泌治疗可使患者的3年iDFS事件风险降低25.2%;3年无远处疾病生存事件风险降低26%;起始剂量为400 mg的3年瑞波西利治疗方案耐受性良好,无新的安全性信号。2023年ESMO年会上进一步公布了其关键亚组分析结果:在所有临床相关亚组(包括疾病分期、淋巴结转移情况、既往是否接受化疗、是否绝经、年龄等)中,瑞波西利联合NSAI对比NSAI单药的iDFS获益是一致的,联合治疗组始终具有更明显的iDFS获益,与在整体人群中观察到的结果一致;淋巴结阴性亚组中,瑞波西利组iDFS为94%,内分泌治疗组仅为89%,说明瑞波西利可显著改善淋巴结阴性患者的生存时间。这一研究结果进一步支持瑞波西利联合NSAI作为Ⅱ、Ⅲ期(包括淋巴结阴性疾病患者)HR阳性、HER-2阴性的早期乳腺癌患者的治疗新选择。NATALEE研究选择了瑞波西利,除了纳入了中高危人群,还入组了一部分相对低危的患者。此外NATALEE研究还将健康相关生活治疗(HRQOL)作为次要终点,结果显示在标准治疗辅助NSAI中加用瑞波西利,相对于单纯NSAI组,HR+/HER2-早期乳腺癌患者的HRQOL得以维持,并且在躯体功能、总体健康状态、社交功能、情感功能、乳腺癌症状、焦虑和抑郁等维度均显示出类似结果。同时在安全性方面,3年的低剂量间歇性的瑞波西利辅助治疗的不良事件较少且可耐受。
总的来看,NATALEE研究与MonarchE研究优势互补,各有千秋。同时,我们不仅要关注生存数据上的改善,也要重视不良反应以及药物对患者生活质量的影响。国产原研CDK4/6抑制剂达尔西利辅助治疗注册研究正在进行中,期待这项研究的结果。
在CDK4/6抑制剂联合内分泌新辅助治疗方面,也有一些研究进行了探索。coopERA研究选择了内分泌治疗(Giredestrant或阿那曲唑)+哌柏西利的联合新辅助治疗方案。该研究达到了主要研究终点,结果显示Giredestrant组在2周后的Ki67降低程度方面要显著优于阿那曲唑组,同时在完全细胞周期停滞(CCCA)比例方面,Giredestrant较阿那曲唑也展现出数值优势。目前口服SERD类药物联合或不联合CDK4/6抑制剂的多项研究正在进行中,值得期待。2023年SABCS上还公布了DARLING-1研究的结果,该研究选用了达尔西利+来曲唑联合新辅助治疗方案。结果显示,客观缓解率(ORR)达到51.7%,2周CCCA比例达70%。
2.1.2 免疫治疗联合化疗或内分泌治疗新进展
免疫治疗在ER阳性早期乳腺癌中的应用取得了显著进展。HR+/HER2-早期乳腺癌的新辅助治疗的病理学完全缓解(pCR)率并不高,一般在8%~15%之间。能否对这部分患者采用化疗联合免疫治疗的方案来提高新辅助治疗的pCR率呢?KEYNOTE-756研究以及CheckMate-7FL研究分别针对帕博利珠单抗联合化疗和纳武利尤单抗联合紫杉醇两种新辅助治疗方案进行了探索。KEYNOTE-756研究显示,新辅助化疗联合帕博利珠单抗显著提高了早期、高危ER+/HER2-乳腺癌的pCR率。CheckMate 7FL研究中新辅助化疗联合纳武利尤单抗也观察到了类似的pCR获益。两项研究的试验组相较于安慰剂组均带来了pCR率的改善,将HR+/HER2-乳腺癌的pCR率提升至接近25%。KEYNOTE-756研究还对免疫治疗获益的生物标志物进行了分析,发现PD-L1 CPS≥1时,pCR率更高,同时ER低表达的人群获益更大。Checkmate-7FL研究的亚组分析则发现PD-L1阳性、ER/PR低表达、sTIL≥1%的人群接受纳武利尤单抗治疗的pCR获益更高。需要注意的是,虽然两项研究pCR数据获益可靠,但我们还是要重视免疫治疗在新辅助阶段应用时的安全性管理,这有待EFS数据的公布,我们也需要更多的研究来确定能够预测pCR和EFS数据获益的生物标志物。
2.2 晚期乳腺癌研究新进展
2.2.1 口服雌激素受体的下调剂Elacestrant
既往雌激素受体下调剂,我们只有氟维司群,FALCON研究已经证实氟维司群是一个单药最优的内分泌治疗药物。口服的SERD相比于氟维司群,使用更为便捷,而且药效学和药代学显示可能会有更优疗效,因此成为了近年来研究的热点,但直到今年才终于有第一个口服SERD类药物正式上市。在EMHRALD这项Ⅲ期临床研究中,入组的是HR阳性和HER2阴性的晚期乳腺癌,在晚期阶段既往已经接受过一线或者二线的内分泌治疗,且接受过细胞周期依赖性激酶4/6抑制剂(CDK4/6i),将Elacestrant和研究者选择的标准的晚期内分泌治疗氟维司群或者芳香化酶抑制剂进行对比,主要研究的终点是全人群的PFS以及ESR1突变人群的PFS双终点。该研究最终结果为阳性,特别是ESR1突变的人群疾病进展风险降低45%,全人群的疾病进展风险降低30%。基于该研究的数据,美国FDA批准了Elacestrant用于HR阳性、HER2阴性、ESR1突变的晚期或转移性乳腺癌。
2.2.2 新型的ADC药物戈沙妥珠单抗
戈沙妥珠单抗(SG)已被获批用于晚期三阴性乳腺癌的治疗,通过TROPiCS-02研究的数据,进一步拓宽了该药物的适应证。该研究入组的是HR阳性和HER2阴性的晚期乳腺癌患者,既往均接受过CDK4/6i,而且要接受过至少两线但不超过四线的姑息化疗,将SG和研究者选择的化疗进行头对头的对比,主要研究终点PFS值显著改善(提高了1.5个月),而总生存也有统计学意义的显著提高(提高了3.3个月)。在亚裔人群的桥接研究EVER-132-002中显示PFS有统计学意义的显著改善,OS也有显著提高。
2.2.3 AKT的抑制剂Capivasertib
对于HR阳性HER2阴性的晚期乳腺癌来说,最常发生突变的通路是PAM通路,在这个通路当中,已经有mTOR抑制剂依维莫司,PI3K抑制剂Alpelisib获批于PI3K突变的患者。而AKT抑制剂直到今年才有第一个新药Capivasertib获批,用于HR阳性HER2阴性,同时具备PAM通路PIK3CA或者AKT1、PTEN通路改变的人群。基于CAPItello-291研究,AKT抑制剂Capivasertib联合氟维司群和单用氟维司群对比,总体人群的PFS可以从3.6个月提高到7.2个月(HR=0.6),而对于PAM通路改变人群改善更明显(HR=0.5)。
2.2.4 新型CDK4/6抑制剂来罗西利
2023年ASCO年会上报道了Ⅲ期LEONARDA-1临床研究,评估CDK4/6抑制剂来罗西利联合氟维司群(联合组)对比氟维司群单药(单药组)治疗既往接受内分泌治疗后疾病进展的HR阳性、HER-2阴性的局晚期或转移性乳腺癌患者的有效性和安全性。该研究共入组275例患者,截止至数据收集时,联合组和单药组的中位PFS时间分别为11.07个月和5.49个月(HR=0.458,P<0.001),联合组ORR为26.9%,完全缓解率为2.5%,显著高于单药组的9.9%和0,且联合组中绝经前或围绝经期患者与绝经后患者观察到的获益一致;联合组与单药组最常见的TRAE为中性粒细胞减少(90.5% vs. 4.3%)、白细胞减少(86.9% vs. 6.5%)、贫血(34.3% vs. 10.1%)、血小板减少(19.7% vs. 3.6%)以及腹泻(19.7% vs. 3.6%),联合组46.7%患者发生3、4级TRAE,而单药组未发生≥3级TRAE,且两组均未发生≥3级的严重腹泻事件。该研究证实,对于内分泌耐药的HR阳性、HER-2阴性的晚期乳腺癌患者,使用来罗西利联合氟维司群疗法可显著改善患者的疗效,安全性及耐受性均在可控范围。
2.2.5哌柏西利与他莫昔芬的联合使用
虽然既往Ⅲ期研究证明在内分泌治疗(芳香化酶抑制剂或氟维司群)中加入哌柏西利,可以提高患者的PFS时间。然而,哌柏西利与他莫昔芬的联合使用对于不同绝经状态患者的疗效和安全性仍有待探索。2023年ASCO年会上公布了一项随机、双盲Ⅲ期临床研究(PATHWAY试验)的主要结果,探索哌柏西利+他莫昔芬±戈舍瑞林治疗HR阳性、HER-2阴性的晚期乳腺癌亚洲患者的疗效与安全。该研究入组患者1:1随机分配接受哌柏西利或安慰剂联合他莫昔芬作为一线或二线治疗,绝经前或围绝经期患者同时接受戈舍瑞林的卵巢抑制,主要终点PFS,次要终点包括OS、ORR、安全性和患者报告的结果。该研究共纳入了184例患者,截至数据截止日期,哌柏西利+他莫昔芬组的中位PFS时间为24.4个月,安慰剂+他莫昔芬组的为11.1个月(HR=0.602,单侧P=0.002);其中,一线治疗患者的HR=0.521,二线治疗患者的HR=0.707;绝经前或围绝经期患者的HR=0.378,绝经后患者的HR=0.677;虽然OS数据尚未成熟,但初步分析显示哌柏西利组降低了27%的死亡风险;哌柏西利+他莫昔芬组与安慰剂+他莫昔芬组≥3级TRAE发生率分别为93.4%和20.4%,最常见的为中性粒细胞减少症(哌柏西利+他莫昔芬组为89.0%,安慰剂+他莫昔芬组为1.1%)。该研究达到了其主要研究终点,提示与安慰剂+他莫昔芬相比,HR阳性、HER-2阴性的晚期乳腺癌患者采用哌柏西利+他莫昔芬治疗方案后PFS可获得显著且有临床意义的改善,且安全性可耐受。
概述
女性激素相关性肿瘤主要包括乳腺癌、子宫内膜癌及少部分卵巢性索间质肿瘤。近年来,子宫内膜癌(EC)的发病率和死亡率不断上升,全球年新发病例约417,367例,年死亡病例约97,370例,预计到2040年,它将成为女性第三大流行癌症类型和导致女性死亡的第四大癌症。原发性晚期或复发性子宫内膜癌(R/M EC)的治疗进展(尤其是一线治疗)始终“步履维艰”,亟需有所突破。复发/转移性子宫内膜癌患者即使经过化疗、手术或放化疗后,仍有近一半复发,中位无进展生存期(PFS)和总生存期(OS)分别仅13个月和37个月。近年来,子宫内膜癌的分子分型应用越来越广泛,并涌现了众多靶向、免疫治疗的新方案。现将2023年子宫内膜癌诊治进展和未来发展展望进行汇总如下。
过去的2023年,子宫内膜癌研究领域取得了较多进展,包括国际妇产科联盟(FIGO)新分期系统的发布及R/M-EC免疫联合化疗一线治疗研究结果的公布等。本文将回顾过去一年里EC领域研究的新进展,以期探索未来方向研究。
01 FIGO 2023子宫内膜癌新分期的提出
自子宫内膜癌2009 FIGO分期以来,对子宫内膜癌的病理和分子特征的理解已经取得了许多进展。尤其是癌症基因组图谱(TCGA)数据发布以来,分子遗传学研究进展迅速,进一步明确了不同组织学类型子宫内膜癌的生物学特征及其不同的预后。新分期系统的目标是更好地定义预后分组,以明确更适当的手术、放疗和系统性治疗方案。
随着子宫内膜癌组织病理学、TCGA分子分型及前哨淋巴结活检的进展,对子宫内膜癌生物学特征的异质性及其不同预后结局的认识逐步提高。2021年,欧洲妇科肿瘤学会/欧洲放射肿瘤学会/欧洲病理学会(ESGO/ESTRO/ESP)首先提出了基于分子分型的EC管理指南;2023年,FIGO妇科肿瘤委员会参考ESGO/ESTRO/ESP指南,推出了2023版的EC分期系统。相较于老分期系统,2023版分期系统(表1)纳入了更多新指标(包括组织病理学、肿瘤分级、肌层浸润、淋巴脉管间隙浸润、附件受累及淋巴结状况等),更为细化,更能反映当前EC的研究现状。此外,此次新分期更新的最大亮点是引入了子宫内膜癌分子分型。对于分子分型已知的I-II期EC,POLE突变或TP53突变将改变患者的分期(表2)。POLEmut型EC,无论LVSI程度或组织学类型如何,都被归类为IAmPOLEmut期;而局限于子宫体的p53abn型EC,无论子宫肌层浸润与否,宫颈浸润与否,LVSI程度如何,均被归为IICmp53abn。MMRd或NSMP状态不会改变FIGO分期,但也应该被记录下来。


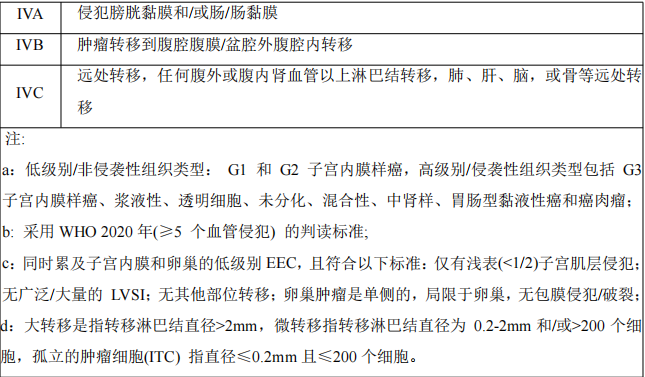
表2、具有分子分型的FIGO 2023子宫内膜癌分期系统

02 免疫联合治疗进入复发/转移性子宫内膜癌的一线治疗
从2012年到2023年,免疫治疗可谓“十年磨一剑,出鞘必锋芒”。2023年以来,随着多项免疫检查点抑制剂(ICIs)联合紫杉醇+卡铂化疗一线治疗R/M EC的2期(1项)和3期(4项)随机对照试验(RCT)结果陆续公布。在意向性分析人群(ITT)中,4项研究结果较为一致:相比化疗,免疫联合化疗将复发风险显著降低22%~36%,均达到预设的主要研究终点;OS数据虽尚未成熟,但免疫联合化疗呈现出OS获益趋势。这些研究结果推动免疫治疗终于“问鼎”晚期或复发性子宫内膜癌一线。至此,尘封了10年的一线联合化疗方案格局终于被打破,2023年V2版本子宫内膜癌NCCN指南关于晚期或者复发性子宫内膜癌的一线标准治疗方案也成功被改写为免疫治疗联合化疗后免疫治疗维持(1类证据)。
EC目前从分子分型角度可将其分为四种亚型(POLE突变型、dMMR/MSI-H、p53突变型、NSMP型),不同亚型对于免疫治疗的获益程度也不同。因此,我们推测化疗联合ICI的疗效在不同亚型中发挥的作用可能亦有所不同,对于免疫治疗最可能获益的错配修复缺陷/微卫星高度不稳定性(dMMR/MSI-H)人群。在4项III期RCT研究中,dMMR/MSI-H约占R/M-EC人群的18.5%-27.6%,化疗组的中位无进展生存(mPFS)为6.2–7.7个月,而ICIs联合化疗组mPFS为28.7个月-未达到,ICIs联合化疗将进展风险降低了58%-78%;此外,随访时间最长的RUBY研究结果显示,多塔利单抗(Dostarlimab)联合化疗组24个月OS率也明显优于化疗组(83.3% vs. 58.7%,HR=0.30,95% CI:0.13-0.70),基于此,2023年7月FDA批准Dostarlimab联合紫杉醇+卡铂后Dostarlimab维持一线治疗dMMR/MSI-H型R/M-EC。
在DNA错配修复功能正常/微卫星稳定(pMMR/MSS)人群中,有3项III期RCT研究结果阳性,ICIs用药分别为多塔利单抗(Dostarlimab)、帕博利珠单抗(Pembrolizumab)和度伐利尤单抗(Durvalumab)。三项研究的化疗组mPFS为6.2-7.9月,ICIs联合化疗组mPFS为9.2-9.9月,ICIs的加入使pMMR/MSS患者的进展风险下降23%-53%,显然这部分患者从ICIs联合化疗中的获益不如dMMR/MSI-H人群。另一方面,遗憾的是,在阿替利珠单抗(Atezolizumab)联合化疗的AtTEnd研究中,549例pMMR患者的数据显示,阿替利珠单抗联合化疗组和化疗组相比,无论mPFS(9.5月vs. 9.2月,HR=0.92,95% CI:0.73–1.16)还是mOS(31.5月vs. 28.6月,HR=1.00,95% CI:0.74–1.35)均无统计学意义的显著差异。
pMMR/MSS这一组患者包括了POLE突变亚型、NSMP亚型和TP53突变亚型,需要考虑患者异质性对结果的影响。RUBY研究回顾性探讨了不同分子分型子宫内膜癌对免疫联合化疗的疗效。该研究中的400例患者进行了TCGA分子分型,NSMP亚型最常见(n=216,54%)。相较于标准化疗,dostarlimab联合化疗在该亚型展现出24个月PFS率获益的趋势(31.0% vs. 20.1%;HR,0.77;95% CI,0.55~1.07),但24个月OS率没有改善(66.0% vs. 61.4%;HR,0.87;95% CI,0.56~1.36)。
预后最差的TP53突变亚型在RUBY研究中占22%(88例)。dostarlimab联合化疗在TP53突变亚型中亦显示出明显的临床获益:24个月PFS率分别为32.4% vs. 17.8%(HR,0.55;95% CI,0.30~0.99),24个月OS率分别为70.8% vs. 30.2%(HR,0.41;95% CI,0.20~0.82)。但与此相反,在DUO-E研究的154例浆液性EC(约92%为TP53突变亚型)中,与单纯化疗相比,度伐利尤单抗联合化疗未能改善患者的PFS(HR,0.71;95% CI,0.46~1.11),而化疗+度伐利尤单抗+奥拉帕利维持治疗可较化疗显著改善患者的PFS(HR,0.46;95% CI,0.27~0.77)。
POLE突变亚型的EC预后最好,在RUBY研究中无论是单纯化疗还是化疗联合dostarlimab,这类患者均未出现复发。但其在晚期或复发EC中占比很少,例如RUBY研究中仅有5例患者,占1.25%。
总之,2023年是免疫治疗全面进入R/M EC一线治疗的一年。
03 KEYNOTE-775确认了“可乐组合”在pMMR型R/M EC后线治疗的疗效
KEYNOTE-775是一项多中心、开放标签、III期RCT研究,共纳入827例既往含铂化疗失败的R/M-EC,分别接受乐伐替尼(Lenvatinib)联合帕博利珠单抗(“可乐组合”)或单药化疗。2022年,N Engl J Med首次报道了KEYNOTE-775研究的初步结果。今年4月,J Clin Oncol杂志报告了最终OS数据和更新的PFS和安全性数据,结果发现:“可乐组合”降低了pMMR患者40%的进展风险(HR=0.60;95%CI: 0.50-0.72)和30%的死亡风险(HR=0.70;95% CI: 0.58-0.83),而对于总人群,“可乐组合”降低了44%的进展风险(HR=0.56;95%CI: 0.48-0.66)和35%的死亡风险(HR=0.65;95%CI: 0.55-0.77)。需要注意的是,在KEYNOTE-775研究中,65例dMMR患者接受“可乐组合”,其客观缓解率(ORR)为41.5%,mPFS为10.7月,mOS为31.9月,而在KEYNOTE-158研究中,帕博利珠单抗单药治疗的dMMR患者(n=94)的ORR为50%,mPFS为13.1月,mOS为65.4月。因此,对于经治的dMMR型R/M EC,“可乐组合”是否优于帕博利珠单抗单药仍值得进一步探讨。
04 GOG-258:放化疗联合化疗未能改善局部晚期EC的OS
GOG-258试验是一项前瞻性III期RCT研究,旨在探索与单独的6个疗程TC化疗相比,放化疗联合4个疗程TC化疗能否改善手术后初治局晚期子宫内膜癌(IIIa-IVa期,FIGO 2009,残留病灶≤2cm)的预后。2019年,N Engl J Med首次报道了GOG-258研究的结果,与单独化疗相比,放化疗联合化疗未能改善5年无复发风险(59% vs. 58%),降低了阴道局部及区域淋巴结复发风险(2% vs. 7%; 11% vs. 20%),但同时增加了远处转移的风险(27% vs. 21%);今年3月27日,SGO年会上更新了GOG-258试验总生存(OS)数据,结果显示:放化疗联合组未能改善患者的OS,并且各个亚组分析中放化疗联合组也未能改善患者的OS。需要注意的是,GOG-258研究中放化疗联合组中仅75%的患者完成4周期的既定化疗,而单纯化疗组85%的患者完成既定6周期化疗;同时放化疗联合组中高达70%的患者接受传统的四野放疗,增加了放疗副反应。
05 DUO-E:一线免疫+化疗后,免疫+聚腺苷二磷酸核糖聚合酶(PARPi)维持治疗晚期EC PFS获益显著
DUO-E/GOG-3041/ENGOT-EN10 III期临床研究是首个评估奥拉帕利用于晚期/转移性子宫内膜癌维持治疗的研究,并结合患者的分子状态进行分层分析。在2023 ESMO大会中报道了研究的PFS主要分析结果以及首次OS中期分析。
该研究是一项三臂、随机、双盲、安慰剂对照、多中心III期临床试验。纳入718名既往未经一线化疗的新诊断III期或IV期或复发性子宫内膜癌患者,其中有接近30%的亚洲患者。受试者按1:1:1随机分配至A组(紫杉醇/卡铂+安慰剂治疗,安慰剂维持治疗)、B组(紫杉醇/卡铂+度伐利尤单抗治疗,度伐利尤单抗维持治疗)、C组(紫杉醇/卡铂+度伐利尤单抗治疗,度伐利尤单抗+奥拉帕利维持治疗)。
中期结果发现,在意向性治疗分析(ITT)人群,度伐利尤单抗单药或联合奥拉帕利,mPFS期分别为10.2个月、15.1个月,优于单独化疗组(mPFS期:9.6个月)。dMMR和pMMR的患者,度伐利尤单抗单药或联合奥拉帕利mPFS期均高于单独化疗组。
dMMR人群中,度伐利尤单抗单药组mPFS期未达到,疾病进展风险显著降低了58%;而度伐利尤单抗联合奥拉帕利组mPFS为31.8个月,疾病进展风险显著降低了59%。pMMR人群中度伐利尤单抗单药组mPFS 9.9个月,度伐利尤单抗联合奥拉帕利mPFS为15个月,疾病进展风险显著降低了43%。提示在pMMR患者中,联合奥拉帕利维持治疗可进一步提高患者PFS。
进一步根据PD-L1状态进行亚组分析,PD-L1阳性(TAP≥1%)亚组中,度伐利尤单抗单药或联合奥拉帕利组的PFS均有获益 (9.5个月 vs. 11.3个月vs. 20.8个月),疾病进展风险分别下降37%和58%。虽然在本次分析时,OS中期分析数据尚不成熟,但度伐利尤单抗单药组和度伐利尤单抗+奥拉帕利组两种治疗方案相较于单纯化疗组均有较好的获益趋势。
06 SIENDO研究:维持治疗可延长TP53野生型晚期子宫内膜癌PFS
III期SIENDO研究(NCT03555422)披露了口服核输出蛋白-1(exportin-1,XPO1)抑制剂Selinexor维持治疗在化疗后达到完全缓解(CR)/部分缓解(PR)的R/M-EC中的价值,263例ITT人群中未达到主要研究终点(mPFS:5.7月vs. 3.8月;HR=0.76,95% CI:0.54-1.08,P=0.13);然而,在探索性分析中,对于103例TP53野生型患者,Selinexor明显改善了患者的mPFS(13.7月 vs. 3.7月;HR=0.41;95%CI: 0.23-0.72,P=0.002),提示Selinexor可用于化疗后达到CR/PR的NSMP亚型R/M EC维持治疗。
总结
子宫内膜癌已经进入分子分型的“精准治疗”时代,国内外指南已经将分子分型检测纳入其中,逐渐开始用于分期、风险分层和指导靶向、免疫治疗,进一步深入临床实践。在复发/转移性子宫内膜癌的一线治疗方面,免疫联合化疗已成为一线治疗推荐,遗憾的是,目前关于ICI一线治疗亚洲R/M EC人群的数据较少,且获益不明显。对于晚期/复发子宫内膜癌的治疗,免疫联合抗血管生成药物可作为去化疗的选择,期待更多基于子宫内膜癌分子分型治疗的研究开展,也期待更多亚洲人群的数据。
内分泌治疗是前列腺癌的基础、一线治疗方案,伴随着大多数患者的终身诊疗过程。以阿比特龙、恩扎卢胺、阿帕他胺、达罗他胺等药物为代表的新型内分泌治疗的出现,不仅显著改善去势抵抗性前列腺癌(castration resistant prostate cancer,CRPC)临床疗效及预后,而且广泛运用于高危、转移性、雄激素敏感前列腺癌的初始治疗,能明显改善患者的总生存和预后。随着各项临床研究的不断深入,新型内分泌治疗已应用于前列腺癌诸多不同状况的临床治疗,有着令人满意的治疗效果。此外雄激素剥夺治疗(androgen deprivation therapy, ADT)药物研究也在不断进展之中,为患者的临床治疗提供新的选择。
01 联合达罗他胺能的系统治疗能明显改善转移性雄激素敏感前列腺癌的临床转归
肿瘤转移负荷和高危因素对转移性雄激素敏感前列腺癌(metastatic hormone-sensitive prostate cancer,mhsPca)的临床治疗结局有明显影响。通过对ARASENS实验临床数据的再分析,证实联合达罗他胺能的系统治疗能改善全人群转移性雄激素敏感前列腺癌的临床转归。mhsPca患者随机分为2组,达罗他胺+ADT+多西他赛(达罗他胺组),安慰奖+ADT+多西他赛(安慰奖组)。高转移负荷定义为:内脏转移,和/或≥4处骨转移灶(至少1处在脊柱/骨盆以外);高危病例为存在≥2个高危因素(Gleason评分≥8,≥3处骨转移灶,存在可测量的内脏转移灶)。共1305例患者,1005例(77%)是高转移负荷病例,912例(70%)是高危病例。与安慰剂组相比,达罗他胺能显著改善高转移负荷组(HR, 0.69; 95% CI, 0.57 - 0.82),高危组 (HR, 0.71; 95% CI, 0.58 - 0.86),低危组 (HR, 0.62; 95% CI, 0.42 -0.90)的总生存(overall survival,OS),对于低转移负荷组,达罗他胺组也有明显的生存获益 (HR, 0.68; 95% CI, 0.41- 1.13)。在去势抵抗出现时间和后续系统抗肿瘤治疗方面,达罗他胺组也有明显的临床获益。治疗副作用 (Adverse events,AEs)方面,二组基本相似,高转移负荷组3-4级AEs,达罗他胺组64.9%,安慰剂组64.2%,而低转移负荷组分别为70.1%和61.1%。
02 大幅度、快速、持续的PSA下降预示阿帕他胺+ADT治疗转移性去势敏感性前列腺癌的良好疗效
多中心III期RCT临床研究TITAN的结果显示:阿帕他胺+ADT能改善转移性去势敏感性前列腺的总生存 (overall survival,OS)和影像无进展生存(radiographic progression-free survival,rPFS)。进一步对TITAN研究对象的PSA变化动力学进行研究,提示治疗后大幅度、快速、持续的PSA下降与阿帕他胺+ADT治疗转移性去势敏感性前列腺癌的良好疗效直接相关。研究中1052例患者按1 : 1分配入阿帕他胺组(阿帕他胺240 mg/天+ADT,525例)和安慰剂组(安慰剂+ADT,527例),随访44个月。结果显示:在整个研究过程中血PSA下降≥50% ,≥90%,达≤0.2 ng/ml患者比例,阿帕他胺组分别为90%, 73%, 和68%,对照组分别为55%, 29%, 和32%。治疗3月后,血PSA下降≥90%或达≤0.2 ng/ml者,阿帕他胺组分别为59%,51%,对照组分别为13%,18%。与安慰剂组相比,治疗3月后血PSA的快速、大幅度下降与长OS(HR 0.35; 95% CI,0.25-0.48),rPFS(HR 0.44; 95% CI,0.30-0.65),生化进展时间(HR 0.31; 95% CI,0.22-0.44),去势抵抗时间(HR 0.38; 95% CI,0.27-0.52)直接相关。在治疗6月,12月时,研究结果相似。
03 恩杂鲁胺能明显改善高危生化复发患者的无转移生存期
根治性治疗后局限性前列腺癌患者存在生化复发高危因素意味着临床进展的风险增大。一项III期临床研究,目的是比较恩杂鲁胺(160mg/天)+亮丙瑞林(联合治疗组)、恩扎卢胺(160mg/天)单药组与安慰剂+亮丙瑞林(ADT组),对存在生化复发高危因素(血PSA倍增时间≤9月)的前列腺癌患者的疗效和安全性。研究共招募1068名患者,按1:1:1比例随机分配,其中联合治疗组355例,单药组355例,ADT组358例,中位随访时间60.7月。结果显示:5年无转移生存,联合治疗组为87.3% (95% CI, 83.0-90.6),单药组为80.0% (95% CI, 75.0-84.1),ADT组为71.4% (95% CI, 65.7-76.3)。与ADT组相比,联合治疗组无转移生存显著改善(转移或死亡HR, 0.42; 95% CI, 0.30-0.61; P<0.001),单药组也明显改善(转移或死亡HR, 0.63; 95% CI, 0.46-0.87; P=0.005),而治疗相关危险情况没有出现。三组病例的QOL差异不明显。研究结果提示:恩杂鲁胺单药治疗较单纯ADT治疗在防治有生化复发高危因素的前列腺癌的转移方面有明显优势,联合ADT则疗效更为显著。
04 辅助内分泌治疗可能不能提升局部高危前列腺癌新辅助内分泌治疗后近距离放疗+外放疗的临床疗效
局部高危前列腺癌近距离放疗+外放疗患者,30个月ADT(6月新辅助ADT + 24个月辅助ADT)疗效是否优于6个月ADT(新辅助)?一项来自37家医院的III期临床研究回答了这个问题。研究共纳入332例前列腺癌患者,年龄40-79岁,T2c-3a,PSA >20 ng/mL,Gleson评分>7,新辅助ADT治疗6个月后行碘-125近距离放疗+外放疗,然后随机分为两组,一组无进一步治疗(165例,短疗程组),一组进行24个月ADT(167例,长疗程组)。中位随访时间9.2年。7年内累计生化进展率短疗程组为9.0% (95% CI, 5.5-14.5) ,长疗程组为8.0% (95% CI,4.7-13.5),差异不明显(P=0.65)。临床进展率、转移、挽救性治疗、疾病特异性死亡和总生存,二组差异均不显著。3级以上内分泌治疗、放疗相关副反应短/长疗程组分别为 0.6%/1.8% (P=0.62) 和1.2%/ 0.6% (P=0.62),差异均不显著。研究结果证实,对于局部高危前列腺癌患者,ADT+近距离放疗+外放疗是可行的,该研究未能证实,该治疗方案中,额外的24个月辅助ADT治疗对局部高危前列腺癌患者似乎临床获益不显著。当然,这个结论需进一步非劣性研究的证实。
05 瑞卢戈利在晚期前列腺癌新型内分泌治疗中安全、有效
瑞卢戈利是一种具有口服活性,非肽性,有效的促性腺激素释放激素(GnRH)的拮抗剂。一项正在进行的I期临床试验的中期结果证实瑞卢戈利在晚期前列腺癌的新型内分泌治疗中耐受性良好且安全、有效。这是一个52周、开放、平行队列研究,研究分两部分:部分1,对转移性去势敏感或去势抵抗性前列腺癌患者联合使用瑞卢戈利和阿比特龙;部分2,对转移性去势敏感性前列腺癌或非转移性去势抵抗性前列腺癌患者联合使用瑞卢戈利和阿帕他胺。如患者既往使用亮丙瑞林或地加瑞克者,入组后更换为瑞卢戈利。该中期分析病例均完成了12周以上的观察。入组病例部分1有15名,部分2有10名。结果证实,所有的药物治疗副作用均为轻中度,且均在已知的个人用药安全范围内。生命体征和心电图参数等基本正常。血清睾酮水平持续处于去势水平。
06 II期药物负荷实验探索替维瑞克治疗晚期激素敏感晚期前列腺癌安全性、药代动力学和药效动力学。
替维瑞克是一种GnRH的拮抗剂。有5个单臂、非对照II期药物负荷实验评估不同负荷剂量替维瑞克治疗晚期前列腺癌的药代动力学、药效动力学、有效性和安全性。这5个负荷剂量分别是:①皮下注射替维瑞克90mg,连续3天;②肌肉注射替维瑞克90mg,第0、7天;③皮下注射替维瑞克120mg,连续2天;④皮下注射替维瑞克2×60mg,连续3天;⑤皮下注射替维瑞克2×90mg,连续3天。共82例患者参与实验。替维瑞克90 mg/180 mg皮下注射,连续3天方案,平均维持去势水平天数为55.32、68.95 天,>90%病例在28天时血睾酮< 0.5 ng/mL。去势状态出现时间,皮下注射平均时间1.10 - 1.77天,肌肉注射为2.4天。最常见的不良反应是注射部位局部的反应,无严重副作用出现。提示:替维瑞克安全、耐受性良好,连续3天皮下注射能迅速达去势水平。
07 雌二醇透皮贴剂用于前列腺癌ADT治疗能明显减少雌激素紊乱相关毒性反应
LHRHa治疗前列腺癌在剥夺雄激素的同时,也剥夺了雌激素,会引起一系列雌激素剥夺毒性反应,如骨质疏松症、潮热、代谢异常等,而口服雌激素因其心血管毒性已基本弃用。而雌二醇透皮贴剂用于前列腺癌ADT治疗可能可以避免上述不良反应。III期临床实验PATCH (NCT00303784) 是从一项II期随机临床实验(n = 251,比较LHRHa/雌二醇透皮贴剂心脏毒性)的基础上扩展而来,纳入研究对象为局部晚期(1362例)和转移性(1128例)前列腺癌患者。研究结果显示雌二醇透皮贴剂组与LHRHa组相比,雄激素剥夺效果相似,而代谢指标、生活质量评分、骨健康指数(腰椎骨密度平均改变+7.9%/-3.0%,预估差异9.3% (95% CI:5.3-13.4))均明显改善。更为重要的是,二组心血管事件发生率、首次心血管事件发生时间均无明显差异(HR 1.11, 95% CI 0.80-1.53; P=0.54),肿瘤控制效果正在观察之中。
概述
免疫检查点抑制剂(immune checkpoint inhibitors, ICIs)是近年来恶性肿瘤治疗领域的一项重大突破,可显著改善多种恶性肿瘤的临床结局。ICIs主要通过阻断细胞毒性T淋巴细胞抗原-4(cytotoxic T lymphocyte-associatedantigen-4, CTLA-4)或程序性细胞死亡受体-1(programmed cell death-1, PD-1)/程序性细胞死亡配体-1(programmed cell death-ligand 1, PD-L1)途径激活T淋巴细胞,从而破坏肿瘤细胞,增强抗肿瘤免疫反应。ICIs治疗耐受性常较好,但也可产生一系列不良反应,称为免疫相关不良反应(immune-related adverse events, irAEs)。大多数irAEs往往是轻微的且具有自限性,但在少数严重病例(3级或4级)中,可能会发生危及生命的情况。内分泌系统不良反应是常见的irAEs之一,可累及甲状腺、垂体、胰岛、肾上腺等,其中甲状腺功能异常和垂体炎最常见。目前内分泌irAEs的发病机制、预测因素、irAEs的发生与肿瘤反应和生存改善之间的关系等尚未阐明。本报告就2023年度内分泌irAEs的最新进展以及未来可能的发展方向做一概览。
01 我国内分泌irAEs研究进展
1.1 本学科研究新进展
常俊佩等进行的一项回顾性研究探讨内分泌irAEs在真实世界中的发生情况及处理流程,结果显示204例实体瘤患者中12例患者出现内分泌irAEs,其中甲状腺功能异常最常见,9例(4.4%)出现甲状腺功能减退症,1例(0.5%)出现甲状腺毒症,中位发生时间分别为自第1次免疫药物治疗后7周、9周。另有1例(0.5%)1型糖尿病,1例(0.5%)肾上腺皮质功能减退症,中位发生时间分别为自第1次免疫药物治疗后6周、7周。12例患者按分级管理流程及时给予处理,症状均好转或恢复正常,后续均继续给予ICIs治疗。该研究表明ICIs使用过程中内分泌irAEs发生风险相对较高,尤其是甲状腺功能异常,需要治疗期间定期检测内分泌指标,及时处理并不会影响后续ICIs治疗。而王群等进行一项回顾性研究纳入26例接受PD-1抑制剂后出现内分泌irAEs的患者,结果显示PD-1抑制剂相关甲状腺功能异常发生率次于垂体炎,作者认为可能与选用的病例均为内分泌科住院患者、病情较重、对于无症状甲状腺功能异常或病情较轻的患者未在统计之列有关。
Shen等进行一项回顾性研究纳入23例ICIs相关糖尿病患者,34.8%(8/23)的患者在每个治疗周期监测血糖。严格血糖监测组中严重糖尿病酮症酸中毒(diabetic ketoacidosis,DKA)患者的比例低于非严格血糖监测组(16.7% vs. 55.6%),对20例患者进行高血糖病因鉴别检测,其中20%患者谷氨酸脱羧酶抗体(glutamic acid decarboxylase antibody,GADA)阳性,55%患者C肽<3.33pmol/L。半数ICIs相关糖尿病患者出现其他内分泌irAEs,其中最常见的是甲状腺炎。12例(52.2%)患者停用ICIs治疗,3例(13.0%)患者在发生糖尿病后中断ICIs治疗,继续治疗组和中断治疗组患者的肿瘤进展时间比停用ICIs的患者长(333.5±82.5天 vs. 183.1±62.4天)。值得注意的是仅17.4%的ICIs相关糖尿病患者完全按照指南进行管理。因此尽管目前已经制定了多种评估和治疗指南,但在临床实践中ICIs相关糖尿病的管理仍具有挑战性。
Wu等进行的回顾性研究纳入270例接受ICIs治疗的恶性肿瘤患者,中位随访时间为17.7个月,其中120例(44%)患者在免疫治疗后出现甲状腺功能异常,最常见的甲状腺irAEs是临床甲状腺功能减退症伴或不伴短暂性甲状腺毒症,其次是亚临床甲状腺毒症。甲状腺毒症中位发生时间为49天,甲状腺功能减退症中位发生时间为98天。在接受PD-1抑制剂治疗的患者中,年龄较小、基线TSH水平较高、既往甲状腺疾病与甲状腺功能减退症发生相关,甲状腺毒症仅与基线TSH水平相关。开始ICIs治疗后出现甲状腺功能异常与更好的PFS和OS相关。另外,抗甲状腺球蛋白抗体(anti-thyroglobulin antibody, TgAb)阳性会增加甲状腺irAEs的风险。
王一博等进行的一项回顾性研究评估晚期非小细胞肺癌(non-small cell lung cancer, NSCLC)患者应用ICIs后出现甲状腺功能异常的危险因素及其与疗效的关系,结果显示共有86例(43.10%)患者发生甲状腺功能异常,Logistic回归分析发现美国东部肿瘤协作组体能状态(Eastern Cooperative Oncology Group performance status, ECOG PS)、胸腔积液、乳酸脱氢酶(lactic dehydrogenase, LDH)是甲状腺功能异常发生的影响因素,甲状腺功能异常组患者相比于甲状腺功能正常组患者的中位无进展生存期(progression-free survival, PFS)显著延长,且甲状腺功能异常组的客观缓解率(objective response rate, ORR)和疾病控制率(disease control rate, DCR)均优于甲状腺功能正常组。Cox回归分析示ECOG PS、LDH、细胞角蛋白19片段、甲状腺功能异常是疗效的影响因素。该研究表明甲状腺功能异常可能是免疫治疗疗效的影响因素,接受免疫治疗后发生甲状腺功能异常的晚期NSCLC患者可能有更好的疗效。
张蕾等开展的一项回顾性研究纳入23例使用ICIs后出现垂体功能减退的肿瘤患者,结果显示23例患者均出现继发性肾上腺皮质功能减退,均未出现中枢性尿崩症。累及垂体-甲状腺轴者3例(13.0%),甲状腺功能正常者11例(47.8%),出现ICIs相关原发性甲状腺功能减退症9例(39.1%),累及垂体-性腺轴者4例(17.4%),该研究表明及时评估ICIs治疗中患者的垂体及靶腺功能有助于提高免疫治疗的安全性。
1.2国内相关重大计划和研究项目
为了观察真实世界中ICIs相关内分泌不良反应的发生情况及处理措施和流程,常俊佩等回顾性分析进行ICIs治疗的患者免疫相关内分泌不良反应的发生及处理,该研究表明ICIs使用过程中内分泌irAEs发生风险相对较高,尤其是甲状腺功能异常,需要治疗期间定期检测内分泌指标,及时处理并不会影响后续ICIs治疗,为临床提供参考。
02 国内外研究进展比较
2.1 国际内分泌irAEs研究现状
2.1.1 内分泌irAEs与肿瘤预后及生存预测相关研究进展
理论上,irAEs的发生意味着T细胞介导的免疫反应增强,因此irAEs的发生可能表明对ICIs治疗有更好的反应。部分文献报道发生内分泌irAEs的患者有更长的总生存期(overall survival,OS)和PFS。Benz等进行的一项回顾性研究纳入187例接受ICIs治疗的患者,大约半数患者出现至少一种irAEs,肺部和内分泌irAEs较为常见,出现内分泌或肠道irAEs的患者的OS显著延长。Nasca等进行的回顾性研究探讨irAEs与微卫星不稳定性转移性结直肠癌(microsatellite instability-high metastatic colorectal cancer,MSI mCRC)生存结果的关联,使用“负荷评分”(burden score)评估irAEs,结果显示在331例患者中,144例(43.5%)患者出现irAEs,中位随访时间29.7个月后,皮肤、内分泌和肌肉骨骼irAEs负荷较高的患者OS及PFS较长,而胃肠道、肺炎、神经系统、肝脏、肾脏和其他irAEs负荷较高者对OS及PFS具有不利影响,作者认为并非所有irAEs对OS及PFS产生积极的预后作用,可建立ICIs毒性模型(保护性和不利irAEs的负荷评分)可用作MSI mCRC患者对ICIs反应的替代临床标志物。然而,irAEs是否可作为免疫治疗疗效的有效替代仍存在争议,Amoroso等进行的一项荟萃分析探索irAEs对总生存期的替代作用,结果表明在不同癌症类型中,ICIs治疗对总体irAEs的影响与对OS的治疗效果之间存在不同程度的相关性,所有估计的相关性都是低强度的,进一步分析发现总体1-2级或3-4级irAEs发生率或特定(皮肤、胃肠道、内分泌)irAEs发生率的治疗效果之间没有显著关联。因此,需进一步阐明irAEs与生存获益之间关联机制。
2.1.2内分泌irAEs预测因素研究进展
目前尚无生物标志物可预测哪些患者可能会因ICIs治疗而出现内分泌irAEs。Taylor等总结文献研究提出B细胞和针对自体抗原的抗体有望成为预测肿瘤患者发生irAEs的生物标记物。Ruggeri等在意大利人群中进行的一项单中心回顾性研究结果显示,基线抗甲状腺自身抗体阳性、既往存在甲状腺疾病、存在甲状腺疾病家族史是甲状腺irAEs发生的独立预测因子,作者认为甲状腺irAEs可能是易感个体甲状腺疾病迅速进展的结果,预先存在的甲状腺自身免疫可能会增加甲状腺irAEs的风险。抗垂体抗体(anti-pituitary antibody,APA)是针对人垂体细胞的自身抗体,存在于一些自身免疫性垂体炎患者中,APA在与垂体炎相关自身免疫中的重要性已得到广泛认识。事实上,既往已有报道ICIs相关垂体炎患者体内出现多种针对促肾上腺皮质激素(adrenocorticotropic hormone , ACTH)细胞、促甲状腺激素细胞和促性腺激素细胞的垂体自身抗体,有学者认为ICIs相关垂体炎可能是副肿瘤综合征的一种形式。Urai等报道1例患者因大细胞神经内分泌癌转移而接受ICIs治疗,治疗后25周后出现孤立性ACTH缺乏症(isolated adrenocorticotropic hormone deficiency, IAD)。在肿瘤组织中观察到异位ACTH表达,并在患者血清中特异性检测到循环抗阿片黑素促皮质激素原(proopiomelanocortin,POMC)抗体。此外,使用患者血清进行免疫荧光染色分析显示,自身抗体的识别位点是ACTH25-39,这为鉴别与副肿瘤性自身免疫性ACTH缺乏症相关的抗体提供了新的见解。
2.1.3免疫检查点抑制剂相关糖尿病研究进展
Lee等利用使用三级医院数据库进行纵向轨迹分析比较接受ICIs的患者和接受传统化疗的患者新发糖尿病的风险,共纳入1326例患者,1105例接受传统化疗,221例接受ICIs治疗。ICIs组新发糖尿病的风险显著高于传统化疗组(OR=2.454,95%CI:1.528-3.940)。在ICIs组中,血糖模式增加的患者主要是男性,并且与ICIs治疗后淋巴细胞增多有关。作者认为接受ICIs治疗的患者,尤其是男性和ICIs治疗后淋巴细胞明显增多者,需要定期监测血糖水平,以尽早识别ICIs相关糖尿病。Shen等进行一项回顾性研究纳入23例ICIs相关糖尿病患者,34.8%(8/23)的患者在每个治疗周期监测血糖。严格血糖监测组中严重糖尿病酮症酸中毒(diabetic ketoacidosis,DKA)患者的比例低于非严格血糖监测组(16.7% vs. 55.6%),对20例患者进行高血糖病因鉴别检测,其中20%患者谷氨酸脱羧酶抗体(glutamic acid decarboxylase antibody,GADA)阳性,55%患者C肽<3.33pmol/L。半数ICIs相关糖尿病患者出现其他内分泌irAEs,其中最常见的是甲状腺炎。12例(52.2%)患者停用ICIs治疗,3例(13.0%)患者在发生糖尿病后中断ICIs治疗,继续治疗组和中断治疗组患者的肿瘤进展时间比停用ICIs的患者长(333.5±82.5天 vs. 183.1±62.4天)。值得注意的是仅17.4%的ICIs相关糖尿病患者完全按照指南进行管理。因此尽管目前已经制定了多种评估和治疗指南,但在临床实践中ICIs相关糖尿病的管理仍具有挑战性。
目前ICIs治疗在既往存在自身免疫性疾病人群中的安全性及有效性尚不明确,Hilder等进行的一项多中心回顾性研究纳入11例接受ICIs治疗、既往存在1型糖尿病(type 1 diabetes mellitus,T1DM)的肿瘤患者,平均年龄为50.6岁,63.6%为女性,大多数接受PD1/PDL1抑制剂单药治疗,3/11例患者出现3/4级irAEs,包括肝炎、肌炎和重症肌无力,3例患者均中断ICIs治疗并接受辅助治疗,包括糖皮质激素、静脉免疫球蛋白或吗替麦考酚酯,irAEs得到缓解。与未发生T1DM的匹配对照组相比,先前存在T1DM的患者所有级别和严重(3级或更高)irAEs的发生率相似,总生存率两组无显著差异。需要对既往患有T1DM的患者进行更大规模的前瞻性研究,以进一步明确既往存在自身免疫疾病患者ICIs治疗的安全性及有效性。
2.1.4免疫检查点抑制剂相关甲状腺功能异常研究进展
甲状腺功能异常是最常见的内分泌irAEs,其临床表现多样,Wu等进行的回顾性研究纳入270例接受ICIs治疗的恶性肿瘤患者,中位随访时间为17.7个月,其中120例(44%)患者在免疫治疗后出现甲状腺功能异常,最常见的甲状腺irAEs是临床甲状腺功能减退症伴或不伴短暂性甲状腺毒症,其次是亚临床甲状腺毒症。甲状腺毒症中位发生时间为49天,甲状腺功能减退症中位发生时间为98天。在接受PD-1抑制剂治疗的患者中,年龄较小、基线TSH水平较高、既往甲状腺疾病与甲状腺功能减退症发生相关,甲状腺毒症仅与基线TSH水平相关。开始ICIs治疗后出现甲状腺功能异常与更好的PFS和OS相关。另外,抗甲状腺球蛋白抗体(anti-thyroglobulin antibody, TgAb)阳性会增加甲状腺irAEs的风险。
既往研究表明首次ICIs治疗后6周内出现短暂性甲状腺毒症是ICIs单药治疗相关甲状腺irAEs的典型病程。Ueba等报道1例接受帕博利珠单抗(pembrolizumab)联合培美曲塞和卡铂治疗的患者中观察到甲状腺毒症延迟出现,发生在首次服用帕博利珠单抗后22周。Ueba等进一步开展一项回顾性队列研究以阐明与ICIs和化疗联合治疗相关的甲状腺irAEs的临床特征,纳入207例接受帕博利珠单抗和84例接受阿替利珠单抗(atezolizumab)的患者,并分为帕博利珠单抗或阿替利珠单抗单药治疗组和帕博利珠单抗或阿替利珠单抗联合化疗组,结果表明,甲状腺irAEs的发生率并未因联合化疗而改变,另外,仅在帕博利珠单抗或阿替利珠单抗联合化疗中观察到迟发性甲状腺irAEs(定义为首次ICIs剂量后16周或更长时间发生),提示当ICIs与化疗联合使用时,甲状腺irAEs可能会延迟发生,需要更长时间监测甲状腺功能。
既往研究表明ICIs治疗后甲状腺18F-氟脱氧葡萄糖的摄取增加可能提示存在甲状腺irAEs。Galligan等进行回顾性研究纳入127例接受联合ICIs治疗的晚期黑色素瘤患者,结果显示在开始ICIs治疗后平均3周,43/127 (34%) 的患者诊断为甲状腺炎。在基线和治疗开始后中位11周(范围3-32)时进行18F-氟脱氧葡萄糖正电子发射断层扫描/计算机断层扫描(18F-fluorodeoxyglucose positron emission tomography/computed tomography,FDG-PET/CT)。ROC分析显示,FDG-PET/CT检测甲状腺炎的曲线下面积为0.87(95%CI:0.80-0.94),阳性预测值为93%。在有甲状腺炎生化证据的患者中,FDG-PET/CT呈阳性的患者更有可能出现临床甲状腺功能减退症,这提示在初始甲状腺毒症阶段之后持续强烈的炎症反应可能表明甲状腺受到破坏。
2.1.5免疫检查点抑制剂相关肾上腺皮质功能障碍研究进展
Kurokawa等在日本人群中进行的一项回顾性研究纳入186例接受帕博利珠单抗治疗的患者,结果显示有59例患者临床上疑诊肾上腺皮质功能不全,10例(5.4%)确诊,症状包括低钠血症(9例)、疲劳(8例)和纳差(6例)。所有患者的ACTH水平均较低,5例患者被诊断为孤立性ACTH缺乏症。所有患者在糖皮质激素替代治疗后完全康复。肾上腺皮质功能不全发病的中位时间为8.0个月。这些患者的中位PFS为22.4个月,本研究中报道帕博利珠单抗治疗的患者中肾上腺功能障碍的发生率比以前报道的更高。此外,继发性肾上腺皮质功能不全,特别是孤立性ACTH缺乏症,是帕博利珠单抗治疗后出现的肾上腺功能障碍的主要形式。
2.2 国际新技术发展现状
2.2.1甲状腺irAEs发病机制研究进展
目前甲状腺irAEs的发病机制尚未完全阐明。Pollack等通过在NSCLC小鼠模型使用RNA测序分析靶向αPD-1和αPD-L1的单克隆抗体诱导的甲状腺转录组变化,结果显示,尽管αPD-1和αPDL-1治疗均显示出抗肿瘤反应,但只有αPD-1治疗诱导了显著的转录变化,αPD-1治疗后有952个差异表达基因(differentially expressed genes,DEGs),而αPD-L1治疗后仅有35个DEGs。进一步分析显示,在αPD-1治疗的952个DEGs中,有362个与细胞死亡和存活功能相关,包括预计激活凋亡和坏死途径以及负向激活细胞活力和细胞存活率途径。与白细胞介素-1β和干扰素γ处理的人甲状腺细胞的数据集相比,细胞凋亡途径被激活,然而观察到与器官炎症和上游调节细胞因子相关的独特变化。上述研究证实与αPD-1治疗相关的甲状腺基因表达存在独特的变化,ICIs诱导的甲状腺功能异常可能是由组织细胞凋亡增加介导,导致破坏性甲状腺炎。Wu等研究了正常甲状腺细胞(normal thyroid cells,NTHY)的体外机制,结果显示纳武利尤单抗(nivolumab)导致G1期阻滞并减少游离甲状腺素(free thyroxine, FT4)分泌,通过下调PD-1和上调干扰素γ增加NTHY细胞免疫敏感性,磷酸化蛋白激酶1(phosphorylated protein kinase 1,AKT1)是NIVO调节NTHY细胞免疫敏感性的关键蛋白,纳武利尤单抗通过下调AKT1-S期激酶相关蛋白2(S-Phase kinase associated protein 2,SKP2)抑制PD-L1并促进干扰素γ,从而促进CD8 +T淋巴细胞聚集至甲状腺并增加杀伤力,该研究证实PD-1抑制剂通过调节AKT1-SKP2诱导甲状腺irAEs,并增加甲状腺细胞的免疫敏感性。
考虑到ICIs治疗的机制,irAEs可能更易发生在肿瘤高表达PD-L1的患者中。Horesh等进行的一项单中心回顾性研究纳入107例接受PD-1或PD-L1抑制剂治疗的晚期NSCLC患者,评估患者因素、肿瘤PD-L1表达和分子谱与甲状腺irAEs发生之间的关系,结果显示37例患者(34.6%)出现甲状腺功能异常,肿瘤PD-L1染色强度与甲状腺irAEs无关,未观察肿瘤PD-L1表达与甲状腺irAEs之间的关联,另外PD-L1表达与甲状腺irAEs发生时间并无相关性。
2.3 国际重大研究计划和重大研究项目
Bersanelli等进行的一项前瞻性研究(PROVIDENCE)纳入164例患者,在队列1中,由101例基线时维生素缺乏(≤30 ng/ml)的患者组成,其中70.1%在三个月的重新评估中获得了足够的胆钙化醇补充。第2组由63例患者组成,自免疫治疗开始后的中位时间为3.7个月,没有患者的维生素D水平充足(> 30 ng/ml)。即使在第2组中,系统补充也使77.8%的患者在三个月的重新评估中达到了足够的水平。与由238例未系统补充维生素D的患者组成的回顾性对照组相比,PROVIDENCE队列1显示出更长的OS、治疗失败时间和更高的疾病控制率。进一步分析显示,PROVIDENCE队列1患者与对照组相比死亡风险(HR=0.55,95%CI:0.34–0.90)和治疗中断风险(HR=0.61,95%CI:0.40–0.91)显著降低,在较长的治疗暴露范围内,PROVIDENCE队列1中任何级别的irAEs的累积发生率较高,但队列1患者的所有级别甲状腺irAEs风险均显著降低(OR=0.16,95% CI:0.03-0.85)。
03 我国研究现存优势与不足
3.1 存在的优势
我国作为世界人口最多的国家之一,具有庞大的患者群体,有助于开展大规模的临床研究,收集更多的数据和案例。中国人群的遗传背景、生活方式和环境等因素与西方国家有所不同,研究结果可能为全球范围内的免疫治疗提供更多的参考价值。
3.2 存在的不足
由于监测和报告系统的不完善,导致对内分泌irAEs的实际发生率和严重程度的了解不足。对于内分泌系统免疫相关不良反应的长期影响和后续发展情况的研究还相对不足,缺乏足够的长期随访数据。目前开展性研究多为回顾性研究,样本量相对较小,针对内分泌系统免疫相关不良反应的大规模临床试验仍相对较少,缺乏长期随访和前瞻性研究。
01 PI3K/AKT/mTOR信号通路:
1.1 PI3K/AKT/mTOR在糖脂代谢中的作用
1.1.1调节葡萄糖代谢:AKT激活可促进细胞对葡萄糖的摄取和利用,通过促进葡萄糖转运体GLUT4的移位至细胞膜表面,增加细胞葡萄糖摄取。同时,AKT还能够促进糖原合成酶的活性,从而促进葡萄糖的储存为糖原。
1.1.2调节脂质代谢:mTORC1是mTOR复合体的一个重要亚单位,它在脂质代谢中发挥着重要作用。mTORC1的活化可促进脂肪酸和甘油三酯的合成,并抑制脂解酶活性,从而促进脂肪的合成和储存。
1.1.3调节胰岛素信号通路:AKT是胰岛素信号通路的一个关键分子,它在细胞内传递胰岛素的信号,调节糖代谢和脂质代谢。通过激活AKT,PI3K/AKT/mTOR信号通路可以增强胰岛素的作用,从而调节血糖水平和脂质代谢。
1.2 PI3K/AKT/mTOR通过糖脂代谢在肺癌中的作用
1.2.1 非小细胞肺癌
蛋白磷酸化和去磷酸化之间的动态平衡由受体酪氨酸激酶(RTKs)和蛋白酪氨酸磷酸酶(PTPs)的活性控制。这种酶活性的变化在肿瘤发生中起着关键作用。RTKs被认为是各种恶性肿瘤的致癌因素。癌变RTKs可以通过不同机制激活下游信号通路并介导肿瘤细胞的代谢重编程,从而影响肿瘤的糖酵解。在非小细胞肺癌患者临床患者组织样本中,PTPRH的表达水平高,并与肿瘤直径和临床分期密切相关。PTPRH改变了细胞行为,抑制了凋亡,并促进了18F-FDG的摄取、乳酸的产生以及糖酵解相关蛋白的表达。此外,通过使用LY294002和740Y-P(分别为PI3K的抑制剂和激动剂)评估,发现PTPRH通过PI3K/AKT/mTOR信号通路调节NSCLC细胞的糖代谢。这些结果在裸鼠体内使用异种移植肿瘤模型进行了验证。通过裸鼠皮下移植肿瘤模型,利用免疫组化染色法测定了PTPRH、糖酵解相关蛋白、p-PI3K/PI3K和p-AKT/AKT的蛋白表达水平。研究结果显示,PTPRH通过PI3K/AKT/mTOR信号通路促进了NSCLC的糖酵解、增殖、迁移和侵袭,最终促进了肿瘤的进展,这可以通过LY294002和740Y-P来调节。靶向PI3K/AKT/mTOR信号通路成为潜在的治疗靶点,Kirsty J McMillan等人研究发现白藜芦醇通过主要抑制AKT信号通路介导的HK2表达来损害葡萄糖代谢,NSCLC细胞中外源性过表达恒定激活的AKT1信号通路明显减轻了白藜芦醇诱导的糖酵解抑制。体内数据表明,白藜芦醇显著抑制了裸鼠移植瘤模型中的肿瘤生长。
1.2.2 小细胞肺癌
小细胞肺癌(SCLC)以高转移率和不良预后为特征。铂类化疗仍然是治疗的基石;然而,几乎所有患者都会产生获得性耐药性。研究发现PI3K/AKT/mTOR途径在SCLC中频繁活化,并且与SCLC对放疗的耐药性密切相关。这条途径是癌细胞葡萄糖代谢的重要调节因子,其激活可能通过影响SCLC中的生物能量过程而影响放疗耐药性。葡萄糖代谢有三个主要支路——有氧糖酵解、氧化磷酸化和己糖磷酸通路——参与放疗的耐药性。PI3K/AKT/mTOR途径与葡萄糖代谢之间的相互作用主要通过缺氧诱导因子 1(HIF-1)信号传导来影响葡萄糖代谢,参与放疗耐药性,包括抑制己糖磷酸通路的限速酶的泛素化。
1.3.PI3K/AKT/mTOR通过糖脂代谢在肝细胞癌中的作用
1.3.1 糖代谢
肝细胞肝癌(HCC)是肝癌的?种主要形式,也是全球癌症相关死亡的主要原因之?。迫切需要对HCC的病理?理学和药物作?机制有新的认识,以改善患者的预后。由于HCC经历了葡萄糖代谢的代谢重编程,从正常细胞的氧化磷酸化到肿瘤细胞的有氧糖酵解,这种现象被称为“Warburg效应”,是癌症的?个标志,?持癌细胞的快速??、存活和侵袭。有报道称,mTOR的机械靶点(Mechanistic target of rapamycin, mTOR)是细胞??和代谢的主控制器,通过依赖HIF1α的糖酵解酶转录来促进“Warburg效应”。AKT/mTOR信号通路在肝癌发展中扮演关键作用,通常驱动着肝癌的发展,并与糖代谢活性增加密切相关,表明其在肝细胞癌生长过程中的重要性。葡萄糖代谢在肝癌细胞中通过PI3K/AKT/mTOR信号通路参与调节,包括促进糖酵解等活动。抑制AKT/mTOR信号通路可降低肝癌细胞的活动力,减少葡萄糖消耗和乳酸产生,进而抑制肿瘤生长。葡萄糖代谢途径的通过糖酵解和磷酸戊糖途径(PPP)两条途径被分解,其中PPP在肝细胞癌细胞增殖和生长中发挥着关键作用。除了AKT/mTOR信号通路外,其他信号通路如PI3K/AKT信号通路也参与了PPP代谢途径的调节。最后,乳酸代谢与干细胞癌细胞的代谢和存活密切相关,与PI3K/AKT通路的活动相关联。这些发现揭示了葡萄糖和乳酸代谢在肝癌发展中的重要性,以及不同信号通路在调控肿瘤代谢中的作用。
1.3.2 脂代谢
脂质代谢在肿瘤的生长和生物合成中起着重要作用,因为脂质提供能量和中间物质,同时构成细胞膜的组成部分。AKT/mTOR信号通路的激活可以触发关键脂肪酸相关基因的转录,促进肝癌细胞的脂肪酸合成,而AKT/mTOR/SREBP-1信号通路则是调节肝细胞脂质代谢的关键途径。抑制与脂质合成相关的关键酶和蛋白可减少肝癌细胞的增殖和存活,尤其是AKT依赖的细胞增殖。此外,胰岛素和生长因子通过AKT/mTOR/SREBP信号通路与肿瘤相关物质的生产相关联,而在缺氧的肿瘤微环境中,激活的AKT/mTOR信号通路导致脂质合成和积聚,促进了肝癌的发展。NRF2也参与了肝脂质代谢的调节,促使生长因子基因的转录,进而通过自分泌信号转导促进AKT激活,从而控制肝葡萄糖和脂质代谢。这些发现突显了脂质代谢及其调节在肝癌发展中的重要性,同时揭示了多种信号通路在肿瘤脂质代谢中的相互作用。
1.4 PI3K/AKT/mTOR通过糖脂代谢在乳腺癌中的作用
CPNE1通过激活AKT-mTOR信号通路调控多个信号通路,可以刺激细胞增殖和分化。此外,CPNE1与多种癌症相关,然而,其在乳腺癌中,特别是三阴性乳腺癌(TNBC)中的作用尚未完全阐明。研究发现CPNE1的高表达与TNBC患者的不良预后相关。CPNE1的敲除降低了TNBC细胞的存活能力、迁移、侵袭和增殖能力。此外,代谢组学分析显示葡萄糖代谢是最主要的途径,并且CPNE1的敲除显著限制了TNBC细胞的糖酵解活性。在小鼠模型中验证了这些结论。此外过表达CPNE1并用PI3K抑制剂(LY294002)处理TNBC细胞系。结果显示,CPNE1通过PI3K/AKT/HIF-1α信号通路促进了TNBC细胞的有氧糖酵解。这表明CPNE1调节了细胞糖酵解并参与了TNBC的发展。在其他研究中,通过建立小鼠结直肠癌、胰腺癌、黑色素瘤等多种移植瘤模型,以及结直肠癌自发成瘤模型、乳腺癌自发成瘤模型等不同实体瘤模型,观察到在寒冷暴露下,小鼠的棕色脂肪得到显著激活。基因富集分析及代谢组分析显示,寒冷暴露导致棕色脂肪组织中葡萄糖代谢显著上调,而肿瘤组织中的葡萄糖代谢则被显著抑制,其中包括PI3K及mTOR信号的下调。这些研究结果表明,寒冷激活棕色脂肪组织,通过血糖竞争机制,有效抑制了肿瘤生长:降低了葡萄糖的来源,削弱了肿瘤对葡萄糖的摄取能力。
02 AMPK信号通路:
AMPK(AMP-activated protein kinase)是一种重要的能量传感器,它在细胞能量代谢平衡中起着关键作用。AMPK信号通路可以被活化的方式包括:增加AMP/ATP比例、Ca 2+ 水平的增加以及一些激酶(如LKB1)的磷酸化等。一旦AMPK被活化,它会通过调节多种靶点来影响糖脂代谢和细胞生存。在肿瘤形成中,AMPK的作用与其在糖脂代谢中的调节密切相关。AMPK在细胞代谢平衡中的调节作用能够影响细胞的生存和增殖,从而影响肿瘤的形成。一般来说,AMPK的活化被认为是一种抑制肿瘤形成的因素,它能够抑制细胞增殖、促进细胞凋亡、抑制新血管生成等。相反,AMPK的抑制可能促进肿瘤形成,因为它可能导致细胞代谢紊乱、增加细胞增殖等。
Yan Ding等人的研究发现,在能量应激条件下,AMP激活蛋白激酶(AMPK)在Ser1077位点磷酸化INF2,导致INF2在ER(雌激素受体)中的局部化增加,并增强了动态素相关蛋白1(DRP1)对线粒体的招募。INF2在Ser1077位点的AMPK介导的磷酸化促进了线粒体分裂并促进了EC(子宫内膜癌)细胞的生长。通过免疫组化分析的病理检查在EC标本中显示AMPK活性与INF2的磷酸化(Ser1077)呈正相关。Chen等人研究发现萝卜硫素(SFN)诱导的过多活性氧(ROS)产生激活了AMPK信号通路,并促进了Nrf2的转位,从而抑制了胰腺癌细胞的细胞活力。使用AMPK信号通路的小分子抑制剂复合物C预处理逆转了Nrf2的亚细胞转位,并挽救了细胞的侵袭能力。通过裸鼠和胰腺癌转基因小鼠,确定SFN可以抑制肿瘤的进展,在SFN治疗组中,肿瘤更小,进展较慢。
03 HIF-1信号通路:
HIF-1(hypoxia-inducible factor 1)是一种重要的转录因子,它在低氧环境下被激活,并参与调节细胞对低氧环境的适应性反应。除了调节氧气稳态以外,HIF-1也参与调节细胞的糖代谢、脂质代谢以及肿瘤的形成和发展。氧气供应不足(缺氧)导致电子传递链增加活性氧(ROS)的产生。HIF-1介导对缺氧的适应性代谢反应的机制,包括通过增加糖酵解途径的通量和减少三羧酸循环的通量,以减少线粒体ROS的产生。HIF-1还介导通过丝氨酸合成途径和线粒体一碳代谢(叶酸循环)增加线粒体抗氧化物质(NADPH和谷胱甘肽)的产生。在应对缺氧或细胞毒性化疗时,动态维持ROS稳态对于诱导乳腺癌干细胞表型至关重要。在乳腺癌细胞中抑制丝氨酸合成途径的第一个酶磷酸甘油醛脱氢酶会影响肿瘤的发生、转移和对细胞毒性化疗的响应。
04 Wnt/β-catenin信号通路:
肿瘤的发生过程中,肿瘤细胞展现出与正常细胞不同的代谢模式。这种异常的代谢改变被称为肿瘤的代谢重编程。Wnt信号通路是调节细胞增殖和分化的关键信号通路之一。近年来,人们发现Wnt信号参与了通过影响代谢重编程来促进恶性肿瘤的发生和发展。研究发现DKK4调控葡萄糖诱导的肝细胞癌典型Wnt信号通路的激活。同时,在裸鼠体内记录膀胱癌细胞的生长情况。对临床和异种移植肿瘤组织标本进行了免疫组化染色。发现SMAR1在膀胱癌患者中下调表达,与较差的预后相关。SMAR1敲除增强了膀胱癌细胞的活性、增殖、迁移、侵袭、上皮间质转化(EMT)和Warburg效应。SMAR1通过抑制Wnt/β-连环蛋白信号通路的活性来抑制膀胱癌的进展。
05 PPARs信号通路:
5.1 PPARs在糖脂代谢中的作用
PPARs(peroxisome proliferator-activated receptors)是一类核受体,包括α、β/δ和γ三个亚型,它们在调节脂质和糖代谢、细胞增殖和分化等生理过程中发挥重要作用。PPARs通过调节基因转录来影响多种代谢途径,包括脂质代谢、糖代谢以及炎症反应等。
5.1.1调节糖代谢: PPARs通过调节糖代谢酶的表达和活性,影响葡萄糖的吸收、利用和代谢。例如,PPARγ可以抑制糖异生途径,促进葡萄糖摄取和利用,从而抑制肿瘤细胞的生长和增殖。
5.1.2调节脂质代谢: PPARs可以促进脂肪酸的氧化代谢和脂质分解,抑制脂质合成途径,从而影响肿瘤细胞的生长和存活。
5.1.3抗炎作用: PPARs具有抗炎作用,可以通过抑制炎症因子的产生和炎症信号通路的激活,抑制肿瘤的发生和发展。
5.1.4调节细胞增殖和凋亡:PPARs通过调节细胞增殖和凋亡相关基因的表达,影响肿瘤细胞的生长和存活。
5.1.5抑制血管生成:PPARs可以抑制肿瘤血管生成,从而抑制肿瘤的生长和转移。
5.2 卵泡膜细胞瘤
在卵泡膜细胞瘤中表现为明显的脂肪积聚和过氧化物酶体增殖物激活受体γ(PPARγ)的表达增加。通过建立了小鼠卵泡膜细胞瘤模型,发现了ooPIK3CA*卵泡膜细胞瘤模型中的代谢异常,并暗示过氧化物酶体增殖物激活受体γ可能是原发性卵泡膜细胞瘤生长的潜在驱动因素。Zhang等人研究发现PPARδ直接调节中性氨基酸转运蛋白SLC1-A5(溶质载体家族1成员5)和葡萄糖转运蛋白-1(Glut1)基因的转录,导致葡萄糖和氨基酸的摄取,mTOR信号的激活和肿瘤的进展。相反,PPARδ的沉默或其拮抗剂抑制了这一事件。更重要的是,PPARδ促进了癌细胞代谢重编程,导致化疗耐药性,而PPARδ拮抗剂能够减轻这种耐药性。
概述
随着变革性诊断和管理方案的引入,甲状腺癌的管理进入一个全新时代。为了减少不必要的活检,国际上已经开发出几种基于超声的甲状腺结节风险分层系统。低危甲状腺癌手术治疗的替代方案如主动监测和热消融已得到应用。已有越来越多高质量的证据证实了靶向治疗、免疫治疗甚至二者联合治疗等新的系统性疗法用于晚期甲状腺癌的疗效。本报告从甲状腺癌的术前诊断以及多种类型甲状腺癌的管理等方面,就2023年度内分泌甲状腺肿瘤的最新进展以及未来可能的发展方向做一概览。
01 我国甲状腺肿瘤研究进展
1.1 甲状腺癌术前诊断
超声诊断是用于诊断甲状腺结节良恶性的一种常用非侵入性检查方法。2015年,美国放射协会发布甲状腺影像报告和数据系统(ACR TI-RADS),根据超声学特征对甲状腺结节进行风险分层,推荐评分为3、4、5的结节行细针穿刺细胞学检测。2023年中华内分泌学会发布的甲状腺结节和分化型甲状腺癌诊治指南将C-TIRADS评级分为6类,4c类提示甲状腺结节有超过50%的恶性风险。
国内张水兴团队通过比较ACR-TIRADS、C-TIRADS和EU-TIRADS发现,C-TIRADS在甲状腺癌诊断中表现卓越,具有比ACR-TIRADS和EU-TIRADS更高的辨别性能,尤其在减少不必要穿刺检查方面效果显著。鲁可等在超声和组织病理分析的基础上,发现对于未确定或疑似甲状腺结节,采用两种TIRADS联合检测可以提高诊断准确性。在存在两种TIRADS的诊断不一致情况下,特别关注回声特征有助于区分良性和恶性结节。梁平团队通过分析7个中心的FTA和FTC超声特征,开发一种用于评定滤泡性甲状腺肿瘤的影像和数据系统(F-TIRADS),评分高于7分提示滤泡性甲状腺肿瘤的恶性风险大于50%。
分子检测已被用于甲状腺结节的诊断,尤其是对于细胞学不能确定的甲状腺结节。傅国栋等通过对甲状腺结节患者的BRAF V600E和TERT启动子变体进行定量分子测定,发现BRAF V600E或TERT启动子突变有较高的肿瘤阳性诊断率,有BRAFV600E或TERT启动子变体的高VAF或两种变体在任何VAF下共存时,甲状腺结节的恶性肿瘤会增加高危组织病理学特征的可能性。
基因测序技术可以分析甲状腺癌组织中的基因表达谱,用于区分不同亚型的甲状腺癌、预测患者的预后。国内徐辉雄教授等进行了一项多中心的临床研究,包括550名通过细针穿刺评估和组织病理学证实的甲状腺结节患者。通过定量显色印迹基因原位杂交(QCIGISH),评估印迹基因SNRPN和HM13的等位基因表达,他们证明了SNRPN和HM13的组合在甲状腺结节的术前诊断中具有最有效的诊断价值。这种基于印记生物标志物的测试能够有效区分恶性和良性甲状腺结节,为术前诊断提供了有效的工具。
此外,人工智能在甲状腺癌诊断方面取得了显著进展,利用图像识别、深度学习和大数据分析等技术,能够提高医学影像的分析准确性,辅助医生进行临床决策,并推动个性化医疗。利用大数据分析,AI可以从大规模的医疗数据中学习,识别潜在的风险因素、疾病模式和治疗效果。这有助于个性化医疗,为患者提供更精准的诊断和治疗方案。
1.2 低危PTC的管理
热消融治疗低危PTC也取得了显著的成果。Yan等进行多中心回顾性研究,结果发现,RFA组和MWA组在疾病进展、VRR、肿瘤消失率或并发症方面无显著差异。在77.2个月的中位随访期间,疾病进展的发生率、淋巴结转移率和复发率分别为3.6%、1.1%和2.5%。接受RFA治疗的T1bN0M0 PTC也有和T1a相似的疾病进展率和5年无复发生存率。此外,热消融对于BRAFV600E突变和包膜侵犯的单灶PTMC也是有效和安全的治疗方法。在选定的单侧多灶PTMC患者中,RFA可能是一种安全和有效的手术替代方法。一项中位随访时间72.9的回顾性研究显示,RFA和手术组的疾病进展(4.5% vs 3.8%;P≥0.999)、淋巴结转移率(2.3% vs 3.8%;P≥0.999)、持续性病变(2.3% vs 0%;P=0.272)和RFS率(97.7% vs 96.2%;P=0.673)无统计学差异。在T1N0M0 PTC患者中也有类似发现。
对于低危PTMC热消融后局部肿瘤进展的危险因素也有部分研究进行探索。Ren等进行5年的单中心队列研究,结果显示初始消融比可能是MWA后PTMC局部肿瘤进展的预测因素。Yan等对RFA治疗的T1N0M0 PTC回顾性分析,结果肿瘤大小和包膜下位置是与持续性病变相关的预测因素。但此类研究结论仍需进一步验证。在规范严格的热消融治疗下,如果患者出现局部肿瘤进展,也不会影响后续的手术管理。
1.3 MTC的管理
单独的超声检查预测MTC淋巴结转移的灵敏度为89.36%,特异性为70.69%。术后癌胚抗原和降钙素预测颈部淋巴结转移的截断值分别为7.115 ng/mL和13.185 pg/mL。超声结合术后血清癌胚抗原和降钙素,可以使特异性提高到91.38%和87.93%,灵敏度为95.45%。多因素逻辑分析显示超声提示可疑淋巴结和术后降钙素高于13.185 pg/mL是MTC术后颈部淋巴结转移的危险因素。
1.4 晚期甲状腺癌的靶向治疗
晚期甲状腺癌的靶向治疗主要通过抑制特定分子靶点来阻断肿瘤的生长和扩散,包括酪氨酸激酶抑制剂、甲状腺激素受体抑制剂、免疫检查点抑制剂以及放射性碘治疗。林岩松等进行了一项随机、双盲的随机对照研究,对191名RAIR-DTC患者进行了比较,结果显示达拉非尼在改善患者的无进展生存期、客观缓解率和疾病控制率方面效果显著。
02 国内外研究进展比较
2.1 甲状腺癌术前诊断
国际内分泌协会和超声介入协会等,基于美国ACR-TIRADS评分系统,在甲状腺结节的成分、回声、形状、边缘、是否侵犯包膜和钙化方面达成国际专家共识,发表了甲状腺结节超声词典。此共识建立了国际甲状腺影像报告和数据系统(I-TIRADS),并作为通用风险分层系统的基础。
细胞学检测是判断甲状腺结节良恶性的,中国甲状腺细针穿刺细胞病理学诊断专家共识提到,评级Ⅴ类为可疑恶性肿瘤,Ⅵ类为恶性肿瘤。在2023年更新的Bethesda系统中,新增了儿童甲状腺癌恶性风险、细胞分子检测以及甲状腺结节的临床和影像学特征。两者在评级分类中存在差异,中国共识中Ⅳ类包括滤泡性肿瘤或可疑滤泡性肿瘤,而第3版Bethesda系统在Ⅵ类中多出了鳞状细胞癌、混合型癌和非霍奇金淋巴瘤。
2.2 低危PTC的管理
Miyauchi等纳入3222名接受AS的低危PTMC患者和2424名接受立即手术患者,结果显示在AS组中,10年和20年的肿瘤增长率为4.7%和6.6%,淋巴结转移率分别为1.0%和1.6%。394名患者接受延迟手术,其中41.4%因为医生偏好,23.9%由于疾病进展。在手术组中,10年和20年的淋巴结转移率分别为0.4%和0.7%,1.4%(18/1327)的患者出现残留甲状腺复发。AS组的LNMs明显高于手术组(10年和20年分别为1.1% vs. 0.4%和1.7% vs. 0.7%;P=0.009),但差异很小。接受AS的低危PTMC患者的长期肿瘤结果与接受立即手术患者没有明显差异。AS期间弥漫性甲状腺疾病(HR: 2.3, 95%CI, 1.4-3.7, P=0.001)和瘤内血管分布(HR: 1.7, 95%CI, 1.0-3.0, P=0.04)与PTMC患者肿瘤进展相关。此外,延迟手术有增加PTMC疾病进展风险的可能性。研究显示与立即手术组相比,AS后接受延迟手术组患者肿瘤体积更大(P=0.002)、淋巴管侵犯率较高(P=0.002)和多灶性(P=0.008)。但两组间甲状腺全切除率、术后甲状旁腺功能减退症和声带麻痹的发生率没有显著差异(分别为P=0.283、P=0.184和P=0.284)。在韩国医疗体系中,早期手术比AS更具成本效益,但对于中国医疗系统而言,AS对PTMC的终生监测更具成本效益。
Scappaticcio等提供了RFA治疗低危PTMC的动态风险分层,Li等定义了RFA治疗PTMC的消融反应系统,为临床消融患者随访提供了诊疗建议。
生活质量方面,荟萃分析显示,与手术相比,接受热消融或AS的低危PTC患者的复发和特定疾病的死亡风险相当,但选择AS的患者有更高的生活质量,当将AS或RFA与手术进行比较时,没有观察到实质性差异。
2.3 MTC的管理
近期GLP-1 RA与甲状腺癌的相关性受到广泛关注。Bezin等通过巢氏病例对照研究,纳入2562例甲状腺癌患者,与45184名对照患者相匹配,结果发现使用GLP-1 RAs 1-3年与所有甲状腺癌(HR: 1.58, 95% CI: 1.27-1.95)和甲状腺髓样癌(HR:1.78, 95% CI: 1.04-3.05)的风险增加相关。但也有评论指出由于GLP-1 RA有可能导致甲状腺癌发病率适度相对增加,但不能排除检测偏差作为替代解释。在没有特定甲状腺癌危险因素的人群中,GLP-1 RA的益处将大大超过其危害。Bea等基于人群的队列研究使用了2014-2020年韩国国民健康保险数据库的索赔数据,结果显示GLP-1 RAs和DPP-4i与2型糖尿病患者甲状腺癌风险增加无关。不同研究间尚存在争议,目前仍缺乏足够的证据表明GLP-1 RAs和DPP-4i药物的使用与人类甲状腺癌之间的相关性。
2.4 晚期甲状腺癌的靶向治疗
美国Rosenberg等的二期临床研究纳入110名RAIR-DTC患者,观察了单用西地尼布和西地尼布联合来那度胺两组的PFS和总生存期,结果显示西地尼布可以显著改善RAIR-DTC患者的PFS和总生存期。
RET作为一种激酶抑制剂可以减缓或抑制肿瘤生长,塞尔帕替尼是一种高选择性、强效的RET抑制剂,在一项1-2期试验中显示对晚期REBEL突变甲状腺髓样癌有效。Hadoux等在一项3期临床研究中,通过对比塞尔帕替尼与卡博替尼或凡德他尼的疗效,将291名患者进行了随机分组,结果显示塞尔帕替尼组在PFS、无治疗失败生存率和总体缓解率方面明显优于对照组。因此,塞尔帕替尼在治疗患有RET突变型甲状腺髓样癌的患者中表现更为出色。
2.5 我国研究现存优势与不足
2.5.1 存在的优势
我国作为世界人口最多的国家之一,具有庞大的患者群体,有助于开展大规模的临床研究,收集更多的数据和案例。中国是最大的甲状腺肿瘤消融研究中心之一,研究结果可能为各国的研究提供更多的参考价值。
2.5.2 存在的不足
由于技术的严格要求,国内现有展开消融队列的研究中心仍有限,缺乏足够的长期随访数据。对于甲状腺肿瘤采取积极监测治疗的长期随访队列尚缺乏,且尚没有对手术、积极监测、热消融治疗低危PTC的治疗对比研究。同时,此类研究缺乏对患者心理状态、生活质量的评估。鉴于患者病情需要和治疗选择偏好,目前开展性研究多为回顾性研究,缺乏高质量研究证据的临床研究。
【主编】
周 琦 重庆大学附属肿瘤医院
【副主编】
李乃适 中国医学科学院北京协和医院
王树森 中山大学附属肿瘤医院
李因涛 山东省肿瘤医院
蔡建良 国家应急总医院
徐书杭 江苏省中西医结合医院
【编委】(按姓氏拼音排序)
陈 兵 陆军军医大学第一附属医院
李 林 重庆大学附属肿瘤医院
杨 雁 华中科技大学附属同济医院
缪洪明 陆军军医大学
杨梦柳 重庆医科大学附属第二医院
鹿 斌 复旦大学附属华山医院
向 阳 中国医学科学院北京协和医院
吴绮楠 重庆医科大学附属大足医院
秦健勇 广州医科大学第三附属医院荔湾医院
邹冬玲 重庆大学附属肿瘤医院
李 冲 重庆医科大学附属大足医院
任虞洁 江苏省中西医结合医院内分泌科
参考文献(References)
[1] RUGO H S, BARDIA A, MARMÉ F, et al. Overall survival with sacituzumabgovitecan in hormone receptor-positive and human epidermal growth factor receptor 2-negative metastatic breast cancer (TROPiCS-02): a randomised, open-label, multicentre, phase 3 trial[J]. Lancet, 2023, 402(10411):1423-1433.
[2] CORTÉS J, MARMÉ F, SCHMID P, et al.Efficacy and safety analyses by prior lines of chemotherapy from the phase III TROPiCS-02 study of sacituzumabgovitecan (SG) vs treatment of physician's choice (TPC) in patients (pts) with HR+/HER2- metastatic breast cancer (mBC)[J]. Ann Oncol, 2023, 34:S343-S344.
[3]OKAJIMA D, YASUDA S, MAEJIMA T, et al. Datopotamabderuxtecan, a novel TROP2-directed antibody-drug conjugate, demonstrates potent antitumor activity by efficient drug delivery to tumor cells[J]. Mol Cancer Ther, 2021, 20(12):2329-2340.
[4]BARDIA A, JHAVERI K, IM S A, et al. LBA11 Datopotamabderuxtecan (Dato-DXd) vs chemotherapy in previously-treated inoperable or metastatic hormone receptor-positive, HER2-negative (HR+/HER2-) breast cancer (BC): primary results from the randomised phase III TROPION-Breast01 trial [J]. Ann Oncol, 2023, 34:S1264-S1265.
[5] OUYANG Q, YIN Y, SONG L, et al. 380MO SKB264 (MK-2870) in previously treated hormone receptor-positive (HR+)/ HER2-negative metastatic breast cancer (mBC): results from a phase Ⅰ/Ⅱ, single-arm, basket trial[J]. Ann Oncol, 2023, 34:S337.
[6] JOHNSTON S R D, TOI M, O'SHAUGHNESSY J, et al. Abemaciclib plus endocrine therapy for hormone receptor-positive, HER2-negative, node-positive, high-risk early breast cancer (monarchE): results from a preplanned interim analysis of a randomised, open-label, phase 3 trial [J]. Lancet Oncol, 2023, 24(1):77-90.
[7] HARBECK N, RASTOGI P, O'SHAUGHNESSY J, et al. LBA17 Adjuvant abemaciclib plus endocrine therapy for HR+, HER2-, high-risk early breast cancer: results from a preplanned monarchE overall survival interim analysis, including 5-year efficacy outcomes[J]. Ann Oncol, 2023, 34(Suppl 2):S1254-S1335.
[8] SLAMON D J, STROYAKOVSKIY D, YARDLEY D A, et al. Ribociclib and endocrine therapy as adjuvant treatment in patients with HR+/HER2- early breast cancer: primary results from the phase Ⅲ NATALEE trial[J]. J Clin Oncol, 2023, 41(Suppl 17):LBA500-LBA500.
[9] BARDIA A, HORTOBAGYI G N, LIPATOV O, et al. LBA23 invasive disease–free survival (iDFS) across key subgroups from the phase Ⅲ NATALEE study of ribociclib (RIB) + a nonsteroidal aromatase inhibitor (NSAI) in patients (pts) with HR+/HER2-early breast cancer (EBC)[J]. Ann Oncol, 2023, 34:S1261-S1262.
[10] SONKE G S, NIJHOF A V O, WORTELBOER N, et al. Primary outcome analysis of the phase 3 SONIA trial (BOOG 2017-03) on selecting the optimal position of cyclin-dependent kinases 4 and 6 (CDK4/6) inhibitors for patients with hormone receptor-positive (HR+), HER2-negative (HER2-) advanced breast cancer (ABC)[J]. J Clin Oncol, 2023, 41(Suppl 17): LBA1000-LBA1000.
[11] LLOMBART-CUSSAC A, HARPER-WYNNE C, PERELLO A, et al. Second-line endocrine therapy (ET) with or without palbociclib (P) maintenance in patients (pts) with hormone receptor-positive (HR[+])/human epidermal growth factor receptor 2-negative (HER2[-]) advanced breast cancer (ABC): PALMIRA trial[J]. J Clin Oncol, 2023, 41(Suppl 17): 1001-1001.
[12] XU B, ZHANG Q, LUO Y, et al. LEONARDA-1: phase III randomized study of lerociclib plus fulvestrant in patients with HR+, HER2- locally advanced or metastatic breast cancer that has progressed on prior endocrine therapy[J]. J Clin Oncol, 2023, 41(Suppl 16):1017-1017.
[13] Kogawa T,NoguchiE,YamanakaT,et al. Palbociclib (P) plus tamoxifen (TAM) ± goserelin in women with hormone receptor-positive (HR+)/HER2-negative (HER2-) advanced breast cancer (ABC): primary results of NCCH1607/PATHWAY, an Asian international double-blind randomized phase 3 trial [J]. J Clin Oncol, 2023, 41(Suppl 17): LBA1068-LBA1068.
[14] LOI S, CURIGLIANO G, SALGADO R F, et al. LBA20 A randomized, double-blind trial of nivolumab (NIVO) vs placebo (PBO) with neoadjuvant chemotherapy (NACT) followed by adjuvant endocrine therapy (ET) ± NIVO in patients (pts) with high-risk, ER+ HER2− primary breast cancer (BC) [J]. Ann Oncol, 2023, 34: S1259-S1260.
[15] CARDOSO F, MCARTHUR H L, SCHMID P, et al. LBA21 KEYNOTE-756: Phase III study of neoadjuvant pembrolizumab (pembro) or placebo (pbo) + chemotherapy (chemo), followed by adjuvant pembro or pbo+ endocrine therapy (ET) for early-stage high-risk ER+/HER2– breast cancer [J]. Ann Oncol, 2023, 34: S1260-S1.
[16].Sung H, Ferlay J, Siegel RL, et al. Global Cancer Statistics 2020: GLOBOCAN Estimates of Incidence and Mortality Worldwide for 36 Cancers in 185 Countries. CA Cancer J Clin. 2021. 71(3): 209-249.
[17].Matei D, Filiaci V, Randall ME, et al. Adjuvant chemotherapy plus radiation for locally advanced endometrial cancer. N Engl J Med 2019;380:2317-26.
[18].Miller DS, Filiaci VL, Mannel RS, et al. Carboplatin and paclitaxel for advanced endometrial cancer: Final overall survival and adverse event analysis of a phase III trial (NRG Oncology/GOG0209). J Clin Oncol 2020;38:3841-50.
[19].Concin N, Matias-Guiu X, Vergote I, et al. ESGO/ESTRO/ESP guidelines for the management of patients with endometrial carcinoma. Int J Gynecol Cancer. 2021. 31(1): 12-39.
[20].Berek JS, Matias-Guiu X, Creutzberg C, et al. FIGO staging of endometrial cancer: 2023. Int J Gynaecol Obstet. 2023. 162(2): 383-394.
[21].Pignata S, Scambia G, Schettino C, et al. Carboplatin and paclitaxel plus avelumab compared with carboplatin and paclitaxel in advanced or recurrent endometrial cancer (MITO END-3): a multicentre, open-label, randomised, controlled, phase 2 trial. Lancet Oncol. 2023. 24(3): 286-296.
[22].Eskander RN, Sill MW, Beffa L, et al. Pembrolizumab plus Chemotherapy in Advanced Endometrial Cancer. N Engl J Med. 2023. 388(23): 2159-2170.
[23].Mirza MR, Chase DM, Slomovitz BM, et al. Dostarlimab for Primary Advanced or Recurrent Endometrial Cancer. N Engl J Med. 2023. 388(23): 2145-2158.
[24].Westin SN, Moore K, Chon HS, et al. Durvalumab Plus Carboplatin/Paclitaxel Followed by Maintenance Durvalumab With or Without Olaparib as First-Line Treatment for Advanced Endometrial Cancer: The Phase III DUO-E Trial. J Clin Oncol. 2023 : JCO2302132.
[25].Nicoletta Colombo, et al. ESMO 2023, LBA 40.
[26].Makker V, Colombo N, Casado Herráez A, et al. Lenvatinib plus Pembrolizumab for Advanced Endometrial Cancer. N Engl J Med. 2022. 386(5): 437-448.
[27].Makker V, Colombo N, Casado Herráez A, et al. Lenvatinib Plus Pembrolizumab in Previously Treated Advanced Endometrial Cancer: Updated Efficacy and Safety Fromthe Randomized Phase III Study 309/KEYNOTE-775. J Clin Oncol. 2023. 41(16): 2904-2910.
[28].O'Malley DM, Bariani GM, Cassier PA, et al. Pembrolizumab in Patients With Microsatellite Instability-High Advanced Endometrial Cancer: Results From the KEYNOTE-158 Study. J Clin Oncol. 2022. 40(7): 752-761.
[29].Matei D, Filiaci V, Randall ME, et al. Adjuvant Chemotherapy plus Radiation for Locally Advanced Endometrial Cancer. N Engl J Med. 2019. 380(24): 2317-2326.
[30].Matei D, et al. Overall Survival in NRG Oncology GOG258, a Randomized Phase III Trial of Chemo-Radiation vs. Chemotherapy Alone for Locally Advanced Endometrial Carcinoma. SGO 2023.
[31].Vergote I, Pérez-Fidalgo JA, Hamilton EP, et al. Oral Selinexor as Maintenance Therapy After First-Line Chemotherapy for Advanced or Recurrent Endometrial Cancer. J Clin Oncol. 2023. 41(35): 5400-5410.
[32].Wang HY,Tian WJ,Ren YL,et al. Camrelizumab plus apatinib in patients with advanced or recurrent endometrial cancer after failure of at least one prior systemic therapy (CAP 04):a single-arm phase Ⅱ trial[C]. Chicago,USA,2023 ASCO Annual Meeting.
[33].Zeng Z,Wei W,Cui LY,et al. Overall survival and subsequent therapy from a phase II study of sintilimab and anlotinib in pa?tients with advanced or recurrent endometrial cancer[C]. Chicago,USA,2023 ASCO Annual Meeting.
[34].Yuan GW,Li ZP,Ye F,et al. A multicenter,single-arm, phase 2 study of surufatinib plus toripalimab for patients with advanced endometrial cancer[C]. Chicago,USA,2023 ASCO Annual Meeting
[35].F. Joly Lobbedez1, A. Leary2, I.L. Ray-Coquard, et al. Olaparib vs placebo as maintenance therapy after platinumbased chemotherapy in advanced/metastatic endometrial cancer patients: The GINECO randomized phase IIb UTOLA trial. 2023 ESMO. Abstract LBA 42.
[36].Hussain M, Tombal B, Saad F, et al. Darolutamide Plus Androgen-Deprivation Therapy and Docetaxel in Metastatic Hormone-Sensitive Prostate Cancer by Disease Volume and Risk Subgroups in the Phase III ARASENS TrialJ Clin Oncol, 2023,41(20):3595-3607.
[37].Chowdhury S, Bjartell A, Agarwal N, et al. Deep, rapid, and durable prostate-specific antigen decline with apalutamide plus androgen deprivation therapy is associated with longer survival and improved clinical outcomes in TITAN patients with metastatic castration-sensitive prostate cancer. Ann Oncol, 2023, 34(5):477-485.
[38].Freedland SJ, de Almeida Luz M, De Giorgi U, et al. Improved Outcomes with Enzalutamide in Biochemically Recurrent Prostate Cancer.N Engl J Med, 2023, 389(16):1453-1465.
[39].Yorozu A, Namiki M, Saito S, Egawa S,et al. Trimodality Therapy With Iodine-125 Brachytherapy, External Beam Radiation Therapy, and Short- or Long-Term Androgen Deprivation Therapy for High-Risk Localized Prostate Cancer: Results of a Multicenter, Randomized Phase 3 Trial. Int J Radiat Oncol Biol Phys, 2024, 118(2):390-401.
[40].De La Cerda J, Dunshee C, Gervasi L, et al. A Phase I Clinical Trial Evaluating the Safety and Dosing of Relugolix with Novel Hormonal Therapy for the Treatment of Advanced Prostate Cancer. arget Oncol, 2023, 18(3):383-390.
[41].MacLean CM, Ulys A, Jankevi?ius F, et al. Safety, Pharmacokinetic and Pharmacodynamic Evaluation of Teverelix for the Treatment of Hormone-Sensitive Advanced Prostate Cancer: Phase 2 Loading-Dose-Finding Studies. Medicina (Kaunas), 2023, 59(4):681.
[42].Gilbert DC, Nankivell M, Rush H, et al. A Repurposing Programme Evaluating Transdermal Oestradiol Patches for the Treatment of Prostate Cancer Within the PATCH and STAMPEDE Trials: Current Results and Adapting Trial Design.Clin Oncol (R Coll Radiol), 2024, 36(1):e11-e19.
[43] PARDOLL D M. The blockade of immune checkpoints in cancer immunotherapy [J]. Nat Rev Cancer, 2012, 12(4): 252-64.
[44] RAMOS-CASALS M, BRAHMER J R, CALLAHAN M K, et al. Immune-related adverse events of checkpoint inhibitors [J]. Nat Rev Dis Primers, 2020, 6(1): 38.
[45] CHANG L S, BARROSO-SOUSA R, TOLANEY S M, et al. Endocrine Toxicity of Cancer Immunotherapy Targeting Immune Checkpoints [J]. Endocr Rev, 2019, 40(1): 17-65.
[46] BARROSO-SOUSA R, BARRY W T, GARRIDO-CASTRO A C, et al. Incidence of Endocrine Dysfunction Following the Use of Different Immune Checkpoint Inhibitor Regimens: A Systematic Review and Meta-analysis [J]. JAMA Oncol, 2018, 4(2): 173-82.
[47] 常俊佩, 陈露, 吴通, 等. 免疫检查点抑制剂相关内分泌不良反应的发生及处理: 一项单中心真实世界研究[J]. 中国全科医学, 2023, 26(17): 2095-2101.
[48] 王群, 蒋晶晶, 陆志强, 等. 程序性死亡受体-1抑制剂相关内分泌腺体疾患26例临床特征分析[J]. 江苏大学学报(医学版), 2023, 33(02): 156-161.
[49] 王一博, 王新娟, 程琳, 等. 晚期非小细胞肺癌患者应用免疫治疗后出现甲状腺功能异常与疗效的相关性分析[J]. 中国肺癌杂志, 2023, 26(05): 369-376.
[50] 张蕾, 李晓牧, 陈弘. 免疫检查点抑制剂相关垂体功能减退临床特征[J]. 中国临床医学, 2023, 30(03): 449-453.
[51] BENZ S, SHERMAN K A, DASANU C A, et al. Immune checkpoint inhibitor-related adverse events: Real-world experience from a single veterans' affairs medical center [J]. J Oncol Pharm Pract, 2023: 10781552231184178.
[52] NASCA V, BARRETTA F, CORTI F, et al. Association of immune-related adverse events with the outcomes of immune checkpoint inhibitors in patients with dMMR/MSI-H metastatic colorectal cancer [J]. J Immunother Cancer, 2023, 11(1).
[53] AMOROSO V, GALLO F, ALBERTI A, et al. Immune-related adverse events as potential surrogates of immune checkpoint inhibitors' efficacy: a systematic review and meta-analysis of randomized studies [J]. ESMO Open, 2023, 8(2): 100787.
[54] TAYLOR J, GANDHI A, GRAY E, et al. Checkpoint inhibitor immune-related adverse events: A focused review on autoantibodies and B cells as biomarkers, advancements and future possibilities [J]. Front Immunol, 2022, 13: 991433.
[55] RUGGERI R M, SPAGNOLO C C, ALIBRANDI A, et al. Predictors of thyroid adverse events during cancer immunotherapy: a real-life experience at a single center [J]. J Endocrinol Invest, 2023, 46(11): 2399-409.
[56] RICCIUTI A, DE REMIGIS A, LANDEK-SALGADO M A, et al. Detection of pituitary antibodies by immunofluorescence: approach and results in patients with pituitary diseases [J]. J Clin Endocrinol Metab, 2014, 99(5): 1758-66.
[57] BANDO H, KANIE K, TAKAHASHI Y. Paraneoplastic autoimmune hypophysitis: An emerging concept [J]. Best Pract Res Clin Endocrinol Metab, 2022, 36(3): 101601.
[58] KANIE K, IGUCHI G, BANDO H, et al. Mechanistic insights into immune checkpoint inhibitor-related hypophysitis: a form of paraneoplastic syndrome [J]. Cancer Immunol Immunother, 2021, 70(12): 3669-77.
[59] URAI S, WATANABE M, BANDO H, et al. Paraneoplastic isolated adrenocorticotropic hormone deficiency revealed after immune checkpoint inhibitors therapy: new insights into anti-corticotroph antibody [J]. Front Immunol, 2023, 14: 1284301.
[60] LEE M, JEONG K, PARK Y R, et al. Increased risk of incident diabetes after therapy with immune checkpoint inhibitor compared with conventional chemotherapy: A longitudinal trajectory analysis using a tertiary care hospital database [J]. Metabolism, 2023, 138: 155311.
[61] SHEN M, CHEN D, ZHAO R, et al. Real-world adherence to toxicity management guidelines for immune checkpoint inhibitor-induced diabetes mellitus [J]. Front Endocrinol (Lausanne), 2023, 14: 1213225.
[62] HILDER R, TSAI K, QUANDT Z, et al. Safety and efficacy of immune checkpoint inhibitor cancer therapy in patients with preexisting type 1 diabetes mellitus [J]. Front Endocrinol (Lausanne), 2023, 14: 1242830.
[63] WU L, XU Y, WANG X, et al. Thyroid dysfunction after immune checkpoint inhibitor treatment in a single-center Chinese cohort: a retrospective study [J]. Endocrine, 2023, 81(1): 123-33.
[64] YAMAUCHI I, YASODA A, MATSUMOTO S, et al. Incidence, features, and prognosis of immune-related adverse events involving the thyroid gland induced by nivolumab [J]. PLoS One, 2019, 14(5): e0216954.
[65] UEBA Y, YAMAUCHI I, HAKATA T, et al. Delayed-onset immune-related adverse events involving the thyroid gland by immune checkpoint inhibitors in combination with chemotherapy: a case report and retrospective cohort study [J]. Endocr J, 2023, 70(3): 323-32.
[66] ESHGHI N, GARLAND L L, NIA E, et al. (18)F-FDG PET/CT Can Predict Development of Thyroiditis Due to Immunotherapy for Lung Cancer [J]. J Nucl Med Technol, 2018, 46(3): 260-4.
[67] GALLIGAN A, WALLACE R, KRISHNAMURTHY B, et al. Increased Thyroidal Activity on Routine FDG-PET/CT after Combination Immune Checkpoint Inhibition: Temporal Associations with Clinical and Biochemical Thyroiditis [J]. Cancers (Basel), 2023, 15(24).
[68] KUROKAWA K, MITSUISHI Y, SHIMADA N, et al. Clinical characteristics of adrenal insufficiency induced by pembrolizumab in non-small-cell lung cancer [J]. Thorac Cancer, 2023, 14(5): 442-9.
[69] POLLACK R, STOKAR J, LISHINSKY N, et al. RNA Sequencing Reveals Unique Transcriptomic Signatures of the Thyroid in a Murine Lung Cancer Model Treated with PD-1 and PD-L1 Antibodies [J]. Int J Mol Sci, 2023, 24(13).
[70] WU Y, LI J, YANG X, et al. Immunosensitivity mediated by downregulated AKT1-SKP2 induces anti-PD-1-associated thyroid immune injury [J]. Int Immunopharmacol, 2023, 121: 110452.
[71] HORESH A, POLLACK R, NECHUSHTAN H, et al. Tumor PD-L1 expression and molecular profiling are not associated with immune checkpoint inhibitor-induced thyroid dysfunction in advanced NSCLC patients [J]. Pathol Oncol Res, 2023, 29: 1610951.
[72] BERSANELLI M, CORTELLINI A, LEONETTI A, et al. Systematic vitamin D supplementation is associated with improved outcomes and reduced thyroid adverse events in patients with cancer treated with immune checkpoint inhibitors: results from the prospective PROVIDENCE study [J]. Cancer Immunol Immunother, 2023, 72(11): 3707-16.
[73]Manning, B.D. and A. Toker, AKT/PKB Signaling: Navigating the Network. Cell, 2017. 169(3): p. 381-405.
[74].Hong, S.Y., et al., Oncogenic activation of the PI3K/Akt pathway promotes cellular glucose uptake by downregulating the expression of thioredoxin-interacting protein. Cell Signal, 2016. 28(5): p. 377-383.
[75].Laplante, M. and D.M. Sabatini, mTOR signaling in growth control and disease. Cell, 2012. 149(2): p. 274-93.
[76].Wang, S., et al., PTPRH promotes the progression of non-small cell lung cancer via glycolysis mediated by the PI3K/AKT/mTOR signaling pathway. J Transl Med, 2023. 21(1): p. 819.
[77].Li, W., et al., Resveratrol inhibits Hexokinases II mediated glycolysis in non-small cell lung cancer via targeting Akt signaling pathway. Exp Cell Res, 2016. 349(2): p. 320-327.
[78].Krencz, I., et al., Progression and metastasis of small cell lung carcinoma: the role of the PI3K/Akt/mTOR pathway and metabolic alterations. Cancer Metastasis Rev, 2021. 40(4): p. 1141-1157.
[79].Cheng, J., et al., TRIM21 and PHLDA3 negatively regulate the crosstalk between the PI3K/AKT pathway and PPP metabolism. Nat Commun, 2020. 11(1): p. 1880.
[80].Zhangyuan, G., et al., VersicanV1 promotes proliferation and metastasis of hepatocellular carcinoma through the activation of EGFR-PI3K-AKT pathway. Oncogene, 2020. 39(6): p. 1213-1230.
[81].Tian, L.Y., D.J. Smit, and M. Jucker, The Role of PI3K/AKT/mTOR Signaling in Hepatocellular Carcinoma Metabolism. Int J Mol Sci, 2023. 24(3).
[82].Luo, X., et al., The fatty acid receptor CD36 promotes HCC progression through activating Src/PI3K/AKT axis-dependent aerobic glycolysis. Cell Death Dis, 2021. 12(4): p. 328.
[83].Cao, J., et al., CPNE1 mediates glycolysis and metastasis of breast cancer through activation of PI3K/AKT/HIF-1alpha signaling. Pathol Res Pract, 2023. 248: p. 154634.
[84].Seki, T., et al., Brown-fat-mediated tumour suppression by cold-altered global metabolism. Nature, 2022. 608(7922): p. 421-428.
[85].Jeon, S.M. and N. Hay, The double-edged sword of AMPK signaling in cancer and its therapeutic implications. Arch Pharm Res, 2015. 38(3): p. 346-57.
[86].Ding, Y., et al., Phosphorylation of INF2 by AMPK promotes mitochondrial fission and oncogenic function in endometrial cancer. Cell Death Dis, 2024. 15(1): p. 65.
[87].Chen, X., et al., Activation of Nrf2 by Sulforaphane Inhibits High Glucose-Induced Progression of Pancreatic Cancer via AMPK Dependent Signaling. Cell Physiol Biochem, 2018. 50(3): p. 1201-1215.
[88].Semenza, G.L., Hypoxia-inducible factors in physiology and medicine. Cell, 2012. 148(3): p. 399-408.
[89].Semenza, G.L., Hypoxia-inducible factors: coupling glucose metabolism and redox regulation with induction of the breast cancer stem cell phenotype. EMBO J, 2017. 36(3): p. 252-259.
[90].Mo, Y., et al., The role of Wnt signaling pathway in tumor metabolic reprogramming. J Cancer, 2019. 10(16): p. 3789-3797.
[91].Chouhan, S., et al., Glucose induced activation of canonical Wnt signaling pathway in hepatocellular carcinoma is regulated by DKK4. Sci Rep, 2016. 6: p. 27558.
[92].Bao, P., et al., SMAR1 inhibits proliferation, EMT and Warburg effect of bladder cancer cells by suppressing the activity of the Wnt/beta-catenin signaling pathway. Cell Cycle, 2023. 22(2): p. 229-241.
[93].Yu, S.Y., et al., Metabolic characteristics of granulosa cell tumor: role of PPARgamma signaling. Biol Reprod, 2023.
[94].Zhang, W., et al., PPARdelta promotes tumor progression via activation of Glut1 and SLC1-A5 transcription. Carcinogenesis, 2017. 38(7): p. 748-755.
[95]. Grant EG, Tessler FN, Hoang JK, Langer JE, Beland MD, Berland LL, Cronan JJ, Desser TS, Frates MC, Hamper UM et al: Thyroid Ultrasound Reporting Lexicon: White Paper of the ACR Thyroid Imaging, Reporting and Data System (TIRADS) Committee. J Am Coll Radiol 2015, 12(12 Pt A):1272-1279.
[96].中华医学会内分泌学分会, 中华医学会外科学分会甲状腺及代谢外科学组, 中国抗癌协会头颈肿瘤专业委员会, 中华医学会核医学分会, 中国抗癌协会甲状腺癌专业委员会, 中国医师协会外科医师分会甲状腺外科医师委员会, 中华医学会超声医学分会: 甲状腺结节和分化型甲状腺癌诊治指南(第二版). 中华内分泌代谢杂志2023, 39(03):181-226.
[97].Yan L, Zhen Y, Li Y, Li X, Xiao J, Jing H, Luo Y: Five-year Outcome Between Radiofrequency Ablation vs. Surgery for Unilateral Multifocal Papillary Thyroid Microcarcinoma. J Clin Endocrinol Metab 2023.
[98].Lu K, Wang L, Lai S, Chen Z, Cong S, Huang C, Gan K, Guan H, Kuang J: A new discriminant strategy combined with four TIRADS screening procedures increases ultrasound diagnostic accuracy-focusing on "wrong diagnostic" thyroid nodules. Eur Radiol 2023, 33(2):784-796.
[99].Li J, Li C, Zhou X, Huang J, Yang P, Cang Y, Zhai H, Huang R, Mu Y, Gou X et al: US Risk Stratification System for Follicular Thyroid Neoplasms. Radiology 2023, 309(2):e230949.
[100].Fu G, Chazen RS, Monteiro E, Vescan A, Freeman JL, Witterick IJ, MacMillan C: Facilitation of Definitive Cancer Diagnosis With Quantitative Molecular Assays of BRAF V600E and TERT Promoter Variants in Patients With Thyroid Nodules. JAMA Netw Open 2023, 6(7):e2323500.
[101].Xu H, Zhang Y, Wu H, Zhou N, Li X, Pineda JP, Zhu Y, Fu H, Ying M, Yang S et al: High Diagnostic Accuracy of Epigenetic Imprinting Biomarkers in Thyroid Nodules. J Clin Oncol 2023, 41(6):1296-1306.
[102].Xu W, Jia X, Mei Z, Gu X, Lu Y, Fu CC, Zhang R, Gu Y, Chen X, Luo X et al: Generalizability and Diagnostic Performance of AI Models for Thyroid US. Radiology 2023, 307(5):e221157.
[103].Liao J, Gui Y, Li Z, Deng Z, Han X, Tian H, Cai L, Liu X, Tang C, Liu J et al: Artificial intelligence-assisted ultrasound image analysis to discriminate early breast cancer in Chinese population: a retrospective, multicentre, cohort study. EClinicalMedicine 2023, 60:102001.
[104].Zheng G, Zhang H, Lin F, Zafereo M, Gross N, Sun P, Liu Y, Sun H, Wu G, Wei S et al: Performance of CT-based deep learning in diagnostic assessment of suspicious lateral lymph nodes in papillary thyroid cancer: a prospective diagnostic study. Int J Surg 2023, 109(11):3337-3345.
[105].Yan L, Liu Y, Li W, Zhu Y, Wang J, Zhang M, Tang J, Che Y, Wang H, Wang S et al: Long-term Outcomes of Ultrasound-guided Thermal Ablation for the Treatment of Solitary Low-risk Papillary Thyroid Microcarcinoma: A Multicenter Retrospective Study. Ann Surg 2023, 277(5):846-853.
[106].Yan L, Li Y, Li XY, Xiao J, Tang J, Luo Y: Clinical outcomes of ultrasound-guided radiofrequency ablation for solitary T1N0M0 papillary thyroid carcinoma: A retrospective study with more than 5 years of follow-up. Cancer 2023, 129(16):2469-2478.
[107].Lin Y, Wu ZR, Shi YP, Ding M, Tang XY, He Y, Zhai B, Li P: Radiofrequency Ablation of Unifocal Papillary Thyroid Microcarcinoma With BRAF V600E Mutation. J Clin Endocrinol Metab 2023, 108(11):e1298-e1305.
[108].Zheng L, Dou JP, Han ZY, Liu FY, Yu J, Cheng ZG, Yu XL, Wang H, Cong ZB, Wang SR et al: Microwave Ablation for Papillary Thyroid Microcarcinoma with and without US-detected Capsule Invasion: A Multicenter Prospective Cohort Study. Radiology 2023, 307(3):e220661.
[109].Zhao ZL, Dong G, Wang SR, Liu Y, He JF, Shi LL, Guo JQ, Wang ZH, Cong ZB, Liu LH et al: Efficacy and safety of microwave ablation for the treatment of multifocal versus unifocal T1N0M0 papillary thyroid carcinoma: a propensity-matched multicentre retrospective study. Eur Radiol 2023, 33(12):8727-8735.
[110].Ren Y, Han X, Li Y, Chen G, Jiang L, Liu C, Xu S: Initial ablation ratio predicts the recurrence of low-risk papillary thyroid microcarcinomas treated with microwave ablation: a 5-year, single-institution cohort study. Endocr Connect 2023, 12(9).
[111].Li X, Li Y, Yan L, Xiao J, Yang Z, Jing H, Zhang M, Luo Y: Sonographic Evolution and Pathologic Findings of Papillary Thyroid Cancer After Radiofrequency Ablation: A Five-Year Retrospective Cohort Study. Thyroid 2023.
[112].Li X, Li J, Qiao Z, Yan L, Xiao J, Li Y, Zhang M, Luo Y: Rigorous radiofrequency ablation can completely treat low-risk small papillary thyroid carcinoma without affecting subsequent surgical management. Eur Radiol 2023, 33(6):4189-4197.
[113].Xiao J, Jiang J, Chen W, Hong T, Li B, He X, Liu W: Combination of ultrasound and serological tests for detecting occult lateral lymph node metastases in medullary thyroid cancer. Cancer Med 2023, 12(10):11417-11426.
[114].Lin Y, Qin S, Yang H, Shi F, Yang A, Han X, Liu B, Li Z, Ji Q, Tang L et al: Multicenter Randomized Double-Blind Phase III Trial of Donafenib in Progressive Radioactive Iodine-Refractory Differentiated Thyroid Cancer. Clin Cancer Res 2023, 29(15):2791-2799.
[115].Durante C, Hegedüs L, Na DG, Papini E, Sipos JA, Baek JH, Frasoldati A, Grani G, Grant E, Horvath E et al: International Expert Consensus on US Lexicon for Thyroid Nodules. Radiology 2023, 309(1):e231481.
[116].甲状腺细针穿刺细胞病理学诊断专家共识编写组, 中华医学会病理学分会细胞病理学组: 甲状腺细针穿刺细胞病理学诊断专家共识(2023版). 中华病理学杂志2023, 52(5):441-446.
[117].Ali SZ, Baloch ZW, Cochand-Priollet B, Schmitt FC, Vielh P, VanderLaan PA: The 2023 Bethesda System for Reporting Thyroid Cytopathology. Thyroid 2023, 33(9):1039-1044.
[118].Miyauchi A, Ito Y, Fujishima M, Miya A, Onoda N, Kihara M, Higashiyama T, Masuoka H, Kawano S, Sasaki T et al: Long-Term Outcomes of Active Surveillance and Immediate Surgery for Adult Patients with Low-Risk Papillary Thyroid Microcarcinoma: 30-Year Experience. Thyroid 2023, 33(7):817-825.
[119].Lee JY, Kim JH, Kim YK, Lee CY, Lee EK, Moon JH, Choi HS, Yul H, Cho SW, Kim SJ et al: US Predictors of Papillary Thyroid Microcarcinoma Progression at Active Surveillance. Radiology 2023, 309(1):e230006.
[120].Hwang H, Choi JY, Yu HW, Moon JH, Kim JH, Lee EK, Kim YK, Lee CY, Cho SW, Chung EJ et al: Surgical Outcomes in Patients With Low-risk Papillary Thyroid Microcarcinoma From MAeSTro Study: Immediate Operation Versus Delayed Operation After Active SurveillanceA Multicenter Prospective Cohort Study. Ann Surg 2023, 278(5):e1087-e1095.
[121].Baek HS, Ha J, Kim K, Bae J, Kim JS, Kim S, Lim DJ, Kim C: Cost-Effectiveness of Active Surveillance Compared to Early Surgery of Small Papillary Thyroid Cancer: A Retrospective Study on a Korean Population. J Korean Med Sci 2023, 38(34):e264.
[122].Lai M, Zhang MM, Qin QQ, An Y, Li YT, Yuan WZ: Cost-effectiveness of active surveillance versus early surgery for thyroid micropapillary carcinoma based on diagnostic and treatment norms in China. Front Endocrinol (Lausanne) 2023, 14:1166433.
[123].Scappaticcio L, Bellastella G: Dynamic risk stratification system provides a new paradigm to properly manage low-risk papillary thyroid microcarcinoma treated with radiofrequency ablation. Eur Radiol 2023.
[124].Li X, Yan L, Xiao J, Li Y, Yang Z, Zhang M, Luo Y: Follow-up strategy of radiofrequency ablation for papillary thyroid microcarcinoma: defining a response-to-ablation system. Eur Radiol 2023.
[125].Ledesma-Leon T, Solis-Pazmino P, Lincango EP, Figueroa LA, Ellenhorn J, Nasseri Y, Cohen J, Romero-Arenas M, Garcia C, Sanabria A et al: Ablation techniques or active surveillance compared to surgical resection in patients with low-risk papillary thyroid cancer: a systematic review and meta-analysis. Endocrine 2023.
[126].Bezin J, Gouverneur A, Penichon M, Mathieu C, Garrel R, Hillaire-Buys D, Pariente A, Faillie JL: GLP-1 Receptor Agonists and the Risk of Thyroid Cancer. Diabetes Care 2023, 46(2):384-390.
[127].Thompson CA, Sturmer T: Putting GLP-1 RAs and Thyroid Cancer in Context: Additional Evidence and Remaining Doubts. Diabetes Care 2023, 46(2):249-251.
[128].Bea S, Son H, Bae JH, Cho SW, Shin JY, Cho YM: Risk of thyroid cancer associated with glucagon-like peptide-1 receptor agonists and dipeptidyl peptidase-4 inhibitors in patients with type 2 diabetes: A population-based cohort study. Diabetes Obes Metab 2024, 26(1):108-117.
[129].Rosenberg AJ, Liao CY, Karrison T, de Souza JA, Worden FP, Libao B, Krzyzanowska MK, Hayes DN, Winquist E, Saloura V et al: A multicenter, open-label, randomized, phase II study of cediranib with or without lenalidomide in iodine 131-refractory differentiated thyroid cancer. Ann Oncol 2023, 34(8):714-722.
[130].Hadoux J, Elisei R, Brose MS, Hoff AO, Robinson BG, Gao M, Jarzab B, Isaev P, Kopeckova K, Wadsley J et al: Phase 3 Trial of Selpercatinib in Advanced RET-Mutant Medullary Thyroid Cancer. N Engl J Med 2023, 389(20):1851-1861.