中国抗癌协会
立即下载App《中国恶性肿瘤学科发展报告(2023)》——儿童肿瘤研究进展篇

1、概述
儿童肿瘤主要分为血液肿瘤和实体肿瘤两大类。儿童血液系统恶性肿瘤是一类起源于造血系统的肿瘤性疾病,严重地威胁儿童及家庭的身心健康。《国家儿童肿瘤监测年报(2022)》显示:2019-2020我国儿童肿瘤平均发病率为125.72/百万,前三位疾病中两种为血液系统恶性肿瘤即白血病和淋巴瘤[1]。按照儿童肿瘤的年龄标化发病率:我国儿童白血病发病率为35.6/百万,淋巴瘤6.4/百万,尤以急性白血病更多见。儿童恶性实体肿瘤主要包括神经母细胞瘤、横纹肌肉瘤、骨肿瘤、肾母细胞瘤、肝母细胞瘤、颅外生殖细胞瘤、视网膜母细胞瘤以及脑肿瘤等。这些肿瘤通常具有生长迅速、侵袭性强和易转移等的特点,对儿童的健康和生命造成严重威胁。规范儿童肿瘤疾病诊治流程,进一步提高疗效,改善患儿生存质量,是关系到肿瘤患儿生存及生活质量的重大民生问题。
近年来,随着医学技术的不断进步,儿童肿瘤的诊断和治疗取得了长足进展。神经母细胞瘤作为婴儿最常见的肿瘤和儿童常见肿瘤,其治疗策略已经从传统的手术、化疗和放疗逐渐转向针对特定靶点和基因突变的免疫治疗和靶向治疗。同时,肾母细胞瘤、肝母细胞瘤、脑肿瘤等其他恶性实体瘤的诊断和治疗也取得了重要突破,使得患儿的生存率和生存质量得到了显著提高。国内多中心临床试验的开展和高水平研究结果的发表,也显著提高了我国儿童血液肿瘤疾病的诊疗水平。
在诊断与疾病分类方面,随着病理学、影像学和分子生物学技术的不断进步,儿童恶性肿瘤的病理分型和诊断准确性得到了显著提高。这为精准医疗的实施提供了有力支持,使得治疗方案更加个性化和精准化。
在全球范围内,针对儿童恶性肿瘤的研究持续深入,新靶点的发现和新药物的开发不断取得突破。这些进展为改善患儿的生存率和生存质量提供了更多可能性。但仍存在一系列亟待解决瓶颈问题,如区域诊疗水平尚存在很大差异,难治/复发肿瘤缺乏规范治疗方案,新药及新型免疫治疗应用的适应证及最佳时机等仍有待于进一步商讨。
本报告旨在概述儿童常见恶性肿瘤的病种、特性、治疗策略的演进以及未来的发展方向。通过深入总结这一领域的最新进展和挑战,为患儿提供更加有效的治疗方案和更好的生存机会。

2、 我国儿童肿瘤研究进展
2.1本学科研究新进展
2.1.1 儿童肿瘤发展现状
2.1.1.1 仪器设备
科研技术平台先进,比如以中国医学科学院血液病医院为代表的儿童白血病诊疗中心,现有七大关键技术中心,包括流式中心、影像中心、单细胞组学中心、功能基因与药物筛选中心、实验动物中心、超微病理中心等。目前仪器平台总面积约11000平米,支撑着总价值超过4亿元的大型科研仪器,包含全光谱流式细胞仪、多台高端流式细胞分选仪、超高分辨显微镜、Freedom单细胞建库移液工作站等先进设备,为儿童肿瘤研究提供强有力的技术支撑。全国多家儿童肿瘤诊疗中心具有以上同等科研设备及技术。国家卫生健康委重点实验室儿童血液肿瘤重点实验室依托上海交通大学医学院附属上海儿童医学中心进行转化应用方面的临床研究。
2.1.1.2 检测方法
围绕儿童血液肿瘤及实体肿瘤进行诊断的检查方法:病理诊断,免疫组织化学染色,PCR方法融合基因检测,流式细胞术免疫分型检测,G显带技术染色体核型分析,二代测序技术进行全外显子测序和全转录组测序,单细胞测序等,检测方法上与成人肿瘤并无大的差别。但各层面研究显示儿童肿瘤区别于成人肿瘤,越来越多研究也通过测序来揭示儿童肿瘤的遗传特征及驱动基因。一项国内天津医科大学肿瘤医院赵强/刘赟团队研究通过比较不同分化程度的神经母细胞瘤(neuroblastoma,NB)临床标本的转录图谱,筛选出促进分化成熟的节点lncRNA ADAMTS9-AS2,揭示了ADAMTS9-AS2和LIN28B之间的相互作用抑制了LIN28B与let-7前体之间的相互作用,发现其导致癌基因MYCN的表达受到抑制,随后影响肿瘤的干性和分化。该项研究表明ADAMTS9-AS2的缺失可促进NB转移、肿瘤干性并诱导NB分化功能障碍[2]。而另外一项国外研究则发现NB染色体2p局灶性增益和扩增、正常交感神经-肾上腺谱系和肾上腺素能表型NB中特异性表达、多种肾上腺素能特异性(超)增强子的调节以及肾上腺素能表型NB中SOX11 的高表达,确定SOX11为肾上腺素能表型高危NB中核心调节回路 (core regulatory circuitry ,CRC) 的核心转录因子,具有作为CRC上游表观遗传主调节因子的潜在作用[3]。
单细胞测序技术可在单个细胞层面进行高分辨率的分析来揭示单个细胞的状态和功能,并可根据检测到的每个细胞的基因表达情况对细胞进行分类,从而揭示组织中细胞的异质性,并发现新的细胞亚群以及构建出完整的细胞谱系,同时基于每个细胞的基因表达情况还可以进行分子层面上的机制研究。2020年9月17日,复旦大学附属儿科医院肿瘤外科李凯、董瑞团队和上海交通大学王嘉团队利用单细胞测序技术首次解析了儿童神经母细胞瘤的单细胞图谱,为人们深入了解神经母细胞瘤的发病机制提供了新的视角[4]。
流式细胞分析是量化儿童急性淋巴细胞白血病可测量残留病灶(minimal residual disease,MRD)的常用方法之一。当今化疗方案大多要求医生在化疗开始后的2-3周检测MRD,并根据结果调整化疗强度。运用贝叶斯分析推导出:MRD最坏情况数值遵循beta分布。举例来说:当一共检测5万个细胞而其中没有一个癌细胞时,正确解读不是“MRD为0”,而应是“有95%的可能性,MRD不超过0.006%”,即MRD最坏情况数值是0.006%。竺晓凡教授研究团队运用这个新方法重新分析了接受CCCG-ALL-2015方案治疗的883个急性淋巴细胞白血病患儿,发现新方法显著优于传统的MRD计算方法。根据传统计算方法,有274个患儿的MRD为0,即传统方法完全无法区分这些患儿的复发风险,但新方法能把这274个患儿中真正低风险的118人挑选出来。后期研究团队将开展多中心验证研究,实现精准MRD的判读[5]。
中山大学孙逸仙纪念医院黎阳团队开发了一种通过流式细胞术检测外周血CD4+ CD45RA+PTK7+T细胞水平来定量评价患儿的胸腺近期输出功能从而协助判断肿瘤患儿胸腺增大性质的技术(专利公布号:2023107711338;目前审核中);该技术较传统方法具有更简单、便捷、成本低的优势,能很好地反映胸腺近期输出状况,并有助于鉴别反应性胸腺增生和肿瘤浸润导致的胸腺增大,有望替代有创的胸腺手术活检来评判胸腺增大的性质,目前胸腺近期输出功能流式细胞术检测技术已在中山大学孙逸仙纪念医院投入临床应用,具有较大的临床意义和实用价值。
国际神经母细胞瘤风险分级组织(INRG)高度重视GD2作为检测儿童高危神经母细胞瘤(NB)骨髓转移微小残留病的生物标志物。国内天津医科大学肿瘤医院联合天津大学致力于GD2微小残留病(MRD)检测的研究与技术创新,显著提升了对NB骨髓转移的诊断准确率。该团队不仅申请了多项关于GD2细胞免疫染色的专利,还创新性地设计了一种基于石墨烯/金纳米粒子(AuNP)/GD2单克隆抗体的非功能化电化学生物传感器,用于GD2的高灵敏度检测。金纳米粒子(AuNP)以其卓越的物理和化学特性,能够有效地结合信号化合物及生物识别元件,如核酸适体、蛋白质、抗体片段或肽等,为肿瘤的早期诊断和治疗提供了新的技术途径。该基于GD2的电化学检测方法能够精确地检测出高危NB患儿体内的GD2阳性细胞,为临床医生提供了一种快速且定量的诊断依据,从而有助于实现更为精准的治疗方案制定[6]。
染色质可及性是 DNA 调控元件的一个标志,新出现的证据表明它在癌症中发挥着重要作用。使用测序 (ATAC-seq) 检测转座酶可及染色质的方法的出现和优化使得在原发性癌症的全基因组范围内分析染色质可及性成为可能。利用这项技术,最近的一项研究表明,淋巴细胞特异性开放染色质区域预先决定了 ALL 的糖皮质激素耐药性,这表明染色质可及性特征在 B-ALL 耐药和复发中的潜在作用。然而,关于原发性儿童 B-ALL 的染色质可及性概况以及复发期间发生的可及性变化的认知仍然缺乏。2023年国家儿童医学中心/上海儿童医学中心刘宇和沈树红研究团队在期刊Nature Communications发表论文,从染色质可及性(accessibility)的角度对复发B-ALL基因组特征进行了分析[7]。
2.1.1.3 数据分析
国内各血液肿瘤及实体肿瘤专业学科均有规模不一的数据统计及上报系统,形成以国家儿童医学中心为依托的儿童肿瘤登记平台,可进行实时数据分析。同时以国家血液系统疾病临床医学研究中心为依托的血液肿瘤生物样本库信息登记与信息分析中心可满足大部分临床与基础研究需求。
2.1.2 儿童肿瘤研究新进展
2.1.2.1 神经母细胞瘤研究新进展
神经母细胞瘤(neuroblastoma,NB)是起源于原始神经嵴细胞的恶性肿瘤,发生于交感神经系统。多见于婴幼儿,是儿童最常见的颅外实体肿瘤,占1岁以下婴儿肿瘤的50%。但NB引起的死亡率约占儿童肿瘤死亡率的15%。目前神经母细胞瘤的治疗是根据危险分层选择不同的治疗方法[8, 9]。
外科手术是神经母细胞瘤中重要的治疗方法。国内一项研究回顾分析了儿童肿瘤外科2年间225例腹膜后神经母细胞瘤的手术及预后情况,发现在高危的腹膜后神经母细胞瘤患者中,肾切除并不能提高患者的总体生存率(OS)、无事件生存率(EFS)、亦不能降低局部复发率(CILP)。提示神经母细胞瘤相关外科手术的指导原则是:除非受累的肾脏结构和功能严重受损,均应在完成原发肿瘤的肉眼完全切除的同时尽量保留肾脏[10]。
随着GD2的免疫疗法(如单克隆抗体dinutuximab)和化疗联用广泛用于治疗复发性高危神经母细胞瘤 (HRNB) 儿童,关于化疗联合GD2疗法的使用时机、使用时长以及药效反应的演化都还知之甚少。来自北美的联合研究团队通过回顾性分析146位患者的数据,研究发现大约一半接受伊立替康/替莫唑胺/dinutuximab/粒细胞-巨噬细胞集落刺激因子 (缩写:I/ T/DIN/GM-CSF) 治疗的复发性 HRNB 患者有客观反应。这项研究显示I/T/DIN/GM-CSF 与在治疗期间和治疗停止后均与缓解者的PFS延长相关[11]。除了GD2单抗,靶向GD2的CAR-T细胞治疗是第一个针对儿童实体瘤开发的免疫细胞治疗方法。国外今年公布了一项研究者发起的1/2期临床试验的3年随访结果,初步证明了靶向GD2的第三代自体CAR-T在复发难治的高危神经母细胞瘤中的可行性[12]。一项国内天津医科大学肿瘤医院研究确定了NB组织中B3GALT4可负性调控NB细胞GD2表达水平,其对NB生长起到抑制作用,揭示了B3GALT4通过GD2调控的脂筏、c-Met/AKT/mTOR/IRF-1通路影响NB细胞趋化因子CXCL9、CXCL10表达及CD8+T细胞的浸润,并利用脂筏抑制剂MβCD增加肿瘤组织中CD8+T细胞的浸润数量并增强GD2单抗的免疫治疗效果,为NB免疫联合治疗提供新靶点[13]。
神经母细胞瘤是免疫冷肿瘤,有多种免疫逃逸机制。Myc和N-myc下调MHC-I来规避T细胞介导的细胞毒性作用。正常情况下MHC-I的低表达可以激发NK细胞介导的细胞毒性作用,但是神经母细胞瘤患者中还有其他抑制NK细胞功能的因素。国内的一项研究通过分析了2个神经母细胞瘤患者队列中CD8+ T细胞和NK细胞空间分布、PD-1及PD-L1空间表达及其预后意义,根据不同的免疫细胞分布对肿瘤微环境进行了亚型分类。针对表达PD-L1的CD8+ T细胞和NK细胞进行了功能表型分析,并探究了回输CD8+ T细胞和NK细胞联合PD-1/PD-L1抗体在小鼠移植瘤模型中的疗效,发现NK细胞在神经母细胞瘤中的预后价值,以及NK细胞疗法在神经母细胞瘤免疫治疗方面的潜力[14]。一项国内天津医科大学肿瘤医院团队在CCR发表的文章,发现安罗替尼联合PD-1抗体能通过CD4+ T细胞促使肿瘤血管正常化,重塑肿瘤免疫微环境,并诱导NB消退,进而改善机体全身免疫系统的抑制状态[15]。
2.1.2.2 横纹肌肉瘤研究新进展
横纹肌肉瘤(rhabdomyosarcoma,RMS)约占21岁以下软组织肉瘤的一半以上,占儿童和成人肿瘤的比例分别约为7%和1%,是儿童和青少年最常见的软组织肉瘤之一。尽管随着手术、化疗、放疗综合治疗的进步,RMS 患者的生存率有了较大的提高,然而,目前治疗尚未有显著突破,高危、复发难治转移RMS仍是严重威胁儿童青少年健康和生命的致死性疾病,死亡率高[16]。
儿童软组织肉瘤研究(欧洲)协作组RMS2005研究纳入1733名患有非转移性横纹肌肉瘤的儿童青少年患者(0~25岁),根据危险度被分为低危、中危、高危和超高危4组。在过去发表的数据中,该研究表明对高危患者,在标准化疗方案中省略多柔比星并不会影响整体疗效,且后续增加维持化疗阶段有助于生存获益。另外,该研究更新了非转移性横纹肌肉瘤长期随访结果,表明,约80%的非转移性横纹肌肉瘤患者均获得了长期生存,在低危和中危组患者中,长期生存率可达90%以上[17]。另外,国外一团队还针对复发难治横纹肌肉瘤提出了创新疗法,比如多靶点酪氨酸激酶抑制剂瑞戈非尼可作为VEGFR及其他关键靶点FGFR和PDGFR的抑制剂,与化疗联合应用的潜在候选药物,结果得到了长春新碱和伊立替康(VI方案)在顺序或同时给药方案中进行联合治疗的安全性、最大耐受剂量和推荐II期剂量[18]。
横纹肌肉瘤的预后和其基因型密切相关。根据横纹肌肉瘤的分子特征可以分为融合基因阳性(PAX3或PAX7与FOXO1基因融合)(FP RMS)和融合基因阴性横纹肌肉瘤(FN RMS)。FP RMS的预后明显比FN RMS差,诊断时更常发生转移。一项国外的研究利用单细胞测序通过比较FP RMS和FN RMS的转录组图谱,揭示了两种横纹肌肉瘤分子亚型之间和分子亚型内的细胞成分和分化状态的差异,这种差异与临床预后相关,也是潜在免疫治疗靶点[19]。
2.1.2.3 非横纹肌肉瘤研究新进展
儿童非横纹肌肉瘤类软组织肉瘤(non-habdomyosarcoma soft tissue sarcomas,NRSTs )是除横纹肌肉瘤外所有软组织肉瘤的统称。其病理类型多样,生物学特性差异大。主要包括滑膜肉瘤 ( synovial sarcoma )、 血管周细胞瘤(hemangiosarcoma)、恶性外周神经鞘瘤(malignantperipheral nerve sheath tumor)、上皮样肉瘤(epithelioidsarcoma)、婴儿型纤维肉瘤(IFS)、腺泡状软组织肉瘤(alveolar soft -part sarcoma,ASTS)等等。如早期发现,手术治疗有可能治愈;如肿瘤发现晚,则复发率高,预后差。影响预后的主要因素为原发肿瘤病灶部位、大小、软组织肉瘤类型、组织学分级、肿瘤是否转移、手术切除范围以及患儿的年龄等。目前,滑膜肉瘤的一线治疗为蒽环类药物为基础的化疗,无论是单独使用还是与异环磷酰胺联合使用,其效果有限。
国外一项I/II期临床试验研究针对8名晚期滑膜肉瘤患者采用了可以特异性地下调内源性TCR的新技术,评估对不适合手术切除且对蒽环类药物耐药的晚期或复发性滑膜肉瘤患者,输注表达NY-ESO-1抗原特异性T细胞受体基因的自体T淋巴细胞和抑制内源性T细胞受体表达的siRNAs(产品代码:TBI-1301)的安全性和有效性。总体响应率为50.0%。采用贝叶斯方法评估TBI-1301的疗效,试验结果显著优于作为历史对照的帕唑帕尼(ORR为5.7%)。关于安全性方面,包括CRS在内,TBI-1301被认为是可接受的,因此,基于TBI-1301输注的过继免疫治疗有望成为治疗SS的一种有前景的新方法[20]。
婴儿型纤维肉瘤也是儿童中常见的非横纹肌软组织肉瘤。在1岁以内儿童中,约有1/4的软组织肉瘤为婴儿型纤维肉瘤。在婴儿型纤维肉瘤中有一个特征性融合基因——ETV6-NTRK3。NTRK基因家族与其他基因发生融合形成结构性激活的TRK融合蛋白可能导致肿瘤发生。拉罗替尼(larotrectinib)作为第一代高选择性口服TRK抑制剂,用于批准治疗NTRK基因融合阳性肿瘤。一项综述对关于拉罗替尼治疗NTRK基因融合阳性肿瘤有三个大型的临床试验进行介绍。得出结论拉罗替尼在所有年龄组和不同肿瘤类型中都表现出显著的抗肿瘤活性,无论NTRK基因或融合类型如何。但部分使用拉罗替尼治疗的患者会出现耐药。其耐药机制的可能与基因突变导致的氨基酸取代引起酪氨酸激酶结构域的改变,从而导致第一代NTRK抑制剂的结合受阻有关[21]。
腺泡状软组织肉瘤(ASPS)生长缓慢,但预后不佳,且有较高的早期恶性转移倾向。患者的5年总体生存率在各项研究中在20~46%之间。ASPS也一直缺乏标准疗法。这类肿瘤对传统化疗不敏感,早期治疗包括手术与系统治疗,极少有治愈作用。美国国立卫生研究院癌症研究所(NCI)的研究团队发表的一个多中心的单臂二期临床试验中显示,PD-L1抗体药atezolizumab(阿替利珠单抗)在52名可评估的患者中有19人出现了客观应答,客观应答率达到了37%(95% CI:24-51%)。患者的中位无进展生存时间是20.8个月。该研究显示阿替利珠单抗在ASPS患者中具有持久的抗肿瘤效果[22]。
2.1.2.4 骨肉瘤研究进展
骨肉瘤发病率在青春期的孩子中达到顶峰,为每百万人4.4例,这一时间恰好也是人体发育生长最快的时候。目前骨肉瘤的标准治疗在20世纪80年代确立,包括手术与化疗。对于局部位置的骨肉瘤患者,标准治疗能达到超过60%的长期存活率。遗憾的是自这些标准治疗确立以来,骨肉瘤治疗进展很少。最常用的化疗组合为MAP,包括了高剂量甲氨蝶呤(Methotrexate)、阿霉素(Doxorubicin,又称为Adriamycin)与顺铂(Cisplatin)。MAP外加入异环磷酰胺(Ifosfamide)和依托泊苷(Etoposide)。对于复发或转移性骨肉瘤患者来说,手术合并转移灶切除术改善了生存率。多个临床试验显示,复发后手术无法切除的骨肉瘤患者预后极差。
骨肉瘤精准治疗的难点在于很多骨肉瘤的普遍分子特征是很难成药的靶点,如TP53或RB1。骨肉瘤目前在分子水平上缺乏基于基因组数据的肿瘤分子分型,使得基于分子亚型做特异的肿瘤靶向治疗陷入困境。国内一项研究通过分析121例原发性骨肉瘤的临床、基因组、表观组和转录组数据,通过对骨肉瘤多组学数据的整合分析,原创性地揭示了骨肉瘤四种独立的分子亚型,发现其中免疫激活亚型患者的显著特征为免疫反应较强,患者预后最好;免疫抑制型患者或将是免疫检查点抑制剂的真正获益人群;同源重组缺陷亚型骨肉瘤表现为细胞周期相关基因表达较高,基因组不稳定性最高,可应用一线铂类化疗和PARP抑制剂;MYC驱动型骨肉瘤表现为基因组MYC基因的扩增,同时伴有MYC基因的高表达,该亚型骨肉瘤预后最差[23]。
另外,基于骨肉瘤表面有多种蛋白的过表达,新研究也在尝试寻找更多这类细胞表面的靶点。由于骨肉瘤患者很少,靶向这些表面蛋白的临床试验大部分是“借用”了其他常见肿瘤里也有的靶点。一些可利用的靶点包括GPNMB、LRRC15、HER2、GD2、B7-H3和EGFR。比如,国外一项研究验证了ALPL-1在OS中的特异性表达,且可被TP-1和TP-3抗体识别,并构建了两种嵌合抗原受体(CAR)分子OSCAR-1和OSCAR-3,通过一系列实验证实了OSCAR-T细胞对OS的有效性,提示OSCAR-T细胞或可成为部分OS患者的细胞疗法方案[24]。
关于儿童骨肉瘤的临床试验进展较少,2020年法国肉瘤组的十个中心进行了一项多中心、单臂、两阶段、2期试验,该研究探索MET和VEGFR2抑制剂卡博替尼在晚期尤文肉瘤和骨肉瘤患者中的活性,研究发现在尤文肉瘤患者中,39名患者中有10名(26%;95% CI 13-42)在6个月内出现客观反应(均为部分反应);在骨肉瘤患者中,42名患者中有5名(12%;4-26)出现客观反应(均为部分反应),14名(33%;20-50)在6个月内无进展。卡博替尼对晚期尤因肉瘤和骨肉瘤患者具有抗肿瘤活性,且通常耐受性良好[25]。
2.1.2.5 肝母细胞瘤研究新进展
肝母细胞瘤(HB)是婴幼儿及学龄前儿童最常见的肝脏恶性肿瘤,占所有15岁以前儿童肝脏恶性肿瘤的65%,并且近年来发病率有逐渐增多的趋势[8]。目前肝母细胞瘤的治疗是以外科手术切除为主,联合化疗的综合治疗。早期患者生存率可达90%以上,然而,高危患者总生存率大约40%,仍有待提高。
部分HB患儿会产生化疗耐药,目前耐药已成为影响HB肿瘤复发和患儿死亡的最主要原因。因此,亟待探索HB化疗耐药形成的影响因素及潜在机制,探寻新的有效治疗策略。国内一项研究对180例HB患儿的肿瘤组织进行了多组学测序,对HB样本进行了分子分型,鉴定出了一种新的化疗耐药亚型S2A。在单细胞层面探究了S2A化疗耐药亚型形成的潜在分子机制:S2A型肿瘤细胞通过分泌TGF-β促进TGF-β_CAF形成,同时抑制CD8效应T细胞的肿瘤杀伤功能以及诱导抑炎型巨噬细胞形成,共同构成了有利于肿瘤对抗铂类化疗的免疫微环境,进而促进了S2A肿瘤的化疗耐药。并且指出血清黄曲霉毒素水平检测可能是一种简便易行的预测HB化疗耐药及不良预后的潜在标记物[26]。
国内另有一项多中心、前瞻性的研究,共纳入399名HB患者。评估中国儿童癌症组(CCCG)2016年提出的新治疗方案的有效性,旨在确定中国儿童肝母细胞瘤(HB)的生存风险因素。结果发现4年无事件生存率(EFS)和总生存率(OS)分别为76.9%和93.5%。极低风险、低风险、中风险和高风险组的4年EFS率分别为100%、91.6%、81.7%和51.0%。4年OS分别为100%、97.3%、94.4%和86.8%。实施CCCG-HB-2016方案以来,HB儿童的生存结局显著改善。年龄≥8岁、肿瘤破裂(R+)和肝外肿瘤扩散(E+)是独立的预后风险因素。接受新辅助化疗前两个周期后AFP下降>75%的患者具有更好的EFS和OS[27]。
2.1.2.6 肾母细胞瘤研究新进展
肾母细胞瘤又称Wilms瘤(WT),是常见的儿童恶性肿瘤,多数患儿预后良好,5年生存率可达到85%-90%。但肾母细胞瘤生存者的长期发病率和死亡率,以及长期健康状况(例如肾衰竭)的信息较为缺乏。仅限于肾切除术、长春新碱和放线菌素-D治疗的WT生存者的研究显示,长期慢性健康状况和死亡率的发生率在很大程度上与非癌症人群相当。而接受更激进方案治疗的生存者的长期死亡率和健康状况(例如心力衰竭、卵巢功能早衰和随后的恶性肿瘤)的发生率升高。一项国外研究阐述单侧非综合征性肾母细胞瘤生存者的长期发病率和死亡率风险,结果显示就长期死亡率而言,在2008名单侧WT生存者中,有142人死亡,其中35年累计死亡发生率,按原因可分为7.8%(全因),1.6%(复发相关),4.7%(健康相关)。其中全因素和健康相关的死亡率呈逐渐上升趋势,尤其是那些接受≥4种化疗药物且接受放疗的生存者。预计未来几十年长期死亡率/发病率的负担将低于过去的生存者。然而所有治疗组的肠梗阻和肾衰竭等迟发效应的风险均升高,并且所有3-5级CHC的风险按治疗组强度呈剂量依赖性增加[28]。
在肾母细胞瘤的治疗和管理中,生物标志物用以预测患者预后日益受到重视。特定分子生物标志物,如肿瘤组织1p和16q的LOH、11p15和1q增益与初次手术后复发风险增加密切相关。因此细胞遗传学和分子检测如1q增益和/或1p、16q 的LOH被建议用于所有新诊断的儿童(NCCN Guidelines Version 1.2023 Wilms Tumor )。在过去的十年里,原发性肿瘤的测序技术已经明确了肾母细胞瘤的遗传基础,但并未对治疗、疗效或毒性产生影响。一项国外研究在umbrella AREN03B2研究中的复发样本上,发现超过40%的复发样本含有SIX1或MYCN突变,DIS3和TERT以前并未在大型原发性肾母细胞瘤研究中发现,现在被确定为经常发生突变。原发性肿瘤和复发肿瘤配对的分析表明,11p15杂合性丢失(和其他拷贝数变化)以及WT1和MLLT1的突变通常发生在早期,但SIX1、MYCN和WTX的突变在某些个体中是晚期发展。最显著的是,75%的复发样本获得了1q,这为在临床试验中研究循环肿瘤DNA提供了强有力的概念支持,以便更早地发现1q的增加并监测疗效[29]。
另一项研究则评估了在肾母细胞瘤血清和尿液中检测循环肿瘤DNA(ctDNA)及选定风险标志物的实用性。发现在50名患者中,有41名(82%)患者的血清中检测到ctDNA,13名(26%)患者的尿液中检测到ctDNA。血清ctDNA检测与肿瘤测序结果的一致性如下:1q增益为77%,16q缺失为88%,1p缺失为70%,因此,ctDNA作为一种易于获取的预后生物标志物显示出潜力,并有可能检测肿瘤异质性。后续将进一步探索ctDNA作为肾母细胞瘤患者风险适应性治疗中的无创诊断和预后工具[30]。
2.1.2.7 脑肿瘤研究新进展
脑肿瘤是儿童常见的实体肿瘤,也是儿童癌症死亡的主要原因。中枢神经系统(CNS)肿瘤占儿童癌症的20%,发病率仅次于白血病。常见的脑肿瘤有胶质瘤、室管膜瘤、中枢胚胎性肿瘤如髓母细胞瘤、颅内生殖细胞肿瘤等。近来,随着中枢神经系统肿瘤诊断和治疗的发展,许多患儿的生存期和生活质量已有所改善[31]。
美国一项研究建立了一个免疫基因组学平台O.R.A.N,并应用于O.R.A.N平台进行抗原预测并筛选肿瘤特异性抗原,开发针对特定肿瘤抗原的个性化mRNA疫苗,并在临床前模型中研究了TOFU mRNA疫苗与抗PD-1肿瘤免疫检查点抑制剂疗法(ICI)联合使用的抗肿瘤功效,发现TOFU mRNA疫苗与抗PD-1疫苗具有协同作用[32]。
高级别胶质瘤(HGG)是最致命的脑部恶性肿瘤,尽管有手术、放疗和化疗等多种治疗方式,治愈率仍然非常低。此外,由于原发性复制修复缺陷(RRD)导致耐药,RRD-HGG常在放化疗后会迅速复发。加拿大团队报告了RRD-HGG患者在抗PD-1单药治疗后发生肿瘤进展的挽救性免疫疗法的最大规模注册研究的真实世界数据,研究共纳入了75例RRD-HGG患者。大多数患者在放化疗失败后首次进展时接受了抗PD-1/PDL1单药治疗(n=70;94%)。最常见的病理诊断为胶质母细胞瘤(WHO 4级)。在ICI单药治疗中,55例(73%)患者的肿瘤发生进展,最常见的进展部位是局部(75%)。在这55例患者中,17例(31%)完全停用ICI, 38例(69%)继续使用ICI(根据联盟指南,单独使用或联合CTLA4抑制、MEK抑制和/或再放疗的挽救性联合)。所有75例复发性RRD-HGG患者的中位总生存期为25.5个月,是抗PD-1单药治疗10个月的PFS的两倍多。这表明在抗PD-1单药治疗后进展的部分患者中,挽救性治疗可以显著延长生存期。24例(63%)患者在抗PD-1的基础上加用了伊匹木单抗(CTLA4抑制剂)。两种ICI治疗组的第二次总生存期为12.1个月,3例患者的进展后生存期为20个月[33]。
低级别胶质瘤(pLGG)是儿童患者中常见的中枢神经系统肿瘤,预后较好。然而对于未完全切除的肿瘤患儿仍然存在进展的风险。目前的治疗包括手术切除、化疗和MEK抑制剂,但对于复发或难以手术切除的病例,治疗选择有限。在pLGG中,约15%-20%会携带BRAF V600突变,常见于多形性黄色星形细胞瘤、毛细胞型星形细胞瘤、神经节胶质细胞瘤亚型中。2023年的一项II期临床试验表明与标准化疗相比,达拉非尼联合曲美替尼一线治疗携带BRAF V600突变的儿童低级别胶质瘤患者的缓解率更高、无进展生存期更长、安全性更好。达拉非尼联合曲美替尼一线治疗能够让携带BRAF V600突变的儿童低级别胶质瘤患者获得更大获益[34]。PNOC001 II期临床试验旨在评估依维莫司对进展/复发性儿童低级别胶质瘤的疗效并识别疾病进展的生物标志物,研究结果表明,依维莫司在治疗复发/进展性儿童低级别胶质瘤中有效,具有良好的耐受性,无进展生存期与PI3K/AKT/mTOR通路激活无关,罕见的、新的KIAA1549:BRAF断点可能定义了进展性疾病的生物标志物 [35]。美国国家儿童医学中心的一项研究报道了新型RAF抑制剂Tovorafenib对复发/难治性儿童低级别胶质瘤的 II期临床试验结果,表明Tovorafenib可能是治疗携带BRAF突变的复发/难治性儿童低级别胶质瘤的有效疗法。携带BRAF融合的肿瘤患者中,ORR为69%,携带BRAF V600E突变的患者中,ORR为50%。这表明Tovorafenib对不同类型的BRAF突变的pLGG均有效。另外,Tovorafenib对于先前接受过MAPKi治疗的患者也具有疗效[36]。
髓母细胞瘤是儿童最常见的恶性脑瘤之一。国外一项研究通过对481例髓母细胞瘤患者样本的分析,研究人员发现肿瘤细胞中的染色体外环状DNA(ecDNA)普遍存在于约18%的髓母细胞瘤患者中。发现ecDNA与癌基因扩增、预后、TP53突变密切相关、通过CRISPR干扰(CRISPRi)实验进一步证实了ecDNA上的增强子对肿瘤细胞增殖的影响[37]。另外,国内苏州大学团队和美国团队合作发现PDLIM3的表达对于髓母细胞瘤细胞中Hedgehog(Hh)通路的激活是必要的。PDLIM3存在于髓母细胞瘤细胞和成纤维细胞的原发性纤毛中。阐明了PDLIM3在SHH型髓母细胞瘤细胞中纤毛形成和Hh信号传导中的重要作用[38]。
弥漫内生型脑桥胶质瘤(DIPG)是一种儿童脑肿瘤,具有高度侵袭性、难以手术治疗、死亡率高的特点,目前尚无有效的治疗方法。约80%的DIPG患者存在组蛋白H3K27M突变,导致全基因组H3K27me3的降低和转录异常,该突变被认为是DIPG发病的主要推动因素。除了H3K27M突变外,90%的H3.3K27M型DIPG存在p53信号通路异常。国内一项研究发现吉西他滨在H3K27M存在的条件下诱导DIPG的细胞凋亡。激活cGAS-STING信号及下游RELB介导的非经典NF-κB信号通路,从而促使肿瘤存活。进行药物筛选后发现Fimepinostat与吉西他滨表现出卓越的药物协同性,且Fimepinostat能够抑制吉西他滨激活的非经典NF-κB信号通路,同时阻断PI3K/ AKT信号通路,产生持续的DNA损伤效应,表现出在体外和体内实验中的卓越协同抗肿瘤作用[39]。
中枢神经系统生殖细胞瘤是一种少见的性腺外生殖细胞瘤,常发生于儿童青少年的松果体及鞍上区。近年来,关于中枢生殖细胞肿瘤的治疗进展方面的研究强调了基于风险的治疗调整的生物标志物的重要性。microRNA和拷贝数变异的识别等生物标志物可能对于治疗分层和评估治疗反应至关重要,目的是减少治疗负担并改善长期结果[40]。另外,国内一项研究表明儿童青少年颅内非纯生殖细胞瘤根据诱导化疗反应及二期手术后的病理结果,对病人进行高度个体化的放疗,对前期化疗反应较好的局限期或转移期病人均降低了放疗强度,仍然取得较好的预后。在保持较好疗效的基础上大大减轻了放疗相关副作用。对前期化疗反应较差的病人,尽管已经增强放疗,效果仍不理想。尚需开发新的治疗方法,以提高疗效[41]。
2.1.2.8 颅外生殖细胞瘤研究新进展
儿童颅外生殖细胞瘤(Extracranial Germ cell tumors,EGCTs)是发生在颅外的生殖细胞肿瘤(Germ cell tumors,GCTs)。在15岁以下的儿童中,约占儿童癌症的3.5%[42];在青少年(15至19岁)中,这一比例增加到14%。铂类化疗药物的引入使颅外恶性GCTs 5年总体生存率超过90%,然而,仍有20%-30%的晚期MGCTs会复发和死亡。
在过去十年中,国内外一直专注于确定预后因素,促进风险分层的改进,以减少部分患者的治疗,同时确定哪些患者需要加强治疗以改善预后。正在进行的一项针对低危患者监测的3期研究和卡铂与顺铂在中危患者中的随机试验(AGCT1531)提出所有部位的I期肿瘤均行术后观察。但已经完成的AGCT0132[43]结果显示仅I期性腺GCT术后可给予观察随访,其中男性4年EFS和OS分别为74%和100%,25名仅接受手术的女性EFS和OS分别为52%和96%,但卵巢GCT有较高的挽救率,故可接受术后观察。AGCT0132试图将中危患者的PEB治疗减少到3个周期,但3个周期的EFS(89%)显著低于预先设定的参数(92%)。因此,4周期的PEB仍是中危的标准方案。在法国TGM13的研究中,招募了115例非精原细胞瘤性生殖细胞肿瘤患者,根据指标等分为4组,旨在降低化疗负担,5年OS 95%,EFS 87%,该研究认为降低化疗强度并不影响预后[44]。
微小残留病灶及早期检测肿瘤标志物一直是肿瘤生物学研究的重点,特别是miRNA的出现,推动了这一进程。胚胎干细胞中表达的microRNA簇已经被证实为恶性GCT的通用生物标志物[45, 46]。
手术是治疗EGCT的主要方式,应遵循无瘤无血手术原则,尽可能保障生育能力。国内一项研究对137例卵巢GCT患儿的病例分析显示保留生育能力的手术和不完全的手术分期并不影响预后[47]。无论分期或者病理,在卵巢GCT患者中保留生育能力和缩小手术是原则。同时卵巢组织冻存是保存生育能力的有效方法。大量临床研究表明精准肿瘤切除术、部分阴道切除术、部分或全部宫颈切除术等保守手术,联合术后化疗及必要时放疗已经初步显示出显著增高的OS和良好的保育生存质量。国内另有研究基于2018版专家共识开展临床工作,不断总结分析单中心临床经验,近年来发表2篇单中心文章:《700例儿童颅外生殖细胞肿瘤单中心临床诊疗总结》《儿童颅外转移性恶性生殖细胞肿瘤诊治经验总结》[48, 49]。上海三家儿童医学中心多中心研究结果显示中国儿童颅外GCT的发病率和临床特征与欧美报道相似。不同病理类型和原发部位的年龄分布反映了原始生殖细胞(PGC)错误迁移的肿瘤细胞起源特征。对于原发部位为纵隔的恶性生殖细胞瘤,应探索更有效的治疗方案[50]。
2.1.2.9 视网膜母细胞瘤研究新进展
视网膜母细胞瘤(retinoblastoma)是儿童最常见的眼内恶性肿瘤,发病与双等位抑制基因Rb1突变、缺失相关,又称双等位遗传性肿瘤。虽然过去的一个世纪,Rb的生存率已经有很大的进步,但是眼球摘除率、视力丧失仍然是占非常大的比例,转移期的RB病死率高达近60%。中国抗癌协会儿童血液肿瘤分会儿童视网膜母细胞瘤协作组制定了相关指南,并针对RB开展系统的研究,主要研究成果如下:回顾性分析2005年9月-2021年3月2790例RB临床资料分析:5年OS>95%;转移期RB行大剂量化疗联合自体外周血造血干细胞移植18例,3年OS达到83.3%;44例家族性RB 5年OS93%[51]; 自2017年参与全球视网膜母细胞瘤现况调查,就不发达国家、地区的RB发病现况和预后开展多中心研究、随访[52, 53]。
2.1.2.10 其他罕见肿瘤研究新进展
儿童实体瘤中有罕见类型的肿瘤发生,比如肺母细胞瘤、胰母细胞瘤、神经内分泌瘤、儿童肾上腺皮质癌等,由于发生率低,研究不多,其进展较为缓慢。仅以肾上腺皮质癌为例介绍。儿童肾上腺皮质癌(ACC) 罕见,常发生于5岁以前,女孩为主,普遍存在男性化特征;儿童肾上腺皮质癌中TP53胚系突变约50-65%[54]。手术是治疗的主要手段,对于晚期疾病的儿童,给予化疗和米托坦的治疗原则;分期早和完全切除是最重要的预后因素;超过 90% 的局部小肿瘤患者长期存活,而转移性肿瘤患者为 10%;尽管肿瘤完全切除,但仍有 50% 的局部大肿瘤患者复发。儿童肿瘤协作组(COG)开展ARAR0332研究,纳入了 78 名患者,分析发现儿童I期肾上腺皮质癌单纯手术可获得较高生存率;II期患者单纯手术失败率高,全身系统治疗有必要。III期患者联合手术+化疗+米托坦综合治疗获得不错生存;IV期患者年龄偏大,生存率低,需要探索新治疗方法;米托坦联合DDP为基础的化疗毒副作用明显,三分之一的患者不能完成治疗[55]。
2.2国内相关重大计划和研究项
2.2.1 国内重大研究项目
(1)国家儿童肿瘤监测中心(简称中心)是由国家卫生健康委批复,在国家儿童医学中心(首都医科大学附属北京儿童医院)内设置的独立部门。中心开展以医院为基础覆盖全国的儿童肿瘤监测工作,截至2024年2月19日,已建立了1094家监测点。中心定期出版监测年报,于2021年3月正式发布《国家儿童肿瘤监测年报2020》,该本年报为首部描述我国儿童恶性肿瘤出院人次的分布及住院特征的专著;于2023年4月正式发布《国家儿童肿瘤监测年报(2022)》,为我国儿童肿瘤防控工作提供数据支撑。2022年9月,中心完成了首个针对我国儿童和青少年癌症发病率和卫生服务可及性的现状研究,并在顶级期刊The Lancet上发表相关文章,响应了儿童癌症全球倡议,为全球儿童癌症防控添砖加瓦。
(2)张翼鷟教授团队《恶性肿瘤和自身免疫性疾病治疗用生物技术药物早期临床试验评价技术平台的建设》为国家科技重大专项(课题号:2020ZX09201026),该重大专项包括了儿童肿瘤早期临床研究的内容,现已完成,并发表了高质量的研究文章。
(3)赵强教授团队《G6PD蛋白在儿童神经母细胞瘤中协调氧化还原稳态的相关研究》受到国家自然科学基金青年项目资助(课题号:82103380),项目经费30万。
(4)中国抗癌协会小儿肿瘤专委会(以下称CCCG)是目前中国儿童肿瘤领域最早且病种覆盖面最广的设立临床研究小组的学术平台。
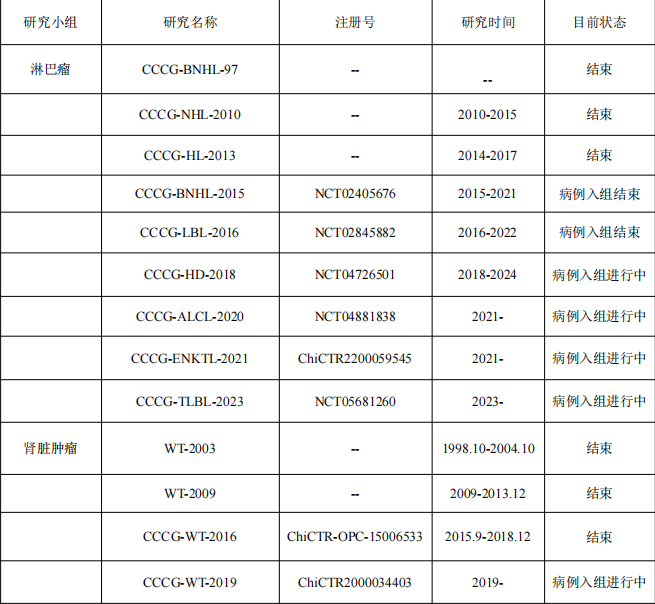
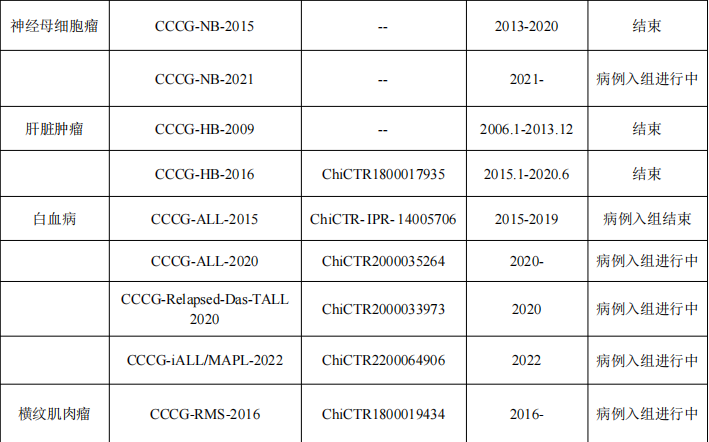
(5)CCCG内科组、外科组和病理组发表方案/共识/指南

2.2.2 国内重大研究计划
(1)赵强教授团队联合重庆医科大学附属儿童医院王珊教授和上海交通大学医学院附属上海儿童医学中心高怡瑾教授获得国家科技部重点研发计划专项《高危神经母细胞瘤发生、复发及转移的分子基础研究》(课题号:2018YFC1313000),课题经费1299万元。
(2)倪鑫教授团队《儿童神经母细胞瘤和肝母细胞瘤发病机制及干预策略研究》为国家自然科学基金重大项目(课题号:82293660),课题经费1500万元。
(3)徐敏/潘秋辉团队获得国家自然科学基金重大项目儿童肝母细胞瘤和神经母细胞瘤诊断新策略研究(课题号:82293662 ),课题经费300万。
(4)张翼鷟教授团队参与的《儿童重要肿瘤与血液性疾病的病因和防治关键技术研究》为国家重点研发计划 (项目编号2022YFC2705005) 。该重大研究课题由我国多家儿童肿瘤权威中心和专家参与,并执笔其中实体肿瘤的研究内容。
(5)汪建教授团队《急性T淋巴细胞白血病分子分型及细胞治疗/T-ALL多维度全景式分子分型及预后评价体系的建立》,获得国家科技部重点研发计划项目资助(课题号:2022YFC2502700),课题经费300万元。
2.3 国内重要研究平台与研究团队
CCCG的研究小组如下(按成立时间顺序):淋巴瘤研究小组(1995),肾脏肿瘤研究小组(1999),神经母细胞瘤研究小组(2009),肝母细胞瘤研究小组(2009),颅外生殖细胞瘤研究小组(2015),儿童脑肿瘤研究小组(2015),白血病研究小组(2015)、横纹肌肉瘤研究小组(2018),视网膜母细胞瘤研究小组(2021)和实体肿瘤造血干细胞移植小组(2023)。
虽然,面临着临床研究资金缺乏、临床研究培训体系不成熟以及缺乏全职临床研究辅助人员支持等诸多困难,各CCCG临床研究小组始终坚持立足专业,争取国际资源,努力联合国内其他区域性研究小组,并以为全球相关学术领域贡献中国证据为目标。现将各临床研究小组工作归纳汇总如下:
(1)淋巴瘤研究小组:王耀平医生于上世纪90年代中期成立,是CCCG历史最悠久的研究小组。20余年来,汤静燕、唐锁勤和高怡瑾医生做了大量工作,为我国儿童和青少年淋巴瘤治疗水平的提高做了大量工作,除定期发布符合我国国情的诊疗共识外,持续主导多项临床研究(包括多项注册临床研究),涵盖侵袭性成熟B细胞非霍奇金淋巴瘤、淋巴母细胞淋巴瘤,间变大细胞淋巴瘤、外周NK- T淋巴瘤和霍奇金淋巴瘤。相关研究报告,相继发表于中华血液学杂志、Med Pediatr Oncol、中华儿科杂志和Ann of Hematol等杂志。近年,引入临床研究PI制度,为年轻学者提供展现才能的平台,促进淋巴瘤专业健康多元化发展。
(2)肾脏肿瘤研究小组:成立于上世纪90年代末,汤静燕,徐敏和孙晓非医生做了大量工作。历经20余年,在充分考虑我国国情前提下,以北美儿童肿瘤协作组(COG)方案为基础,已经推出了CCCG- WT-2003、CCCG- WT-2009、CCCG-WT-2016及CCCG- WT-2019-12修正等多个治疗方案。基于这些方案的回顾性疗效总结,在中华小儿外科、BioMed Res Int和中华儿科杂志等发表。2022年,该研究小组,引入PI制度,王焕民医生主导的“中国儿童双侧肾母细胞瘤”项目正在按序进行中,各项研究成果非常令人期待。
(3)神经母细胞瘤研究小组:成立于2009年。在回顾性分析中国8家儿童肿瘤治疗中心500多例神经母细胞瘤临床数据的基础上,靳燕、袁晓军和赵强等发表神经母细胞瘤CCCG-NB-2015共识多中心中国数据。研究小组在2015年和2021年分别撰写并发布了中国儿童神经母细胞瘤的专家共识。不仅如此,研究小组还通过组织针对儿童神经母细胞瘤的专题讨论会,提高了临床医生的临床处理能力并让公众了解该疾病的最新诊治理念。2018年,在研究小组框架下,由天津医科大学肿瘤医院赵强医生牵头,联合天津医科大学、南开大学、重庆医科大学附属儿童医院、上海交通大学医学院附属上海儿童医学中心首次申报成功国家科技部重点研发计划专项,并于2021年顺利结题,发表众多高水平的文章同时构建了中国国内首个神经母细胞瘤临床样本和多组学的数据库,为推动神经母细胞瘤基础和临床研究相结合做出了贡献。
(4)肝母细胞瘤研究小组:参照北美COG和欧洲国际儿童肝肿瘤协作组的诊疗模式,吴晔明和袁晓军医生于2009年建立CCCG儿童肝母细胞瘤研究小组,并制定了我国首个全国性肝母细胞瘤诊疗规范,即《儿童肝母细胞瘤多学科诊疗规范》(CCCGHB2009)(简称武汉方案),在研究小组内十余家儿童肿瘤治疗中心推广应用,结果于2016年Cancer Letter发布。此外,研究小组于2015年建立临床研究数据库,于2016年发布“儿童肝母细胞瘤多学科诊疗专家共识(CCCG-HB-2016)”,此项研究结果也已于2023年发表于World J Pediatr。
(5)白血病研究小组:成立于2015年,与汤静燕、竺晓凡、李志光和裴正康医生领导的CCCG-ALL-2015临床研究项目的确立密切相关。2018年,随着国家卫生健康委联合国家发展改革委、人力资源和社会保障部、国家医保局、国家中医药局、国家药监局六部委发布的《关于开展儿童白血病救治管理的通知》以来,我国儿童白血病的救治形成三级诊疗网络及全国白血病定点救治医院,形成了CCCG-ALL研究小组,北京CCLG-ALL及广州SCCLG-ALL南北中三大多中心协作组的格局,覆盖除外西藏自治区的全国大部分省市地区,并相继开展了急性早幼粒细胞白血病、急性淋巴细胞白血病及非早幼粒细胞急性髓系白血病的多中心研究,成果发表在Lancet Oncology、JAMA oncology、JCO、Blood、Nature communication、Leukemia、BJH等国际顶级刊物,大大提高了我国儿童白血病诊疗水平的国际认可度。
(6)横纹肌肉瘤研究小组:在马晓莉和王焕民医生的努力下,于2018年成立。同年12月完成在中国临床试验注册中心研究注册(ChiCTR1800019434),同时开始在各参与单位收集研究数据;至2022年,协作组相继发表《儿童及青少年横纹肌肉瘤多中心临床研究--CCCG-RMS-2016近期疗效研究报告》以及《儿童及青少年横纹肌肉瘤多中心临床研究--CCCG-RMS-2016中期研究报告》,多次在各种全国学术会议上汇报协作组工作。2022年,基于前期研究,协作组牵头完成中国抗癌协会《中国肿瘤整合诊治指南--儿童及青少年横纹肌肉瘤》。
(7)颅外生殖细胞瘤研究小组:成立于2015年,与王珊医生及其团队牵头“中国儿童颅外生殖细胞肿瘤专家共识”的撰写有关。此共识,2017和2018年经历2次较大修改,后因疫情搁置,最终版本《儿童颅外生殖细胞肿瘤诊疗专家共识(CCCGGCTs-2021)》已经发表在《中国小儿血液与肿瘤杂志》。
(8)视网膜母细胞瘤研究小组:成立于2021年,由首都医科大学附属北京同仁医院黄东生医生牵头成立。2022年牵头撰写中国抗癌协会-中国肿瘤整合诊疗指南(CACA)眼肿瘤分册-视网母细胞瘤的指南撰写。
(9)实体瘤造血干细胞研究小组:成立于2023年11月CCCG秋季会议。黎阳主任负责了研究小组的创立。研究小组成立前调查显示,2021至2023年全国十七家医疗单位的儿童造血干细胞移植中心共进行儿童实体瘤造血干细胞移植(HSCT)398例,其中行自体造血干细胞移植(auto-HSCT)333例(83.7%),行异基因造血干细胞移植(allo-HSCT)65例(16.3%)。神经母细胞瘤、淋巴瘤、中枢神经系统肿瘤和骨及软组织肿瘤的移植工作,将是未来研究小组的主要关注点。
3、国内外研究进展比较
3.1国内外儿童肿瘤学科发展现状
3.1.1 国内外儿童血液肿瘤学科发展现状
随着化疗方案的日臻成熟,儿童血液肿瘤的预后明显改善,但近年来预后改善的速度有所放缓。然而免疫治疗的不断涌现为儿童血液肿瘤患者提供了新的治疗手段。近年来免疫疗法在ALL、淋巴瘤治疗中取得巨大的进展,迄今已经发现多个治疗靶点,如CD22、CD19、CD38、CD5、CD7等,并研发出一系列新型免疫治疗药物及细胞产品。目前临床可及的免疫疗法主要包括CD3-CD1双特异性抗体(BiTE)、CD22-抗体耦联药物(ADC)-奥加伊妥珠单抗(INO单抗)及嵌合抗原受体T细胞治疗(CAR-T)。2014年继首次报道BiTE在成人难治/复发(R/R)B细胞型ALL临床研究取得较好疗效,2016年 BiTE I/II期临床试验(205研究)[56]确定了儿童爬坡剂量并验证其疗效及安全性,在高肿瘤负荷R/R B-ALL 患儿BiTE 爬坡剂量为第一周5ug/m2/d,接下来3周加量至15ug/m2/d,经过2个疗程39%患儿获得形态学 CR ,52%为MRD转阴。同年BiTE在美国食品药品管理局(FDA)获批用于儿童R/R Ph- B-ALL治疗。2020、2021相继发表同情用药试验(RIALTO)[57]、比较BiTE与常规化疗在儿童高危、中高危首次复发患者疗效III期临床研究(215研究)(COG AALL1331研究)[58, 59],证实BiTE在儿童R/R B-ALL 具有较好的疗效及安全性,2022年5月我国国家食品药品监督管理总局药品审评中心(CDE)批准BiTE用于儿童R/R B-ALL。随着病例数及治疗经验的不断积累,BiTE治疗端口不断前移,2022在美国血液学年会(ASH)有学者报道:BiTE用于一线化疗不耐受及MRD阳性患者,1疗程MRD转阴率高达94%且耐受性良好,无3-4级细胞因子释放综合征(CRS)发生[60]。2023年欧洲血液学年会(EHA)我国单中心一项单臂单中心开放研究,评估BiTE在初诊中/高危 B-ALL 诱导结束第46天MRD阳性患者疗效,入组9例患者均达到MRD转阴,无3-4级CRS发生[61]。Queudeville等[62]研究汇总了5项BiTE单药治疗R/R B-ALL临床数据,其中儿童166例,结果显示治疗前肿瘤负荷≥50%的不论从反应率及生存期都明显低于肿瘤负荷较低患者,因此建议BiTE更适合用于肿瘤负荷较低患者可以充分发挥其抗肿瘤活性。
INO单抗是首个获批用于治疗R/R B-ALL的 ADC药物,在儿童R/R B-ALL 一项同情用药研究,51例患者CR者达67%,其中71%可达MRD转阴[63]。欧洲开展的一项多中心单臂临床研究[64]评估INO单抗单药用于治疗儿童 R/R CD22+B-ALL,总体反应率(ORR)81.5%,MRD转阴率达81.8%, 1年OS 为55.1% ,肝窦阻塞综合征(SOS)是INO单抗最突出不良反应,此项研究SOS发生率为25.9%。
CAR-T是目前用于ALL最常见并且有效的细胞免疫治疗手段,常用的治疗儿童ALL的CAR-T产品包括CD19、CD22、CD19-CD22双靶点、CD7自体及通用型 CAR-T等等。最初全球多中心临床研究(ELIANA)[65]证实CAR-T用于儿童和年轻成人的疗效及安全性,ORR及MRD转阴率均为81%,6月、12月OS分别为 90%、76%, CAR-T治疗后是否桥接造血 HSCT ,国外研究有不同的声音,有研究认为CAR-T治疗后应尽早进行HSCT[66-68],然而Park et al[69]研究结果表明CAR-T后是否桥接HSCT并不影响患者 EFS 。在我国儿童R/R B-ALL临床实践中多建议CAR-T后3-6月桥接HSCT,是否可获得显著生存获益尚需开展进一步前瞻性临床研究。对于单纯B-ALL髓外复发或者骨髓联合髓外复发的患者,CAR-T细胞可以透过血脑屏障或者血睾屏障发挥杀伤肿瘤细胞,但是对于中枢神经系统复发高肿瘤负荷患者建议先予腰穿鞘注联合全身化疗降低肿瘤负荷后再行CAR-T治疗,这样可有效降低中枢神经系统并发症发生。对于B-ALL单纯睾丸复发的患者优先推荐CAR-T治疗,不仅免除了化疗及手术切除的痛苦,而且能够最大限度地维持患儿正常生理功能[70, 71]。CD7 CAR-T来源目前主要有三种,各有优劣:自体CAR-T取材与肿瘤状态密切相关,安全性高但肿瘤细胞污染可能性大;供者CAR-T 取材便利但诱发排异反应的风险较高;目前通用型CAR-T应用广泛,安全性可控,疗效尚需进一步观察。目前CAR-T在R/R 急性髓系白血病(R/R-AML)的疗效不佳,主要原因为缺乏理想靶点,且髓系功能受损缺乏相应的替代治疗。目前除了CD33或CD123 CAR-T临床研究外还有CLL1靶点。CLL1的特异性较CD123、CD33等相对更高,研究结果表明,CLL1 CAR-T治疗儿童R/R-AML是一种安全有效的治疗选择,但初步结果显示后续桥接HSCT可能更为有益[72]。
3.1.2国内外儿童实体肿瘤学科发展现状
近年来,儿童肿瘤学科领域取得了显著进展,基础研究的深入以及技术创新推动了诊疗手段的革新,为儿童肿瘤患者带来了更好的生存机会和生活质量。外科手术在儿童实体肿瘤治疗中作用关键、必不可少;然而,既往缺乏全面的术前评估和治疗模式;缺乏成体系的手术理论和创新性技术支撑,因此手术难度大、安全性差、术中术后并发症常见、器官损伤常见、肿瘤学预后差、幸存者生活质量不佳;为此,针对既往儿童实体肿瘤手术治疗中遇到的困境和痛点,近10年来,在中国工程院相关课题的资助及张金哲院士的指导下,国内团队积极探索,在国内率先建立及完善儿童实体肿瘤术前评估体系、探索和优化术前辅助治疗模式、形成并革新包括无血、无瘤、器官保存等手术技术理论、摸索及尝试微创外科及其他术中辅助新技术的创新性应用;逐渐形成了小儿实体肿瘤无血无瘤器官保存手术理论与技术创新体系,并在以神经母细胞瘤、肝母细胞瘤、胰腺肿瘤、肾母细胞瘤、软组织肉瘤、生殖细胞肿瘤等为代表的儿童实体肿瘤手术中得以应用,手术安全性不断提高、疗效确切、生存率及生活质量大幅度上升。
放疗是儿童肿瘤常见且重要的治疗方式。儿童实体肿瘤,需要接受放疗的包括中枢神经系统肿瘤、尤文肉瘤、肾母细胞瘤、神经母细胞瘤、横纹肌肉瘤等。今年,美国圣裘德儿童医院评估了接受有限性的手术切除,术后联合质子放疗的儿童、青少年[73]颅咽管瘤患者的无进展生存率和总生存率,发现质子治疗和光子治疗在无进展生存率或总生存率方面没有差异,质子治疗并没有改善儿童和青少年颅咽管瘤患者的生存结果,严重并发症发生率相似[74]。国外另一团队则通过分析和比较放射治疗(RT)的适应证、剂量和应用方法,以及它们对局部横纹肌肉瘤(RMS)患儿预后的影响,提示对于不同横纹肌肉瘤IRS分级的患儿,是否需要放疗以及推荐放射剂量可能不同[74]。
随着基因测序技术的发展,儿童肿瘤的分子机制得到了更深入地解析。越来越多的基因突变和染色体异常与儿童肿瘤的发生、发展密切相关,这为精准诊断和治疗提供了重要依据。例如,针对某些特定基因突变的靶向药物已经在临床试验中取得了显著疗效,为儿童肿瘤患者提供了新的治疗选择。NTRK 基因融合见于多种成人和儿童恶性肿瘤,是这些肿瘤的致癌驱动因素[75, 76]。拉罗替尼和恩曲替尼是第一代TRK抑制药物,与TRK可逆性结合,阻止TRK融合蛋白非配体依赖性组成型激活的实体瘤生长。司美替尼即是选择性MEK抑制剂。用于不能手术的 NF1 相关丛状神经纤维瘤 (PNF) 儿童,70% 左右的患儿肿瘤缩小[77],对ALK阳性神经母细胞瘤患儿而言,劳拉替尼被报道可提高客观应答率[78]。
免疫治疗在儿童肿瘤领域也具有潜在应用价值。与传统的化疗和放疗相比,免疫治疗具有更高的特异性和更低的副作用,为儿童肿瘤患者带来了更好的生存机会。例如,针对某些儿童神经母细胞瘤的GD2已经在临床试验中取得了令人鼓舞的效果。抗GD2抗体的免疫疗法使Ⅳ期神经母细胞瘤的治疗效果明显提高[12, 79]。免疫检查点抑制剂(ICIs)ICIs 特异性与PD-1、 CTLA4、PD-L1和其他免疫检查点分子结合,可以有效地阻止肿瘤生长和促进肿瘤消退,临床试验结果表明单药疗效在儿童实体肿瘤中受限,但安全性尚可[80]。另有研究表明可在患有与种系错配修复缺陷相关的实体肿瘤的儿童中诱导肿瘤消退[81]。除了治疗方法的革新,儿童肿瘤学科领域还在风险评估、早期诊断和疗效评估方面取得了重要进展。通过循环肿瘤标志物检测等手段,医生可以更早地发现肿瘤、更准确地评估病情,从而制定出更合理的治疗方案[82-84]。然而,儿童肿瘤学科领域仍面临诸多挑战。一方面,儿童肿瘤的发病率逐年上升,对医疗资源和社会保障体系提出了更高的要求;另一方面,新型治疗方法的成本较高,使得部分患者难以获得及时有效的治疗。因此,需要政府、社会和医疗机构共同努力,推动儿童肿瘤学科领域的持续发展,为儿童肿瘤患者提供更好的医疗服务和支持。
3.1.3国际儿童肿瘤新技术发展现状
随着基因测序技术的发展,越来越多的基因突变和染色体异常被发现,且与儿童肿瘤的发生、发展密切相关,这为精准诊断、分层和精准治疗提供了重要依据。如血液肿瘤方面,目前儿童血液肿瘤的发展主要聚焦的方向之一即MRD检测及预后分层的进一步细化。迄今临床用于儿童 ALL 诊断和MRD评估的常用方法包括多参数流式细胞术(multi-parameter flow cytometry, MFC)和定量聚合酶链式反应(quantitative polymerase chain reaction, qPCR)。近年来,有国外研究团队针对ALL MRD监测采用免疫球蛋白/T细胞受体基因重排(IG/TR)的二代测序技术(next generation sequencing,NGS),通常MFC的敏感度为10-4,qPCR 为10-5,而NGS可以达到10-6,相较于MFC和qPCR ,NGS监测MRD灵敏度更高,应用范围更广泛,主要表现在以下几个方面 1. 对极低肿瘤负荷MFC阴性而qPCR MRD阳性的患者进行更准确的风险预测[85];2. 高危患者使用NGS可早期识别有复发风险的人群[86]。3. NGS-MRD持续阴性预示患者累计复发率(CIR)低且总生存期(OS)更长。循环肿瘤DNA(circulating tumor DNA,ctDNA)是患者外周血带有肿瘤特异性突变或表观遗传学改变DNA片段,半衰期为16分钟到数小时,能准确反映肿瘤最新状态[87, 88]。2017年Paul Yeh等[89]及2019年Nakamura等[90]发表两项研究结果均证实骨髓DNA和外周血ctDNA基因组异质性高度一致性,因此,利用数字PCR(ddPCR)及NGS检测外周血ctDNA可作为儿童AL MRD监测的重要手段。目前ctDNA检测尚在临床研究阶段,但是由于选取外周血作为检测标本,可及性强,患儿接受程度高,有望成为儿童血液肿瘤MRD监测的替代手段[91]。
3.2国际重大研究计划和重大研究项目
3.2.1 国际儿童血液肿瘤重大研究项目
随着科学技术的飞速发展,目前儿童血液肿瘤的发展主要聚焦在以下三个方向:肿瘤靶向药物运用、免疫疗法以及MRD检测及预后分层的进一步细化。临床前研究显示BCL2选择性抑制剂维奈克拉可诱导AML细胞凋亡,有望成为R/R AML极具治疗前景的靶向药物之一,此外高三尖酯碱联合维奈克拉、维奈克拉联合阿扎胞苷、FLT3抑制剂、IDH1/IDH2抑制剂、MEK抑制剂等等也都将成为今后儿童AML不同亚型的重要靶向治疗药物。免疫疗法主要包括一系列CART、BiTE以及INO单抗等进一步扩大适应证的临床试验研究。NGS-MRD监测手段可有效提高肿瘤细胞检出率,在儿童AL预后预测作用明确,未来将有望成为儿童AL疗效评估的重要手段。
3.2.2 国际儿童血液肿瘤重大研究计划
血液肿瘤进入精准诊疗新时代,儿童血液肿瘤重大研究计划分三个层次:第一,临床前基础研究探索血液肿瘤耐药机制及治疗新靶点;采用多组学研究方法进一步探究儿童血液肿瘤发病及耐药机制,揭示重要基因及通路在血液肿瘤细胞发生及分化过程的关键作用,从而阐明其在肿瘤发生及耐药过程中的生物学作用,为儿童血液肿瘤提供治疗新靶点及干预新策略。第二,药物基因组学研究助力个体化精准治疗;通过药物敏感性检测结合AL体细胞基因组景观全面刻画白血病体外药物反应谱和体内早期治疗反应间关系,为儿童AL个体化精准治疗提供依据。第三,血液肿瘤患儿长期生存质量及社会能力研究。国际儿童癌症结果项目研发了针对常见儿童癌症类型的核心健康相关结果集为儿童医疗质量评价体系提供了重要的指标。
3.2.3国际儿童实体肿瘤重大研究项目
(1)Pediatric Cancer Dependencies Accelerator(PedDep Accelerator):由美国麻省理工学院-哈佛大学博德(Broad)研究所、丹娜法伯(Dana-Farber)癌症研究所与圣裘德(St. Jude)儿童医院共同推动的合作项目。该项目旨在利用基因组编辑技术寻找儿童肿瘤的特点,分析遗传学、表观遗传学特征,寻找有效联合治疗方案,并发展数据挖掘和信息技术。
(2)癌症大挑战计划:美国国家癌症研究所(NCI)和英国癌症研究基金会(Cancer Research UK)联合推出的计划,其中包括针对儿童实体瘤驱动基因的靶向治疗研究,目的是寻找新疗法以改善生存率并减少副作用。
3.2.4国际儿童实体肿瘤重大研究计划
(1)美国MATCH研究:2015年7月,美国国家癌症研究所(National Cancer Institute,NCI)启动了一项大规模的临床试验——选择治疗方案的分子分析(Molecular Analysis for Therapy Choice,MATCH),动用全美的卫生资源将抗癌药物与肿瘤的基因特征相匹配,探索分子水平的异常是否能有效指导抗癌药物的选择,向更好地利用靶向药物迈出了关键的一步。
(2)Zero Childhood Cancer:一项由儿童癌症研究所和悉尼Randwick儿童医院癌症中心倡导的精准医学计划。该计划通过基因测序确定每位小患者的癌症分子和遗传特征,并为其制定个性化的诊疗方案。该计划旨在从根本上改变未来癌症的治疗方法。
(3)MAPPYACTS(NCT02613962)是由法国巴黎萨克雷大学研究团队领导的一项国际前瞻性精准医学临床试验,旨在绘制儿童和青少年患者复发/难治性恶性肿瘤的分子谱,以指导癌症在复发/难治情况下最适合的挽救性治疗方案。MAPPYACTS主要利用全外显子组测序(WES)和转录组测序(RNA-seq),根据复发时患者的肿瘤分子谱确定合适的个性化匹配靶向治疗方案,并对其治疗效果进行评估。此外,MAPPYACTS还探索了循环细胞游离DNA(cfDNA)作为一项非侵入式辅助手段评估肿瘤相关基因组变化的可行性。
3.3我国研究现存优势与不足
3.3.1 儿童血液肿瘤研究存在的优势
近年来,国内儿童血液肿瘤三大协作组中国抗癌协会儿童肿瘤协作组(CCCG),中国儿童白血病协作组(CCLG),华南儿童癌症协作组(SCCCG)研究结果相继在国内外报道,呈现出百家争鸣、百花齐放的良好局面。CCCG-急性淋巴细胞白血病(ALL)5年无事件生存率(EFS)已达到国际先进水平(低危组 90.2-90.3%;中危组80.8-82.8%)[92]。根据CCCG-2015方案维持治疗期随机对照研究结果取消2020方案低危组ALL7个周期长春新碱、地塞米松(VP)治疗,为进一步降低低危组患儿药物毒性提高生存质量做出有益的探索。2023年广东-ALL-2008[93]发布VP脉冲治疗在儿童ALL多中心随机对照Ⅲ期临床研究结果,该研究经过长达十年随访进一步证实:儿童高危ALL可以通过VP脉冲治疗生存获益,而标危组及中危组去除VP脉冲治疗并不影响预后。这些研究结果再次为危险度较低ALL患儿取消维持期VP脉冲治疗提供了临床依据。CCCG协作组对[94]费城染色体阳性(Ph+)-ALL采用达沙替尼、伊马替尼随机对照研究并证实达沙替尼治疗组(80mg/m2)生存率明显优于伊马替尼300mg/m2 (4年EFS:71.0%比 48.9%,P=0.007;4年OS :88.4%比69.2%,P=0.04),4年复发率显著降低。2023年CCLG儿童急性髓系白血病(AML)全国多中心研究结果发表:高三尖酯碱(HTT,H)联合柔红霉素(DNR,D)、阿糖胞苷(Ara-c, A)(HAD方案)诱导缓解治疗初诊及R/R AML完全缓解率(CR)及生存率明显优于DNR、Ara-c联合依托泊苷(VP-16,E)(DAE)(CR 79.9%比73.9%,P=0.014;3年OS 69.2% 比62.8%,P=0.025;3年 EFS 61.1%比53.4%,P=0.022)[95]。CCLG-急性早幼粒细胞白血病(APL)2016方案研究结果表明砷剂联合全反式维甲酸(ATRA)是儿童APL安全有效的治疗方案,2年EFS可达90%以上[96]。SCCLG-APL 2011 开展多中心随机对照研究中期结果表明[97]复方黄黛片在儿童APL疗效及安全性与砷剂相当,2组5年预期EFS均达到100%。近期有国内研究团队[98]在儿童血液肿瘤微小残留病(MRD)监测领域开展了创新性工作,该研究通过二代测序技术(NGS)监测MRD甄别出高达26.2%的诱导治疗后高危病例,为白血病危险度分层、个体化治疗提供了敏感检测手段。国内部分中心已开始尝试NGS方法监测ALL MRD,但NGS技术在国内应用时间较短,通常由第三方检测机构完成,质控标准一致性不强且价格比较昂贵,检测周期较长,还需进一步标准化才有望推广应用。此外还有关于特殊融合基因类型,髓系白血病危险度分层预后积分系统,白血病患儿生活质量以及白血病发生、药物反应以及复发耐药机制研究等等相继发表,在世界舞台上发出中国学者在儿童血液肿瘤领域的声音。未来继续开展全国多中心协作、提倡诊治流程的同质化管理对于我国儿童血液肿瘤整体诊治水平提高、儿童肿瘤患儿生存质量改善意义重大。
3.3.2 儿童血液肿瘤研究存在的不足
血液肿瘤性疾病因其高发病率严重威胁到儿童的生命及身心健康,国家目前对于儿童健康方面予以高度的重视,在这种情势下如何推动儿童血液病的防、控、诊、治、康成为目前医疗卫生乃至全社会亟待解决的问题。未来儿童血液肿瘤发展仍应以落实规范化诊疗,强化同质化管理为根本着眼点,进一步细化危险度分层指标,优化MRD指导下的个体化治疗方案,发挥全国多中心协作组的优势,开展更多的高水平新药临床研究,同时建立并完善罕见血液肿瘤性疾病的登记系统、数据库及样本库,助力我国儿童血液肿瘤领域的高质量创新发展,造福更多的患儿及家庭。
3.3.3 儿童实体肿瘤研究存在的优势
庞大的患者群体与丰富的疾病谱:我国拥有庞大的儿童人口基数,因此儿童实体肿瘤的患病人数也相对较多。这使得我国在开展儿童实体肿瘤的研究时,能够积累丰富的临床数据和样本资源。同时,由于儿童实体肿瘤的疾病谱广泛,涵盖了多种不同类型的肿瘤,这为我国的研究者提供了丰富的研究对象,有助于更全面地了解儿童实体肿瘤的发生、发展机制和制定有效的治疗策略。
医疗技术的不断进步:近年来,我国在医疗技术方面取得了显著的进步,包括手术、放疗、化疗以及免疫治疗等。这些技术的进步为儿童实体肿瘤的治疗提供了更多的选择,也提高了治疗效果。同时,随着基因测序、生物信息学等技术的发展,我国的研究者能够更深入地了解儿童实体肿瘤的分子机制,为精准治疗提供了可能。
多学科协作与综合治疗模式:儿童实体肿瘤的治疗需要多学科的协作,包括外科、肿瘤科、放射科、病理科等。在我国,越来越多的医疗机构开始建立多学科协作团队,共同制定治疗方案,提高治疗效果。同时,综合治疗模式的应用也越来越广泛,包括手术联合化疗、放疗、免疫治疗等,这有助于提高患儿的生存率和生活质量。
3.3.4 儿童实体肿瘤研究存在的不足
基础研究相对薄弱:尽管我国在儿童实体肿瘤的临床治疗方面取得了一定的进步,但在基础研究方面仍然相对薄弱。对于儿童实体肿瘤的发病机制、分子靶点等方面的研究还不够深入,这限制了我国在精准治疗和新药研发方面的进展。
临床数据共享与利用不足:目前,我国儿童实体肿瘤的临床数据共享和利用程度仍然较低。不同医疗机构之间的数据互通和协作不足,导致大量有价值的临床数据无法得到充分利用。这限制了我国在儿童实体肿瘤研究方面的深度和广度。
创新药物和治疗手段缺乏:尽管我国在医疗技术方面取得了进步,但在创新药物和治疗手段方面仍然缺乏。目前,许多儿童实体肿瘤的治疗仍然依赖于传统的化疗和放疗手段,而这些手段往往存在较大的副作用和耐药性问题。因此,开发新的创新药物和治疗手段是我国在儿童实体肿瘤领域亟待解决的问题之一。
科普宣传与早期筛查不足:儿童实体肿瘤的早期发现和治疗对于提高患儿的生存率和生活质量至关重要。然而,目前我国在科普宣传和早期筛查方面的投入仍然不足。许多家长和儿童对于儿童实体肿瘤的认识不够深入,缺乏早期筛查的意识和方法。这导致许多患儿在确诊时已经错过了最佳的治疗时机。因此,加强科普宣传和早期筛查是我国在儿童实体肿瘤领域需要重视的问题之一。
【主编】
王焕民 首都医科大学附属北京儿童医院
竺晓凡 中国医学科学院血液病医院
高怡瑾 上海交通大学医学院附属上海儿童医学中心
汤永民 浙江大学医学院附属儿童医院
赵 强 天津医科大学肿瘤医院
张翼鷟 中山大学肿瘤防治中心
【副主编】
徐晓军 浙江大学医学院附属儿童医院
黎 阳 中山大学孙逸仙纪念医院
金润铭 华中科技大学同济医学院附属协和医院
高 亚 西安交通大学第二附属医院
闫 杰 天津医科大学肿瘤医院
秦 红 首都医科大学附属北京儿童医院
王 珊 重庆医科大学附属儿童医院
黄东生 首都医科大学北京同仁医院
【编委】(按姓氏拼音排序)
杨文钰 中国医学科学院血液病医院
徐 敏 上海交通大学医学院附属上海儿童医学中心
李 杰 天津医科大学肿瘤医院
成海燕 首都医科大学附属北京儿童医院
李璋琳 天津医科大学肿瘤医院
苏 雁 首都医科大学附属北京儿童医院
施诚仁 上海交通大学医学院附属新华医院
汤静燕 上海交通大学医学院附属上海儿童医学中心
殷敏智 上海交通大学医学院附属上海儿童医学中心
陈 静 上海交通大学医学院附属上海儿童医学中心
姜大朋 上海交通大学医学院附属上海儿童医学中心
韩亚丽 上海交通大学医学院附属上海儿童医学中心
汤燕静 上海交通大学医学院附属上海儿童医学中心
蔡娇阳 上海交通大学医学院附属上海儿童医学中心
张安安 上海交通大学医学院附属上海儿童医学中心
钟玉敏 上海交通大学医学院附属上海儿童医学中心
汪 健 苏州大学附属儿童医院
胡邵燕 苏州大学附属儿童医院
王金湖 浙江大学医学院附属儿童医院
杨 超 重庆医科大学附属儿童医院
王珍妮 重庆医科大学附属儿童医院
张 谊 首都医科大学北京同仁医院
蒋马伟 上海交通大学医学院附属新华医院
袁晓军 上海交通大学医学院附属新华医院
杨 深 首都医科大学附属北京儿童医院
郑胡镛 首都医科大学附属北京儿童医院
彭晓敏 中山大学孙逸仙纪念医院
熊稀霖 中山大学孙逸仙纪念医院
周 芬 华中科技大学同济医学院附属协和医院
段 超 首都医科大学附属北京儿童医院
阙 旖 中山大学肿瘤防治中心
朱富艺 首都医科大学附属北京儿童医院
万 扬 中国医学科学院血液病医院
靳 燕 天津医科大学肿瘤医院
沈树红 上海交通大学医学院附属上海儿童医学中心
参考文献(References)
1.倪鑫 张, 胡亚美: 国家儿童肿瘤监测年报(2022). 北京:人民卫生出版社 2022, 4.
2.Liu Y, Zhang J, Cao F, Dong X, Li J, Cao Y, Li Z, Guo Y, Yan J, Liu Y et al: N6-methyladenosine-mediated overexpression of long noncoding RNA ADAMTS9-AS2 triggers neuroblastoma differentiation via regulating LIN28B/let-7/MYCN signaling. JCI Insight 2023, 8(22).
3.Decaesteker B, Louwagie A, Loontiens S, De Vloed F, Bekaert SL, Roels J, Vanhauwaert S, De Brouwer S, Sanders E, Berezovskaya A et al: SOX11 regulates SWI/SNF complex components as member of the adrenergic neuroblastoma core regulatory circuitry. Nat Commun 2023, 14(1):1267.
4.Dong R, Yang R, Zhan Y, Lai HD, Ye CJ, Yao XY, Luo WQ, Cheng XM, Miao JJ, Wang JF et al: Single-Cell Characterization of Malignant Phenotypes and Developmental Trajectories of Adrenal Neuroblastoma. Cancer Cell 2020, 38(5):716-733 e716.
5.Feng Y, Qi S, Liu X, Zhang L, Hu Y, Shen Q, Gong X, Zhang W, Wang J, Yan W et al: Have we been qualifying measurable residual disease correctly? Leukemia 2023, 37(11):2168-2172.
6.Chen C, Hu C, He B, Bai Y, He F, Li S, Tan CS: Functionalized GD2 Electrochemical Immunosensor to Diagnose Minimum Residual Disease of Bone Marrow in Neuroblastoma Effectively. Biosensors (Basel) 2023, 13(10).
7.Wang H, Sun H, Liang B, Zhang F, Yang F, Cui B, Ding L, Wang X, Wang R, Cai J et al: Chromatin accessibility landscape of relapsed pediatric B-lineage acute lymphoblastic leukemia. Nat Commun 2023, 14(1):6792.
8.Zafar A, Wang W, Liu G, Wang X, Xian W, McKeon F, Foster J, Zhou J, Zhang R: Molecular targeting therapies for neuroblastoma: Progress and challenges. Med Res Rev 2021, 41(2):961-1021.
9.Qiu B, Matthay KK: Advancing therapy for neuroblastoma. Nat Rev Clin Oncol 2022, 19(8):515-533.
10.Ren Q, Yang S, Chang S, Yang W, Cheng H, Chang X, Zhu Z, Yu T, Feng J, Han J et al: Renal preservation in high-risk retroperitoneal neuroblastoma: Impact on survival and local progression. Eur J Surg Oncol 2024, 50(1):107303.
11.Lerman BJ, Li Y, Carlowicz C, Granger M, Cash T, Sadanand A, Somers K, Ranavaya A, Weiss BD, Choe M et al: Progression-Free Survival and Patterns of Response in Patients With Relapsed High-Risk Neuroblastoma Treated With Irinotecan/Temozolomide/Dinutuximab/Granulocyte-Macrophage Colony-Stimulating Factor. J Clin Oncol 2023, 41(3):508-516.
12.Del Bufalo F, De Angelis B, Caruana I, Del Baldo G, De Ioris MA, Serra A, Mastronuzzi A, Cefalo MG, Pagliara D, Amicucci M et al: GD2-CART01 for Relapsed or Refractory High-Risk Neuroblastoma. N Engl J Med 2023, 388(14):1284-1295.
13.Sha YL, Liu Y, Yang JX, Wang YY, Gong BC, Jin Y, Qu TY, Xia FT, Han L, Zhao Q: B3GALT4 remodels the tumor microenvironment through GD2-mediated lipid raft formation and the c-met/AKT/mTOR/IRF-1 axis in neuroblastoma. J Exp Clin Cancer Res 2022, 41(1):314.
14.Song M, Huang Y, Hong Y, Liu J, Zhu J, Lu S, Wang J, Sun F, Huang J, Xu J et al: PD-L1-expressing natural killer cells predict favorable prognosis and response to PD-1/PD-L1 blockade in neuroblastoma. Oncoimmunology 2024, 13(1):2289738.
15.Su Y, Luo B, Lu Y, Wang D, Yan J, Zheng J, Xiao J, Wang Y, Xue Z, Yin J et al: Anlotinib Induces a T Cell-Inflamed Tumor Microenvironment by Facilitating Vessel Normalization and Enhances the Efficacy of PD-1 Checkpoint Blockade in Neuroblastoma. Clinical cancer research : an official journal of the American Association for Cancer Research 2022, 28(4):793-809.
16.Skapek SX, Ferrari A, Gupta AA, Lupo PJ, Butler E, Shipley J, Barr FG, Hawkins DS: Rhabdomyosarcoma. Nat Rev Dis Primers 2019, 5(1):1.
17.Bisogno G, Minard-Colin V, Zanetti I, Ferrari A, Gallego S, Davila Fajardo R, Mandeville H, Kelsey A, Alaggio R, Orbach D et al: Nonmetastatic Rhabdomyosarcoma in Children and Adolescents: Overall Results of the European Pediatric Soft Tissue Sarcoma Study Group RMS2005 Study. J Clin Oncol 2023, 41(13):2342-2349.
18.Casanova M, Bautista F, Campbell-Hewson Q, Makin G, Marshall LV, Verschuur AC, Canete Nieto A, Corradini N, Ploeger BA, Brennan BJ et al: Regorafenib plus Vincristine and Irinotecan in Pediatric Patients with Recurrent/Refractory Solid Tumors: An Innovative Therapy for Children with Cancer Study. Clinical cancer research : an official journal of the American Association for Cancer Research 2023, 29(21):4341-4351.
19.DeMartino J, Meister MT, Visser LL, Brok M, Groot Koerkamp MJA, Wezenaar AKL, Hiemcke-Jiwa LS, de Souza T, Merks JHM, Rios AC et al: Single-cell transcriptomics reveals immune suppression and cell states predictive of patient outcomes in rhabdomyosarcoma. Nat Commun 2023, 14(1):3074.
20.Kawai A, Ishihara M, Nakamura T, Kitano S, Iwata S, Takada K, Emori M, Kato K, Endo M, Matsumoto Y et al: Safety and Efficacy of NY-ESO-1 Antigen-Specific T-Cell Receptor Gene-Transduced T Lymphocytes in Patients with Synovial Sarcoma: A Phase I/II Clinical Trial. Clinical cancer research : an official journal of the American Association for Cancer Research 2023, 29(24):5069-5078.
21.Xie W, Xu J, Lu S, Zhang Y: Current therapeutic landscape and resistance mechanisms to larotrectinib. Cancer Biol Med 2024, 20(12):967-971.
22.Chen AP, Sharon E, O'Sullivan-Coyne G, Moore N, Foster JC, Hu JS, Van Tine BA, Conley AP, Read WL, Riedel RF et al: Atezolizumab for Advanced Alveolar Soft Part Sarcoma. N Engl J Med 2023, 389(10):911-921.
23.Jiang Y, Wang J, Sun M, Zuo D, Wang H, Shen J, Jiang W, Mu H, Ma X, Yin F et al: Multi-omics analysis identifies osteosarcoma subtypes with distinct prognosis indicating stratified treatment. Nat Commun 2022, 13(1):7207.
24.Mensali N, Koksal H, Joaquina S, Wernhoff P, Casey NP, Romecin P, Panisello C, Rodriguez R, Vimeux L, Juzeniene A et al: ALPL-1 is a target for chimeric antigen receptor therapy in osteosarcoma. Nat Commun 2023, 14(1):3375.
25.Italiano A, Mir O, Mathoulin-Pelissier S, Penel N, Piperno-Neumann S, Bompas E, Chevreau C, Duffaud F, Entz-Werle N, Saada E et al: Cabozantinib in patients with advanced Ewing sarcoma or osteosarcoma (CABONE): a multicentre, single-arm, phase 2 trial. Lancet Oncol 2020, 21(3):446-455.
26.Xiang X, Hao Y, Cheng C, Hu H, Chen H, Tan J, Wang Y, Liu X, Peng B, Liao J et al: A TGF-beta-dominant chemoresistant phenotype of hepatoblastoma associated with aflatoxin exposure in children. Hepatology 2024, 79(3):650-665.
27.Tang MJ, Ma XL, He XL, Pan WH, Zhang XH, Jiang SY, Gao J, Li F, Yao W, Gu S et al: A multicenter prospective study on the management of hepatoblastoma in children: a report from the Chinese Children's Cancer Group. World J Pediatr 2023.
28.Weil BR, Murphy AJ, Liu Q, Howell RM, Smith SA, Weldon CB, Mullen EA, Madenci AL, Leisenring WM, Neglia JP et al: Late Health Outcomes Among Survivors of Wilms Tumor Diagnosed Over Three Decades: A Report From the Childhood Cancer Survivor Study. J Clin Oncol 2023, 41(14):2638-2650.
29.Gadd S, Huff V, Skol AD, Renfro LA, Fernandez CV, Mullen EA, Jones CD, Hoadley KA, Yap KL, Ramirez NC et al: Genetic changes associated with relapse in favorable histology Wilms tumor: A Children's Oncology Group AREN03B2 study. Cell reports Medicine 2022, 3(6):100644.
30.Madanat-Harjuoja LM, Renfro LA, Klega K, Tornwall B, Thorner AR, Nag A, Dix D, Dome JS, Diller LR, Fernandez CV et al: Circulating Tumor DNA as a Biomarker in Patients With Stage III and IV Wilms Tumor: Analysis From a Children's Oncology Group Trial, AREN0533. J Clin Oncol 2022, 40(26):3047-3056.
31.Cohen AR: Brain Tumors in Children. N Engl J Med 2022, 386(20):1922-1931.
32.Trivedi V, Yang C, Klippel K, Yegorov O, von Roemeling C, Hoang-Minh L, Fenton G, Ogando-Rivas E, Castillo P, Moore G et al: mRNA-based precision targeting of neoantigens and tumor-associated antigens in malignant brain tumors. Genome Med 2024, 16(1):17.
33.Das A, Fernandez NR, Levine A, Bianchi V, Stengs LK, Chung J, Negm L, Dimayacyac JR, Chang Y, Nobre L et al: Combined Immunotherapy Improves Outcome for Replication-Repair-Deficient (RRD) High-Grade Glioma Failing Anti-PD-1 Monotherapy: A Report from the International RRD Consortium. Cancer Discov 2024, 14(2):258-273.
34.Bouffet E, Geoerger B, Moertel C, Whitlock JA, Aerts I, Hargrave D, Osterloh L, Tan E, Choi J, Russo M et al: Efficacy and Safety of Trametinib Monotherapy or in Combination With Dabrafenib in Pediatric BRAF V600-Mutant Low-Grade Glioma. J Clin Oncol 2023, 41(3):664-674.
35.Haas-Kogan DA, Aboian MS, Minturn JE, Leary SES, Abdelbaki MS, Goldman S, Elster JD, Kraya A, Lueder MR, Ramakrishnan D et al: Everolimus for Children With Recurrent or Progressive Low-Grade Glioma: Results From the Phase II PNOC001 Trial. J Clin Oncol 2024, 42(4):441-451.
36.Kilburn LB, Khuong-Quang DA, Hansford JR, Landi D, van der Lugt J, Leary SES, Driever PH, Bailey S, Perreault S, McCowage G et al: The type II RAF inhibitor tovorafenib in relapsed/refractory pediatric low-grade glioma: the phase 2 FIREFLY-1 trial. Nat Med 2024, 30(1):207-217.
37.Chapman OS, Luebeck J, Sridhar S, Wong IT, Dixit D, Wang S, Prasad G, Rajkumar U, Pagadala MS, Larson JD et al: Circular extrachromosomal DNA promotes tumor heterogeneity in high-risk medulloblastoma. Nat Genet 2023, 55(12):2189-2199.
38.Zhang J, Yang Y, Li X, Li G, Mizukami T, Liu Y, Wang Y, Xu G, Roder H, Zhang L et al: PDLIM3 supports hedgehog signaling in medulloblastoma by facilitating cilia formation. Cell Death Differ 2023, 30(5):1198-1210.
39.Wang D, Yan K, Yu H, Li H, Zhou W, Hong Y, Guo S, Wang Y, Xu C, Pan C et al: Fimepinostat Impairs NF-kappaB and PI3K/AKT Signaling and Enhances Gemcitabine Efficacy in H3.3K27M-Diffuse Intrinsic Pontine Glioma. Cancer Res 2024, 84(4):598-615.
40.Takami H, Ichimura K: Biomarkers for risk-based treatment modifications for CNS germ cell tumors: Updates on biological underpinnings, clinical trials, and future directions. Front Oncol 2022, 12:982608.
41.Zeng C, Yang Q, Li Z, Wei Z, Chen T, Deng M, Wang J, Wang J, Sun F, Huang J et al: Treatment Outcome of Response-Based Radiation Therapy in Children and Adolescents With Central Nervous System Nongerminomatous Germ Cell Tumors: Results of a Prospective Study. International journal of radiation oncology, biology, physics 2023.
42.Fonseca A, Frazier AL, Shaikh F: Germ Cell Tumors in Adolescents and Young Adults. J Oncol Pract 2019, 15(8):433-441.
43.Singla N, Wong J, Singla S, Krailo M, Huang L, Shaikh F, Billmire D, Rescorla F, Ross J, Dicken B et al: Clinicopathologic predictors of outcomes in children with stage I testicular germ cell tumors: A pooled post hoc analysis of trials from the Children's Oncology Group. J Pediatr Urol 2022, 18(4):505-511.
44.Faure-Conter C, Orbach D, Sudour-Bonnange H, Verite C, Mansuy L, Rome A, Dumesnil C, Thebaud E, Renard M, Hameury F et al: Extracranial germ cell tumours in children and adolescents: Results from the French TGM13 protocol. Pediatr Blood Cancer 2023, 70(3):e30117.
45.Fankhauser CD, Nuno MM, Murray MJ, Frazier L, Bagrodia A: Circulating MicroRNAs for Detection of Germ Cell Tumours: A Narrative Review. Eur Urol Focus 2022, 8(3):660-662.
46.Dieckmann KP, Radtke A, Geczi L, Matthies C, Anheuser P, Eckardt U, Sommer J, Zengerling F, Trenti E, Pichler R et al: Serum Levels of MicroRNA-371a-3p (M371 Test) as a New Biomarker of Testicular Germ Cell Tumors: Results of a Prospective Multicentric Study. J Clin Oncol 2019, 37(16):1412-1423.
47.Hu T, Fang Y, Sun Q, Zhao H, Ma D, Zhu T, Wang C: Clinical management of malignant ovarian germ cell tumors: A 26-year experience in a tertiary care institution. Surg Oncol 2019, 31:8-13.
48.王珍妮 王, 李长春等: 700例儿童颅外生殖细胞肿瘤单中心临床诊疗总结. 中国小儿血液与肿瘤杂志 2023, 28((04)):231-236.
49.张成航 王, 李长春,等: 儿童颅外转移性恶性生殖细胞肿瘤诊治经验总结. 中华转移性肿瘤杂志 2021, 04((4)):274-278.
50.Jiang S, Dong K, Li K, Liu J, Du X, Huang C, Jiao Y, Han Y, Yang J, Liao X et al: Extracranial Germ Cell Tumors in Children: Ten Years of Experience in Three Children's Medical Centers in Shanghai. Cancers (Basel) 2023, 15(22).
51.Zhang Y, Wang YZ, Shi JT, Ma JM, Li B, Zhang WL, Gu HL, Zhou Y, Mei YY, Li S et al: Clinical analysis of 2790 children with retinoblastoma: a single-center experience in China. World J Pediatr 2023, 19(12):1169-1180.
52.Global Retinoblastoma Study G: The Global Retinoblastoma Outcome Study: a prospective, cluster-based analysis of 4064 patients from 149 countries. Lancet Glob Health 2022, 10(8):e1128-e1140.
53.Global Retinoblastoma Study G, Fabian ID, Abdallah E, Abdullahi SU, Abdulqader RA, Adamou Boubacar S, Ademola-Popoola DS, Adio A, Afshar AR, Aggarwal P et al: Global Retinoblastoma Presentation and Analysis by National Income Level. JAMA Oncol 2020, 6(5):685-695.
54.Wang W, Zhang X, Zhao N, Xu ZH, Jin K, Jin ZB: RNA fusion in human retinal development. Elife 2024, 13.
55.Rodriguez-Galindo C, Krailo MD, Pinto EM, Pashankar F, Weldon CB, Huang L, Caran EM, Hicks J, McCarville MB, Malkin D et al: Treatment of Pediatric Adrenocortical Carcinoma With Surgery, Retroperitoneal Lymph Node Dissection, and Chemotherapy: The Children's Oncology Group ARAR0332 Protocol. J Clin Oncol 2021, 39(22):2463-2473.
56.von Stackelberg A, Locatelli F, Zugmaier G, Handgretinger R, Trippett TM, Rizzari C, Bader P, O'Brien MM, Brethon B, Bhojwani D et al: Phase I/Phase II Study of Blinatumomab in Pediatric Patients With Relapsed/Refractory Acute Lymphoblastic Leukemia. J Clin Oncol 2016, 34(36):4381-4389.
57.Locatelli F, Zugmaier G, Mergen N, Bader P, Jeha S, Schlegel PG, Bourquin JP, Handgretinger R, Brethon B, Rossig C et al: Blinatumomab in pediatric relapsed/refractory B-cell acute lymphoblastic leukemia: RIALTO expanded access study final analysis. Blood advances 2022, 6(3):1004-1014.
58.Locatelli F, Zugmaier G, Rizzari C, Morris JD, Gruhn B, Klingebiel T, Parasole R, Linderkamp C, Flotho C, Petit A et al: Effect of Blinatumomab vs Chemotherapy on Event-Free Survival Among Children With High-risk First-Relapse B-Cell Acute Lymphoblastic Leukemia: A Randomized Clinical Trial. Jama 2021, 325(9):843-854.
59.Brown PA, Ji L, Xu X, Devidas M, Hogan LE, Borowitz MJ, Raetz EA, Zugmaier G, Sharon E, Bernhardt MB et al: Effect of Postreinduction Therapy Consolidation With Blinatumomab vs Chemotherapy on Disease-Free Survival in Children, Adolescents, and Young Adults With First Relapse of B-Cell Acute Lymphoblastic Leukemia: A Randomized Clinical Trial. Jama 2021, 325(9):833-842.
60.Angus H AK, Susan B, et al.: Blinatumomab as toxicity sparing first line treatment of children and young persons with B-precursor acute lymphoblastic leukemia (B-ALL). ASH 2022:Poster Abstracts 4052.
61.Xue CW WC, Yang WY, et al.: Infusion of 14 days blinatumomab in combination with chemotherapy for 46-day MRD+ pediatric B-ALL patients in intermediate/high - risk group results in MRD conversion. EHA 2023:Abstract P1402.
62.Queudeville M, Stein AS, Locatelli F, Ebinger M, Handgretinger R, Gökbuget N, Gore L, Zeng Y, Gokani P, Zugmaier G et al: Low leukemia burden improves blinatumomab efficacy in patients with relapsed/refractory B-cell acute lymphoblastic leukemia. Cancer 2023, 129(9):1384-1393.
63.Bhojwani D, Sposto R, Shah NN, Rodriguez V, Yuan C, Stetler-Stevenson M, O'Brien MM, McNeer JL, Quereshi A, Cabannes A et al: Inotuzumab ozogamicin in pediatric patients with relapsed/refractory acute lymphoblastic leukemia. Leukemia 2019, 33(4):884-892.
64.Pennesi E, Michels N, Brivio E, van der Velden VHJ, Jiang Y, Thano A, Ammerlaan AJC, Boer JM, Beverloo HB, Sleight B et al: Inotuzumab ozogamicin as single agent in pediatric patients with relapsed and refractory acute lymphoblastic leukemia: results from a phase II trial. Leukemia 2022, 36(6):1516-1524.
65.Maude SL, Laetsch TW, Buechner J, Rives S, Boyer M, Bittencourt H, Bader P, Verneris MR, Stefanski HE, Myers GD et al: Tisagenlecleucel in Children and Young Adults with B-Cell Lymphoblastic Leukemia. N Engl J Med 2018, 378(5):439-448.
66.Lee DW, Kochenderfer JN, Stetler-Stevenson M, Cui YK, Delbrook C, Feldman SA, Fry TJ, Orentas R, Sabatino M, Shah NN et al: T cells expressing CD19 chimeric antigen receptors for acute lymphoblastic leukaemia in children and young adults: a phase 1 dose-escalation trial. Lancet 2015, 385(9967):517-528.
67.Pulsipher MA: Are CAR T cells better than antibody or HCT therapy in B-ALL? Hematology American Society of Hematology Education Program 2018, 2018(1):16-24.
68.Davila ML, Riviere I, Wang X, Bartido S, Park J, Curran K, Chung SS, Stefanski J, Borquez-Ojeda O, Olszewska M et al: Efficacy and toxicity management of 19-28z CAR T cell therapy in B cell acute lymphoblastic leukemia. Sci Transl Med 2014, 6(224):224ra225.
69.Park JH, Riviere I, Gonen M, Wang X, Senechal B, Curran KJ, Sauter C, Wang Y, Santomasso B, Mead E et al: Long-Term Follow-up of CD19 CAR Therapy in Acute Lymphoblastic Leukemia. N Engl J Med 2018, 378(5):449-459.
70.Maude SL, Frey N, Shaw PA, Aplenc R, Barrett DM, Bunin NJ, Chew A, Gonzalez VE, Zheng Z, Lacey SF et al: Chimeric antigen receptor T cells for sustained remissions in leukemia. N Engl J Med 2014, 371(16):1507-1517.
71.Chen X, Wang Y, Ruan M, Li J, Zhong M, Li Z, Liu F, Wang S, Chen Y, Liu L et al: Treatment of Testicular Relapse of B-cell Acute Lymphoblastic Leukemia With CD19-specific Chimeric Antigen Receptor T Cells. Clin Lymphoma Myeloma Leuk 2020, 20(6):366-370.
72.Zhang H, Wang P, Li Z, He Y, Gan W, Jiang H: Anti-CLL1 Chimeric Antigen Receptor T-Cell Therapy in Children with Relapsed/Refractory Acute Myeloid Leukemia. Clinical cancer research : an official journal of the American Association for Cancer Research 2021, 27(13):3549-3555.
73.Merchant TE, Hoehn ME, Khan RB, Sabin ND, Klimo P, Boop FA, Wu S, Li Y, Burghen EA, Jurbergs N et al: Proton therapy and limited surgery for paediatric and adolescent patients with craniopharyngioma (RT2CR): a single-arm, phase 2 study. Lancet Oncol 2023, 24(5):523-534.
74.Koscielniak E, Timmermann B, Münter M, Weclawek-Tompol J, Ladenstein R, Niggli F, Ljungman G, Brecht IB, Blank B, Hallmen E et al: Which Patients With Rhabdomyosarcoma Need Radiotherapy? Analysis of the Radiotherapy Strategies of the CWS-96 and CWS-2002P Studies and SoTiSaR Registry. J Clin Oncol 2023, 41(31):4916-4926.
75.Kojadinovic A, Laderian B, Mundi PS: Targeting TRK: A fast-tracked application of precision oncology and future directions. Critical reviews in oncology/hematology 2021, 165:103451.
76.Zhao X, Kotch C, Fox E, Surrey LF, Wertheim GB, Baloch ZW, Lin F, Pillai V, Luo M, Kreiger PA et al: NTRK Fusions Identified in Pediatric Tumors: The Frequency, Fusion Partners, and Clinical Outcome. JCO precision oncology 2021, 1.
77.Gross AM, Wolters PL, Dombi E, Baldwin A, Whitcomb P, Fisher MJ, Weiss B, Kim A, Bornhorst M, Shah AC et al: Selumetinib in Children with Inoperable Plexiform Neurofibromas. N Engl J Med 2020, 382(15):1430-1442.
78.Goldsmith KC, Park JR, Kayser K, Malvar J, Chi YY, Groshen SG, Villablanca JG, Krytska K, Lai LM, Acharya PT et al: Lorlatinib with or without chemotherapy in ALK-driven refractory/relapsed neuroblastoma: phase 1 trial results. Nat Med 2023, 29(5):1092-1102.
79.Heczey A, Xu X, Courtney AN, Tian G, Barragan GA, Guo L, Amador CM, Ghatwai N, Rathi P, Wood MS et al: Anti-GD2 CAR-NKT cells in relapsed or refractory neuroblastoma: updated phase 1 trial interim results. Nat Med 2023, 29(6):1379-1388.
80.Que Y, Wang J, Sun F, Wang S, Zhu J, Huang J, Zhao Z, Zhang L, Liu J, Xu J et al: Safety and clinical efficacy of sintilimab (anti-PD-1) in pediatric patients with advanced or recurrent malignancies in a phase I study. Signal Transduct Target Ther 2023, 8(1):392.
81.Touat M, Li YY, Boynton AN, Spurr LF, Iorgulescu JB, Bohrson CL, Cortes-Ciriano I, Birzu C, Geduldig JE, Pelton K et al: Mechanisms and therapeutic implications of hypermutation in gliomas. Nature 2020, 580(7804):517-523.
82.Christodoulou E, Yellapantula V, O'Halloran K, Xu L, Berry JL, Cotter JA, Zdanowicz A, Mascarenhas L, Amatruda JF, Ostrow D et al: Combined low-pass whole genome and targeted sequencing in liquid biopsies for pediatric solid tumors. NPJ Precis Oncol 2023, 7(1):21.
83.Berko ER, Witek GM, Matkar S, Petrova ZO, Wu MA, Smith CM, Daniels A, Kalna J, Kennedy A, Gostuski I et al: Circulating tumor DNA reveals mechanisms of lorlatinib resistance in patients with relapsed/refractory ALK-driven neuroblastoma. Nat Commun 2023, 14(1):2601.
84.Abbou S, Klega K, Tsuji J, Tanhaemami M, Hall D, Barkauskas DA, Krailo MD, Cibulskis C, Nag A, Thorner AR et al: Circulating Tumor DNA Is Prognostic in Intermediate-Risk Rhabdomyosarcoma: A Report From the Children's Oncology Group. J Clin Oncol 2023, 41(13):2382-2393.
85.Kotrova M, Koopmann J, Trautmann H, Alakel N, Beck J, Nachtkamp K, Steffen B, Raffel S, Viardot A, Wethmar K et al: Prognostic value of low-level MRD in adult acute lymphoblastic leukemia detected by low- and high-throughput methods. Blood advances 2022, 6(10):3006-3010.
86.Short NJ, Kantarjian H, Ravandi F, Konopleva M, Jain N, Kanagal-Shamanna R, Patel KP, Macaron W, Kadia TM, Wang S et al: High-sensitivity next-generation sequencing MRD assessment in ALL identifies patients at very low risk of relapse. Blood advances 2022, 6(13):4006-4014.
87.Yu SC, Lee SW, Jiang P, Leung TY, Chan KC, Chiu RW, Lo YM: High-resolution profiling of fetal DNA clearance from maternal plasma by massively parallel sequencing. Clin Chem 2013, 59(8):1228-1237.
88.Lo YM, Zhang J, Leung TN, Lau TK, Chang AM, Hjelm NM: Rapid clearance of fetal DNA from maternal plasma. Am J Hum Genet 1999, 64(1):218-224.
89.Yeh P, Dickinson M, Ftouni S, Hunter T, Sinha D, Wong SQ, Agarwal R, Vedururu R, Doig K, Fong CY et al: Molecular disease monitoring using circulating tumor DNA in myelodysplastic syndromes. Blood 2017, 129(12):1685-1690.
90.Nakamura S, Yokoyama K, Shimizu E, Yusa N, Kondoh K, Ogawa M, Takei T, Kobayashi A, Ito M, Isobe M et al: Prognostic impact of circulating tumor DNA status post-allogeneic hematopoietic stem cell transplantation in AML and MDS. Blood 2019, 133(25):2682-2695.
91.Ruan M, Liu L, Qi B, Chen X, Chang L, Zhang A, Liu F, Wang S, Liu X, Chen X et al: Targeted Next-Generation Sequencing of Circulating Tumor DNA, Bone Marrow, and Peripheral Blood Mononuclear Cells in Pediatric AML. Front Oncol 2021, 11:666470.
92.Yang W, Cai J, Shen S, Gao J, Yu J, Hu S, Jiang H, Fang Y, Liang C, Ju X et al: Pulse therapy with vincristine and dexamethasone for childhood acute lymphoblastic leukaemia (CCCG-ALL-2015): an open-label, multicentre, randomised, phase 3, non-inferiority trial. Lancet Oncol 2021, 22(9):1322-1332.
93.Qiu KY, Wang JY, Huang LB, Li CG, Xu LH, Liu RY, Chen HQ, Ruan YS, Zhen ZJ, Li CK et al: Vincristine and dexamethasone pulses in addition to maintenance therapy among pediatric acute lymphoblastic leukemia (GD-ALL-2008): An open-label, multicentre, randomized, phase III clinical trial. American journal of hematology 2023, 98(6):869-880.
94.Shen S, Chen X, Cai J, Yu J, Gao J, Hu S, Zhai X, Liang C, Ju X, Jiang H et al: Effect of Dasatinib vs Imatinib in the Treatment of Pediatric Philadelphia Chromosome-Positive Acute Lymphoblastic Leukemia: A Randomized Clinical Trial. JAMA Oncol 2020, 6(3):358-366.
95.Li J, Gao J, Liu A, Liu W, Xiong H, Liang C, Fang Y, Dai Y, Shao J, Yu H et al: Homoharringtonine-Based Induction Regimen Improved the Remission Rate and Survival Rate in Chinese Childhood AML: A Report From the CCLG-AML 2015 Protocol Study. J Clin Oncol 2023, 41(31):4881-4892.
96.Zheng H, Jiang H, Hu S, Liao N, Shen D, Tian X, Hao G, Jin R, Li J, Fang Y et al: Arsenic Combined With All-Trans Retinoic Acid for Pediatric Acute Promyelocytic Leukemia: Report From the CCLG-APL2016 Protocol Study. J Clin Oncol 2021, 39(28):3161-3170.
97.Yang MH, Wan WQ, Luo JS, Zheng MC, Huang K, Yang LH, Mai HR, Li J, Chen HQ, Sun XF et al: Multicenter randomized trial of arsenic trioxide and Realgar-Indigo naturalis formula in pediatric patients with acute promyelocytic leukemia: Interim results of the SCCLG-APL clinical study. American journal of hematology 2018, 93(12):1467-1473.
98.Chen H, Gu M, Liang J, Song H, Zhang J, Xu W, Zhao F, Shen D, Shen H, Liao C et al: Minimal residual disease detection by next-generation sequencing of different immunoglobulin gene rearrangements in pediatric B-ALL. Nat Commun 2023, 14(1):7468.