中国抗癌协会
立即下载App临床应对肿瘤患者重症感染
从危重病急救医学的角度上来说,凡是威胁生命的感染即被称为是重症感染。感染所致的全身多器官功能损害,为重症医学中常见病症,一旦发生重症感染有50%以上的患者发展为脓毒症或感染性休克。重症感染一旦发展为感染性休克,可导致患者全身多器官功能障碍,病死率高、预后差。重度营养不良肿瘤患者极易发生重症感染。
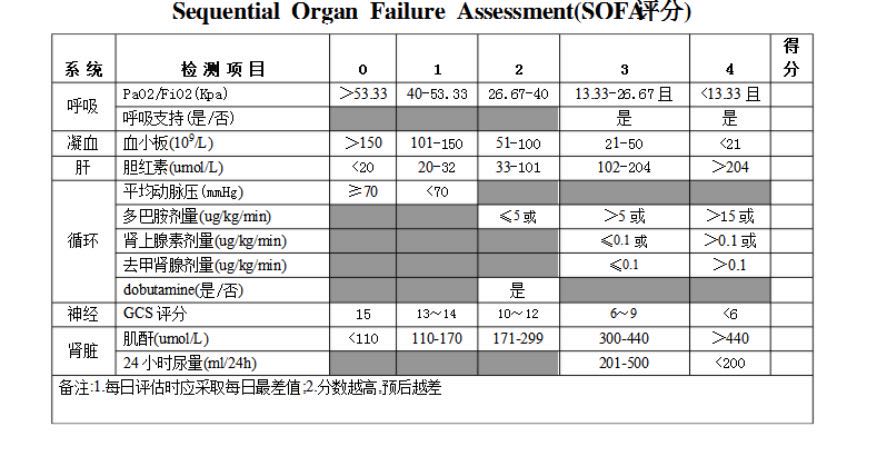
脓毒症就是肿瘤患者机体对感染的反应失调而导致危及生命的器官功能障碍。脓毒症=感染+△SOFA ≥ 2(序贯性器官功能衰竭评分(sequential organ failure assessment, SOFA)。SOFA 评分变化≥ 2 时,认为感染患者出现了器官衰竭的急性变化)。感染性休克是指严重感染导致的肿瘤患者的低血压现象持续存在,经充分的液体复苏难以纠正的急性循环衰竭,可出现迅速导致严重组织器官功能的损伤,主要死亡原因为多器官功能衰竭(multiple organ dysfunction syndrome,MODS)。
(点击表格科放大观看)
抗感染流程
首先判断肿瘤患者是否为重症感染、进而筛查可疑感染部位、再对感染部位导向的抗生素进行选择、评估细菌耐药程度及真菌感染风险。对于感染部位不明时的初始抗感染方案选择覆盖所有可能的病原菌,包括革兰阳性菌和革兰阴性菌; 存在真菌感染危险因素的患者需同时覆盖真菌。病原学获得后尽快针对目标治疗。同时合理应用抗生素:脓毒症患者在 1 h 内开始静脉应用抗生素;给药方案遵循 PK/PD 理论:以青霉素类、头孢类、碳青霉烯类为代表的时间依赖抗生素, 可通过增加给药频次和延长输注时间的方法提高临床疗效;以氨基糖甙类、喹诺酮类为代表的浓度依赖抗生素, 可以通过提高药物浓度来提高临床疗效。
至于抗感染疗程时间,对临床症状改善、患者反应良好、致病菌非多药耐药(multidrug pesistance,MDR) 的肺部感染, 疗程7~10 d;对引流良好的腹腔感染,抗感染疗程应尽量缩短;对于血流感染、骨髓感染、中枢神经系统感染、心内膜炎等特殊部位感染疗程应延长;如果对患者采用包含氨基糖苷类在内的联合治疗,在有良好临床反应的患者中使用 5~7d 可以考虑停用氨基糖苷类;如初始抗生素治疗选择正确, 且患者有良好的临床反应, 感染的临床表现开始消退, 致病菌非 MDR, 可以将疗程缩短至 7 d。疗程需要延长的感染患者包括免疫缺陷患者、起始抗菌药物治疗无效者、多药耐药菌感染者、复发风险高患者,血流感染患者疗程一般需用药至体温恢复正常后 7~10 d;复杂性血流感染全身使用抗菌药物 4~6 周;对确诊的念珠菌血症患者建议首次阴性血培养和临床症状及体征缓解后继续治疗 14 d;对疑似念珠菌血症的经验性治疗,疗程未确定, 但若培养和(或) 血清学检测显示阴性时则停药。可以参考降钙素原等辅助检查结果指导抗感染疗程,但肿瘤患者使用PCT指标需谨慎。
肿瘤患者易发重症感染因素
肿瘤及肿瘤相关治疗都可能造成机体免疫系统损伤,降低患者的免疫力,患者更易发生感染,而伴发营养不良、恶液质、肠梗阻的患者,重症感染的发生率明显升高。①肿瘤本身因素:某些类型的肿瘤会损害免疫系统和血液系统。如淋巴瘤和大多数类型的白血病开始于免疫系统细胞。肿瘤改变了免疫系统细胞,干扰免疫系统正常的功能。血液系统肿瘤细胞进入生成血液细胞的骨髓中,癌细胞与正常的骨髓细胞竞争生存空间和营养。正常骨髓细胞被破坏,剩下的正常细胞不能产生足够的白细胞对抗感染。肿瘤也会损害免疫系统的其他部分,如肿瘤在皮肤或粘膜生长,破坏机体自然屏障,细菌易进入体内。肺部肿瘤可能阻塞正常的气管、支气管等,从而导致阻塞性肺炎和感染。腹腔原发或转移性肿瘤可能通过压迫、侵犯正常组织造成肠梗阻、肠粘膜屏障损伤,造成肠源性感染。恶性胸腹腔积液易发生感染,尤其是置管引流加重感染发生率。②抗肿瘤治疗因素:手术会破坏患者皮肤和粘膜,部分大手术还可抑制机体的免疫组织,使机体易感。化疗所致骨髓抑制及机体不适、免疫力损伤,使机体易感。骨髓抑制中白细胞最易受影响,尤其是粒缺伴发热时重症感染的发生率明显升高。放疗尤其是包含造血功能部分的放疗,患者易出现骨髓抑制,且恢复时间长,增加感染风险。免疫治疗所致的自身免疫性肺炎、自身免疫系统的异常使患者发生感染的风险增加。③营养不良相关因素:肿瘤患者营养不良发生率较高,我国住院患者中重度营养不良发生率高达58%。而营养不良患者的免疫功能通常较弱,感染风险较正常患者明显增加,而重度营养不良尤其是恶液质患者重症感染的发生率及死亡率均较高。建议对肿瘤患者采用PG-SGA法进行营养风险及状况评估,对有营养不良患者及早进行营养支持治疗,遵循中国抗癌协会推荐的五阶梯营养疗法。④肠梗阻:常见所致肠梗阻的瘤种有胃癌、结直肠癌、卵巢癌等,目前肿瘤原因所导致的肠梗阻已占机械性肠梗阻的主要病因。长期肠梗阻会导致肠粘膜缺血、缺氧,粘膜结构再灌注损伤,肠屏障功能障碍,肠道细菌易位、内毒素入血,诱发或加重肠道局部或全身炎症、免疫反应,严重者出现重症感染,甚至MODS。⑤其它:阻塞性肺不张、肠道菌群失调、胸腹腔引流管逆行感染、导管相关性感染、手术术床区感染等。
感染性休克
病理生理学变化。 感染、炎症与免疫反应,当病原微生物入侵时,机体免疫系统被激活,固有免疫发挥效应,同时启动获得性免疫反应,最大限度地清除病原微生物,当感染在可控制的范围内时,免疫系统能够有效发挥防御作用,保护机体的内环境稳定,但免疫反应过度,也会对机体造成损伤。致病微生物作用于机体,激活免疫细胞并释放、分泌细胞因子或炎性介质,启动凝血级联反应,导致SIRS反应;炎症反应加重的同时,抗炎反应也随之加强,机体启动CARS(代偿性抗炎反应综合征)反应,部分患者呈现免疫麻痹或免疫无应答,甚至出现混合拮抗反应综合征(mixed antagonist response syndrome,MARS)。SIRS/CARS造成的组织器官功能障碍反过来影响炎症反应的过程。感染性休克可以不依赖细菌和毒素的持续存在而发生和发展,细菌和毒素仅起到触发急性全身感染的作用,其发展与否及轻重程度则完全取决于机体的反应性。SIRS/CARS的发生发展过程存在个体差异,不完全遵循免疫激活到免疫抑制的先后顺序,且机体的促炎反应和抗炎反应在疾病早期即可同时存在。部分个体在疾病早期表现为过度SIRS反应,炎症介质过量产生,在清除异物抗原及组织碎片的同时造成正常脏器组织的损伤,从而导致器官功能障碍,甚至衰竭部分个体在疾病初期即可表现为明显的免疫抑制状态,出现免疫细胞大量凋亡和免疫器官功能障碍,形成免疫麻痹状态,导致继发感染,最终造成组织器官损伤。见图1。Nature上发表的文章认为,急性全身感染时过度炎症反应和免疫抑制同时发生,而固有免疫表达上调,同时获得性免疫功能下降。患者的免疫反应状态受多种因素影响,包括病原菌的毒力、病原菌的数量、合并的其他疾病、营养状态、年龄,以及细胞因子的基因多态性或其他免疫调节因子及其受体。
感染性休克的微循环变化。感染性休克时外周血管阻力下降,同时容量血管扩张,导致有效循环血量不足,组织器官低灌注,最终发展为微循环障碍。微循环障碍分期:①.缺血性缺氧期(休克早期、休克代偿期);②.淤血性缺氧期(休克进展期、可逆性失代偿期);③.微循环衰竭期(休克难治期、DIC期、不可逆期)。休克各期的出现并不完全遵循渐进的发展规律,也可能无明显的界限,发生感染性休克时,更易诱发DIC或MODS。
感染性休克的诊断是一个综合评估的过程,包括基础生命体征的监测、感染病原学诊断、以及对心血管、呼吸、消化、肝脏、肾脏等各器官系统功能的评估。同时,还需要对微循环功能状态进行评估。见图2及表2、3。
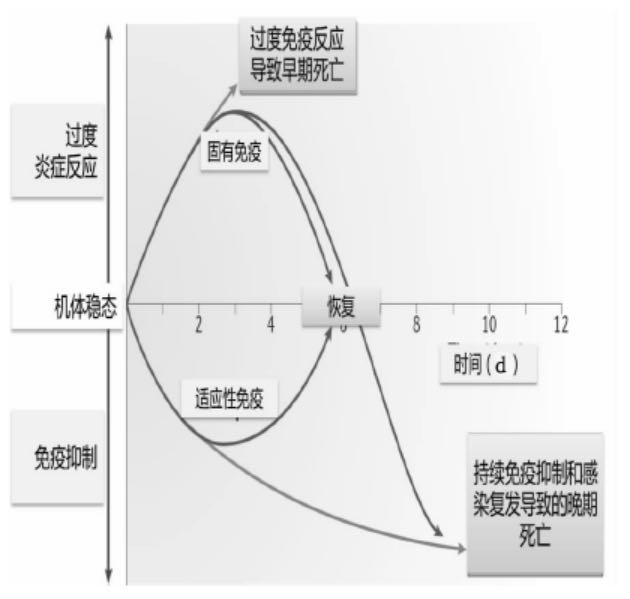
图1.严重感染患者的宿主免疫反应
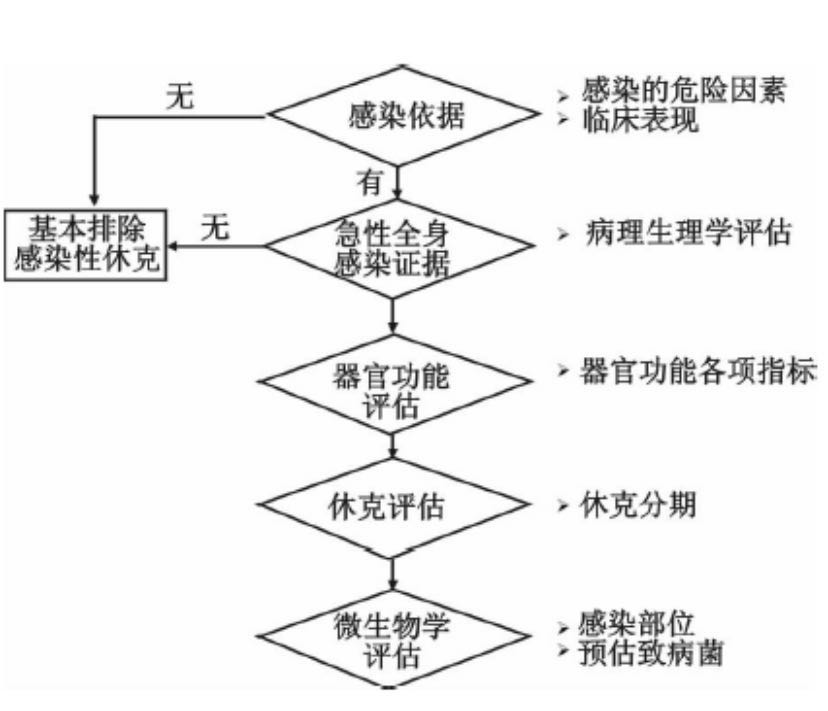
图2:感染性休克诊断流程
表2:感染性休克诊断标准

感染性休克的治疗原则 感染性休克的治疗首先应快速评估并稳定患者的生命体征,尽早经验性使用抗菌药物,同时积极确定病原菌,并基于对患者病理生理学状态的分析以及器官功能障碍的评估,改善机体的炎症状态和器官功能,防止感染性休克向MODS发展。注重个体化因素,而不能固守于程序化的标准治疗。
控制感染是感染性休克的基础治疗措施。明确感染部位,并考虑尽早采取措施控制感染源(12h内);在控制感染源的基础上,推荐在感染性休克确诊后尽早开始(1h内)静脉使用有效的抗菌药物治疗;推荐初始经验性抗感染治疗应包括可以覆盖所有可能的致病;对感染性休克患者,建议经验性联合治疗不超过3~5d。一旦病原菌的药敏确定,结合患者临床情况降级到最恰当的单药治疗。
脏器功能支持
循环系统支持:容量复苏:容量复苏的原则:感染性休克早期,患者均有血容量不足,根据血细胞比容、中心静脉压和血流动力学监测选用补液的种类,掌握输液的速度。推荐晶体为主,有利于防止胶体从血管渗漏导致肺水肿和心力衰竭的发生。低蛋白血症患者推荐白蛋白。
血管活性药物:感染性休克不同阶段的病理生理过程十分复杂,治疗关键是纠正血流动力学紊乱;治疗的主要目标是改善组织器官的血流灌流,恢复细胞的功能与代谢。迄今为止,合理应用血管活性药仍是休克基础治疗之一,其中以多巴胺和去甲肾上腺素为常用。经过充分液体复苏,血压仍不达标,为了使MAP≥65mmHg需要加用血管升压药物,首选去甲肾上腺素;只有当患者心律失常发生风险较低、且低心输出量时,才考虑使用多巴胺。去甲肾上腺素对感染性休克血流动力学影响的研究证明,去甲肾上腺素较之多巴胺在治疗感染性休克方面有更大的优势,尤其是前者在提高平均动脉压、增加外周血管阻力和改善肾功能方面表现了较强的作用,能够改善内脏的灌注和氧合,可使局部氧代谢改善,氧摄取率增加,满足了微循环对氧的需求,而后者可能有更多的不良反应,特别是心房颤动等心律失常,且死亡风险增加。
呼吸系统支持:可首先给予鼻导管给氧或面罩给氧、无创呼吸机辅助呼吸,血气分析每小时1次。如氧饱和度不稳定时,立即给予气管插管呼吸机辅助呼吸。
肾脏功能支持:充分容量复苏的前提下,患者尿量仍没有增加、内环境不稳定时,应及早给予肾功能支持。
消化系统功能支持:有出血危险因素的感染性休克患者,推荐使用H2受体阻滞剂或质子泵抑制剂预防应激性溃疡(stress ulcer,SU)。
内分泌功能调节:目标血糖上限≤10.0mol/L(180mg/dL)。推荐在有营养支持情况下控制血糖,以防止低血糖发生。
血液系统功能支持:推荐在血红蛋白<70g/L(7.0g/L)时输注红细胞;建议血小板计数<10×109L-1时预防性输注血小板;如患者有明显出血风险,建议PLT<20×109L-1时预防性输注血小板;推荐每日皮下注射低分子肝素预防静脉血栓栓塞。
神经肌肉系统功能支持:推荐对无ARDS的急性感染患者尽量避免使用NMBAs(神经肌肉阻滞剂);机械通气的急性感染患者需要注意一些抗生素如氨基糖苷类也可导致神经肌肉功能抑制。
免疫调节剂及炎性治疗
对成人感染性休克患者,如充分的液体复苏和血管活性药能恢复血流动力学稳定,不建议使用静脉注射糖皮质激素;如未达目标,在排除存在持续免疫抑制的情况下建议静脉应用糖皮质激素。应用氢化可的松时,采用持续滴注而非间断静脉推注;应用氢化可的松时应该注意与头孢哌酮类抗菌药物的配伍禁忌,以免发生双硫仑样反应。乌司他丁是体内天然的抗炎物质,通过抑制炎症介质的产生和释放,保护血管内皮,改善毛细血管通透性、组织低灌注和微循环,保护脏器功能,有效降低急性感染患者的28d病死率。可根据病情适当调整乌司他丁的剂量和使用时间。胸腺肽α1作为免疫调节剂可刺激T淋巴细胞分化、增殖、成熟,还可抑制淋巴细胞凋亡,调节细胞因子分泌,对于部分T细胞免疫功能缺陷的患者纠正感染性休克导致的免疫功能紊乱有一定临床意义。
营养支持经胃肠道途径容量复苏以及早期肠道营养支持需要在维持血流动力学稳定、有肠道功能状态下,适量给予,循序渐进。在确诊严重感染/感染性休克最初的48h内,可以耐受的情况下给予经口饮食或肠内营养(如果需要)。在第1周内避免强制给予全热量营养,建议低剂量喂养,仅在可以耐受的情况下加量。对严重感染患者,不建议使用含特殊免疫调节添加剂的营养制剂。对有营养风险的急性感染患者,接受肠内营养3~5d仍不能达到50%目标量,建议添加肠外营养支持。营养支持建议优质高蛋白。
感染性休克院内死亡危险因素,主要包括:是否有合并症、致病原因为医院获得性感染、严重程度高、组织器官功能不全评分、出现ARDS、放置肺动脉导管等。而6h乳酸清除率<50%,以及PCT>10ng/mL,被认为是预后不佳的实验室指标。预后评价方法包括有APACHEⅡ评分、MODS评分、SAPSⅡ评分、SOFA评分、MEDS评分、RAPS评分、REMS评分等。
表3:感染性休克脏器功能障碍诊断标
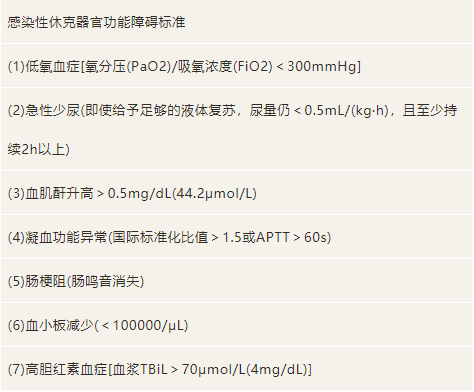
表4:感染性休克初始治疗目标时机
