中国抗癌协会
立即下载App初露锋芒——基于影像组学的无创联合模型,成功预测神经母细胞瘤患儿无事件生存
神经母细胞瘤是儿童最常见的颅外实体瘤,被称为“儿童癌症之王”,在15岁以下儿童恶性肿瘤中占比超过7%,死亡病例约占所有儿童肿瘤的15%。神经母细胞瘤具有较强侵袭性,出现转移的患儿,其生存率并不理想。对无事件生存(EFS)的预测可用于识别可能治疗失败、预后不良的患者。
若干研究已确定了几种与神经母细胞瘤总生存(OS)或EFS相关的标志物,例如染色体倍性、MYCN状态及1p染色体畸变等。然而,获取这些标志物需要有创诊断程序例如活检,因此临床亟需确定更加有用而无创的标志物以改善对神经母细胞瘤患儿预后的预测。
影像组学能够使用无创方法从医学图像中提取大量定量特征(尤其是肉眼不可见或常规影像学检查无法定量的特征),并对其进行深度挖掘和分析。其中,¹⁸F-氟脱氧葡萄糖(¹⁸F-FDG)正电子发射断层成像/计算机断层成像(PET/CT)已成为对神经母细胞瘤患者进行诊断和随访的重要工具。
基于此,首都医科大学附属北京友谊医院的杨吉刚主任团队于2023年10月在Academic Radiology期刊上发表题名为“An Optimal Radiomics Nomogram Based on ¹⁸F-FDG PET/CT for Identifying Event-Free Survival in Pediatric Neuroblastoma”的研究,展示了他们在基于¹⁸F-FDG PET/CT影像组学预测神经母细胞瘤患儿EFS方面的最新研究成果。

研究目的
一项回顾性研究纳入126例神经母细胞瘤患儿,并按照7:3的比例将其随机分为训练集(n=88)和验证集(n=38),旨在探索联合肿瘤和骨髓的影像组学特征能否更准确地预测神经母细胞瘤患儿的EFS。
研究方案
研究者纳入126例经病理学检查确认、于手术或活检前4周内接受过¹⁸F-FDG PET/CT扫描的神经母细胞瘤患儿(根据儿童肿瘤协作组[COG]的风险分层,分别有81例、45例患儿被归类为高危或非高危),按照7:3的比例将其随机分为训练集(n=88)和验证集(n=38)。常规诊断后,对所有患儿根据风险分层进行治疗。研究从¹⁸F-FDG PET/CT扫描之日起评估EFS,以确定事件(复发、进展或死亡)发生的时间或末次已知随访时间。
研究获取并使用组内相关系数(ICC)、斯皮尔曼相关系数、皮尔逊相关系数筛选影像组学特征,然后使用最小绝对收缩和选择运算符(LASSO) Cox回归分析筛选非零系数的影像组学特征,最后使用单因素Cox回归模型分析确定最佳特征。在训练集中建立影像组学模型,即影像组学风险评分(RRS)。采用最大选择秩统计量确定RRS的最佳截断值,将不同风险评分的患者分为高危组和低危组。采用Kaplan-Meier分析评价RRS对EFS风险分层的能力。
采用单因素Cox回归分析评估训练集中与EFS显著相关的临床因素,将P<0.05的因素纳入多因素Cox回归分析以确定与EFS相关的独立危险因素并构建临床模型。传统PET模型基于传统PET参数构建,包括SUVₘₐₓ、SUVₘₑₐₙ、代谢肿瘤体积及总病变糖酵解。
将这些无创临床因素与RRS进行多因素Cox回归分析,建立无创联合模型。最后,通过影像组学列线图对无创联合模型进行可视化。采用C指数、校准曲线和决策曲线分析(DCA)评价模型的性能。
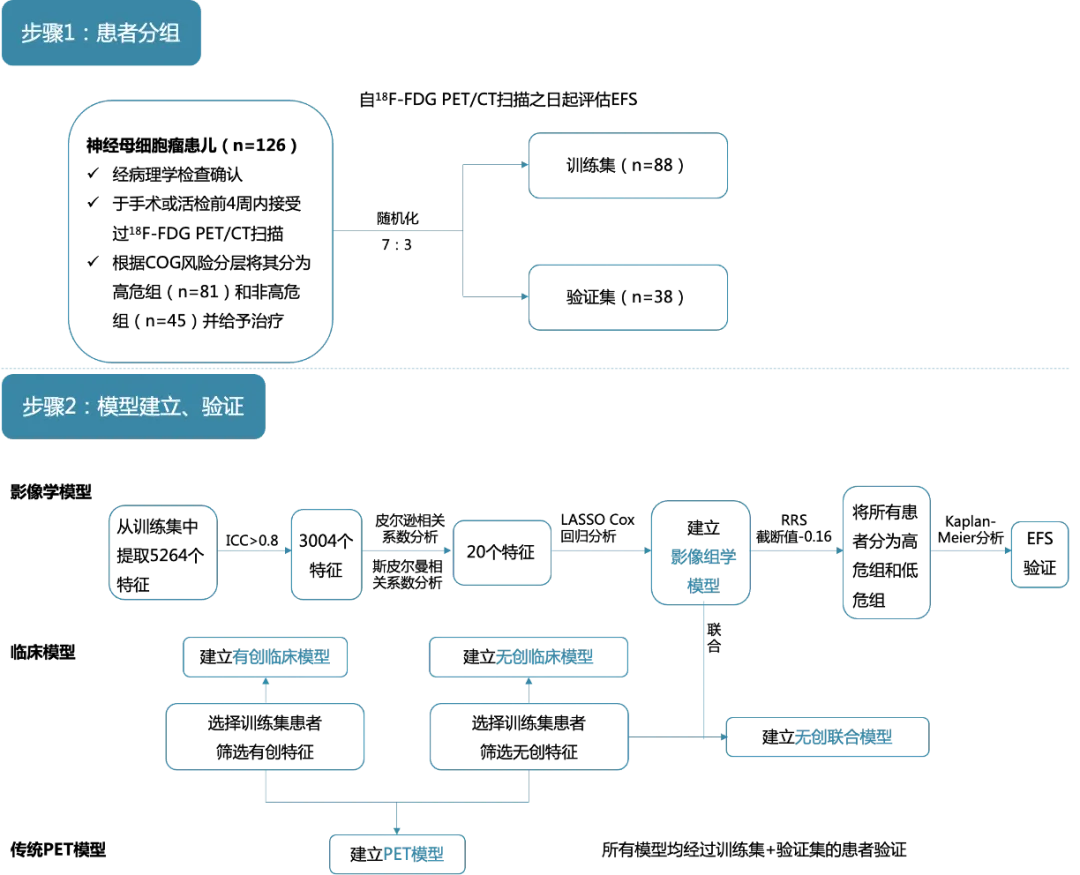
图1. 研究步骤
FDG:氟脱氧葡萄糖;PET:正电子发射断层成像;CT:计算机断层成像;ICC:组内相关系数;RRS:影像组学风险评分;EFS:无事件生存
研究结果
患者特征
在临床因素(有创和无创)和传统PET参数方面,训练集和验证集均无显著性差异。
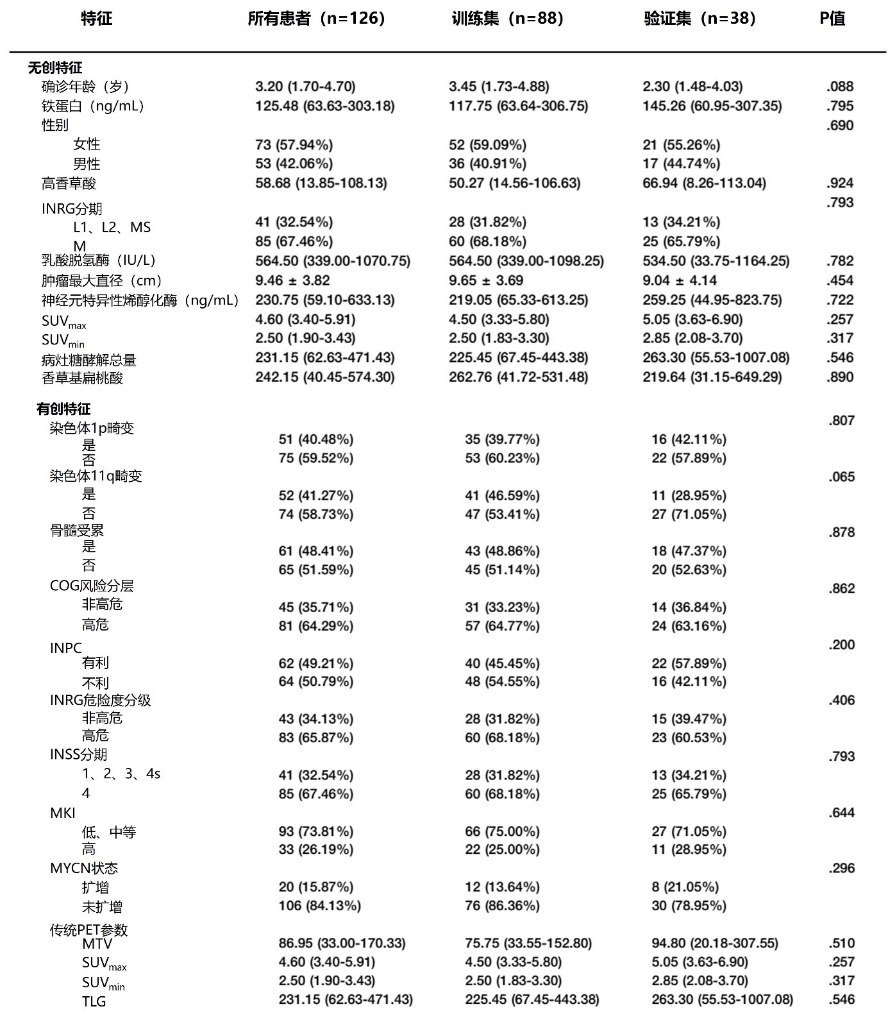
表1. 训练集和验证集中神经母细胞瘤患者的特征
特征选择和RRS生成
总共提取了5264个符合影像生物标志物标准化倡议的影像组学特征。ICC>0.8的特征3004个。进行Pearson相关和Spearman秩相关分析后,共保留了230个特征。通过LASSO Cox回归分析选择了20个非零系数的影像组学特征。最后,单因素Cox回归分析显示,训练集中有15个特征与预测EFS显著相关。基于15个特征的Cox系数生成RRS,用于构建影像组学模型。根据RRS的截断值-0.16将患者分为高危组和低危组(图2)。Kaplan-Meier曲线显示,在训练集和验证集中,高危组的EFS低于低危组(图3)。此外,影像组学模型对EFS具有良好的预测性能,在训练集和验证集中,其C指数分别为0.800(95%置信区间[CI] 0.735-0.865)和0.780(95% CI 0.673-0.887)。
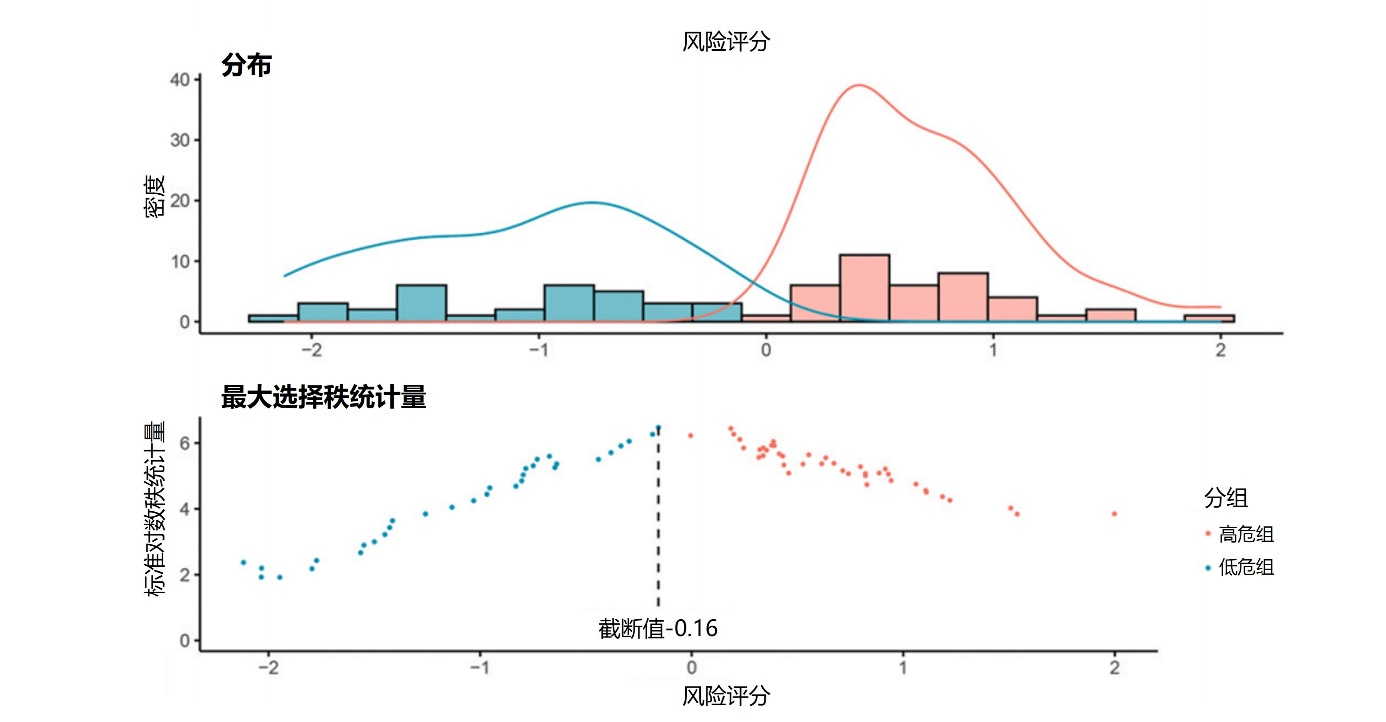
图2. 根据RRS的截断值-0.16将训练集中的患者分为高危组和低危组
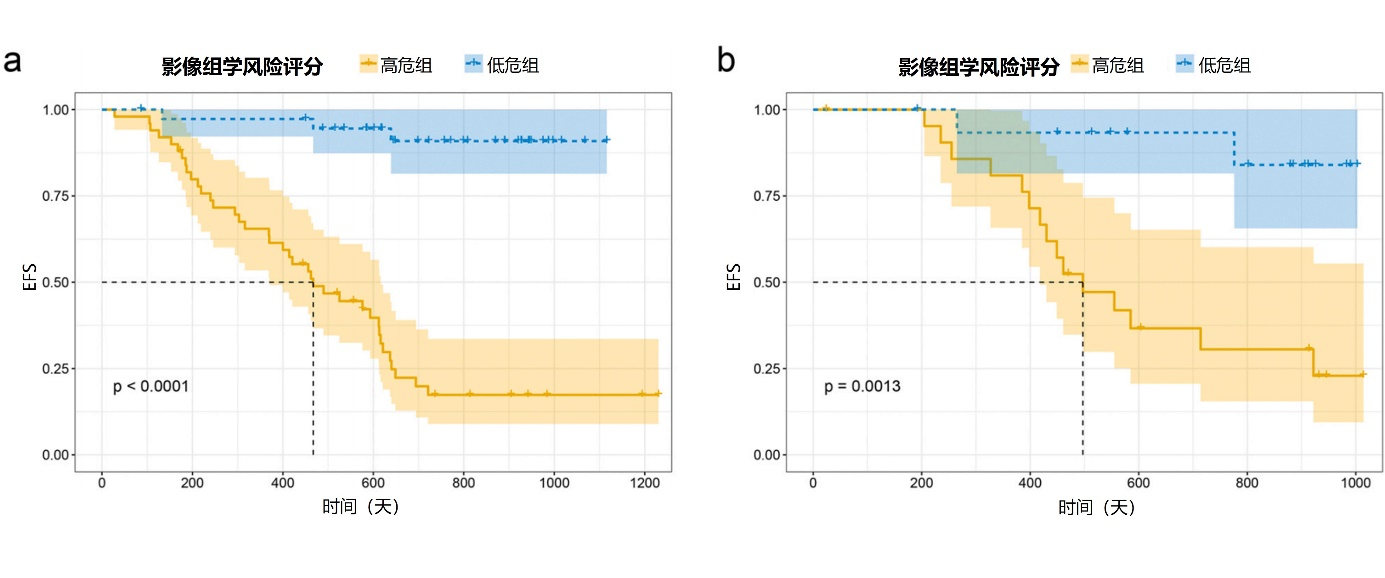
图3. 训练集(a)和验证集(b)中低危组和高
临床模型的建立和无创联合模型的生成
无创临床模型:通过单因素Cox回归分析确定,有5项无创临床特征与EFS显著相关:高香草酸(HVA)、国际神经母细胞瘤风险分组(INRG)分期、肿瘤最大直径、神经元特异性烯醇化酶(NSE)和香草基扁桃酸(VMA)。多因素Cox回归分析显示,INRG分期是EFS的独立危险因素(表2)。训练集和验证集中,由INRG分期构建的无创临床模型的C指数分别为0.672(95% CI 0.609-0.736)和0.675(95% CI 0.573-0.777)。
有创临床模型:单因素Cox回归分析显示,有5项有创临床特征与EFS显著相关:11q畸变、骨髓转移(BMI)、COG风险分层、INRG危险度分级和国际神经母细胞瘤分期系统(INSS)分期。多因素Cox回归分析显示BMI和INSS分期是EFS的独立危险因素(表2)。在训练集和验证集中,由BMI和INSS分期构建的有创临床模型的C指数分别为0.741(95% CI 0.672-0.809)和0.748(95% CI 0.640-0.856)。

表2. 训练集中EFS相关危险因素的单因素和多因素Cox回归分析
NA:不适用
传统PET模型:将所有传统PET参数进行多因素Cox回归分析从而建立传统PET模型。训练集和验证集中,传统PET模型的C指数分别为0.567(95% CI 0.470-0.664)和0.534(95% CI 0.364-0.704)。
无创联合模型:将RRS和INRG分期纳入影像组学模型生成无创联合模型(图4)。校准曲线表明训练集和验证集中,联合模型预测的EFS与实际EFS之间具有良好的一致性(图5a、b)。此外,时间相关受试者工作特征曲线也证实了基于影像组学的无创联合模型比临床模型更能改善对EFS的预测(图5c、d)。无创联合模型的EFS预测性能优于临床模型和影像组学模型(表3),它在训练集和验证集中的C指数分别为0.810(95% CI 0.744-0.876)和0.783(95% CI 0.677-0.888)。DCA显示,在预测2年EFS最合理阈值概率范围内,无创联合模型优于其他模型,这表明它更适合评估个体化生存(图6)。

图4. 无创联合模型
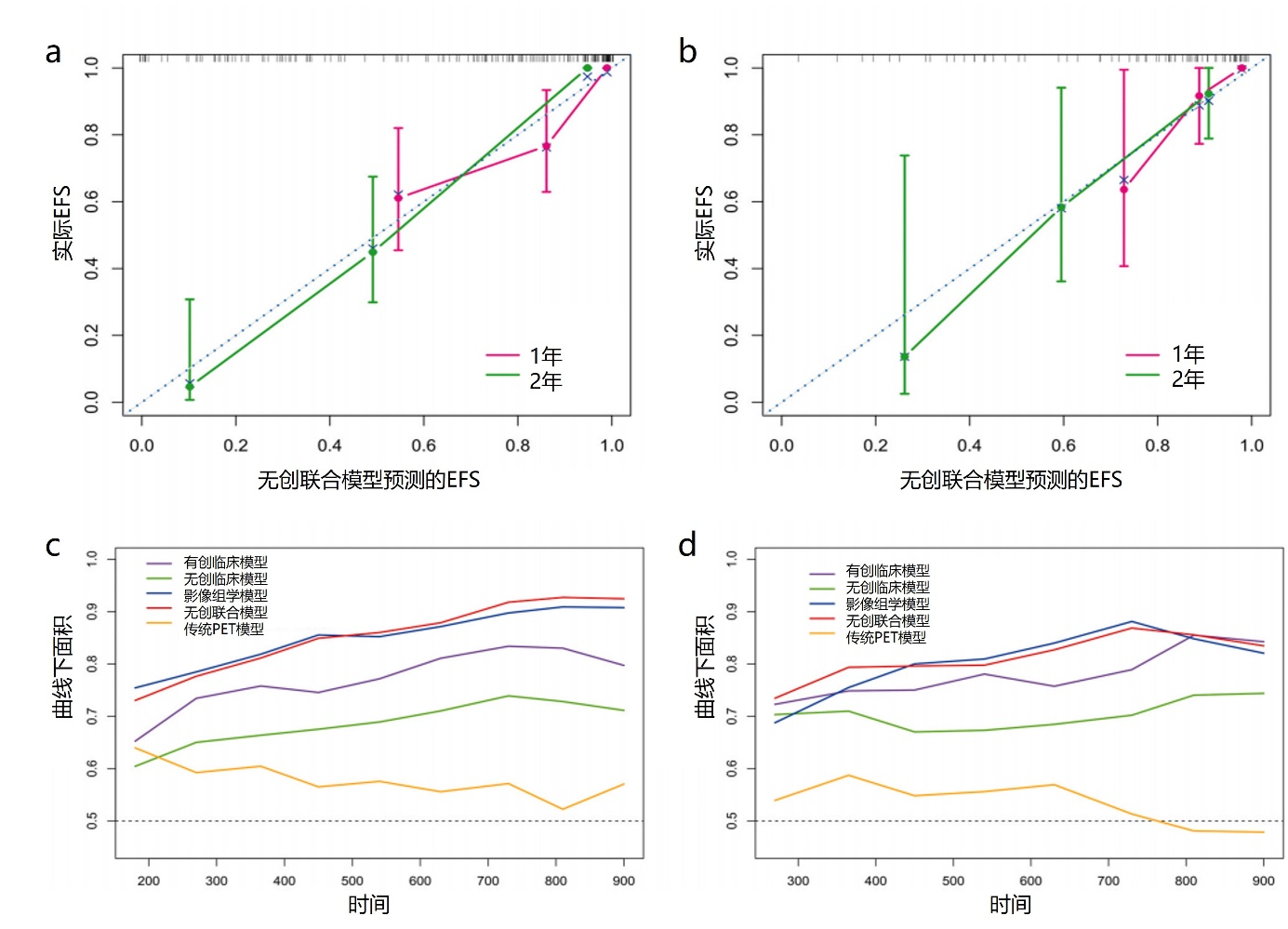
图5. (a、b)训练集和验证集中无创联合模型预测EFS的校准曲线;(c、d)训练集和验证集中各个模型的时间相关受试者工作特征曲线

表3. 训练集和验证集中不同模型预测EFS的C指数
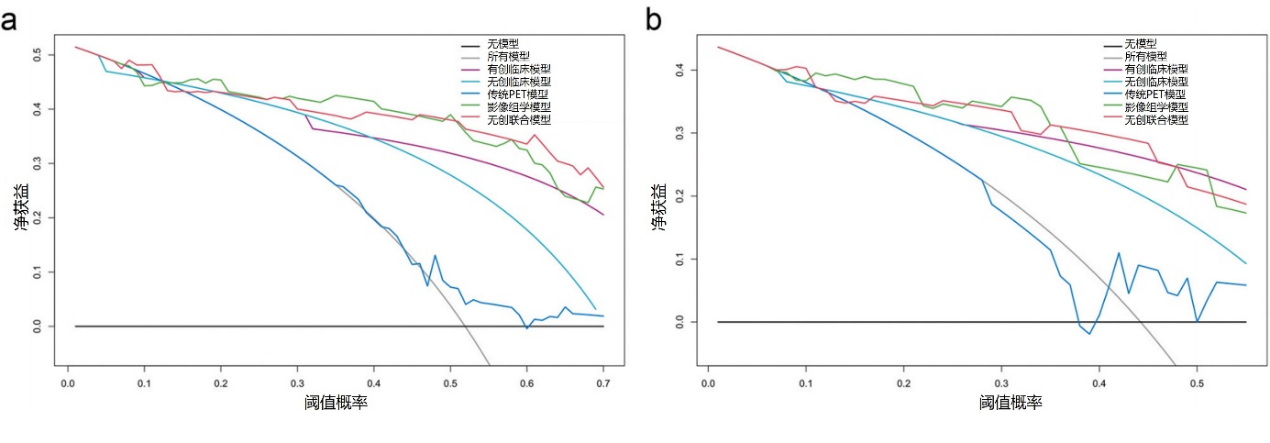
图6. 训练集(a)和验证集(b)中预测2年EFS的模型的决策曲线分析
讨论与结论
本研究开发了基于¹⁸F-FDG PET/CT影像组学的联合模型,并验证了其以无创方式预测神经母细胞瘤患儿EFS的可行性。基于影像组学的联合模型表现良好,优于其他临床模型和传统PET模型。这表明联合影像组学特征和临床因素的模型可以提高预测能力。更重要的是,研究者根据RRS,成功将患者分为了高危组和低危组。这表明RRS可为临床医生对患者进行个体化治疗提供重要参考。
本研究还对所有临床因素进行了单因素和多因素Cox回归分析。将INRG分期确定为EFS的无创独立临床危险因素,将BMI和INSS分期确定为EFS的有创独立临床危险因素。
本研究尚存在一些不足之处,例如,它是回顾性研究,难以避免选择偏倚;此外,它是单中心研究,样本量较小,这表明它的结论可能不适用于其他研究中心。未来,研究者还需纳入更多患者,进行多中心研究以验证本研究的结果。
参考文献:
1.Feng L, Zhang S, Lu X, et al. An Optimal Radiomics Nomogram Based on ¹⁸F-FDG PET/CT for Identifying Event-Free Survival in Pediatric Neuroblastoma. Acad Radiol. 2023 Oct;30(10):2309-2320.