中国抗癌协会
立即下载App【文献快刊】关注神经母细胞瘤的骨髓转移——从患者预后到肿瘤微环境的新见解
1. 上海市4期儿童神经母细胞瘤患者的骨髓复发情况

期刊:American Journal of Cancer Research
影响因子:5.3
主要内容:
骨髓是4期神经母细胞瘤患者常见的转移与复发部位,该研究纳入了2008年至2018年在中国上海两家主要儿科医院诊断为4期神经母细胞瘤的256例患者,回顾性分析了他们的流行病学和骨髓复发特征,并进一步探索了预后指标。
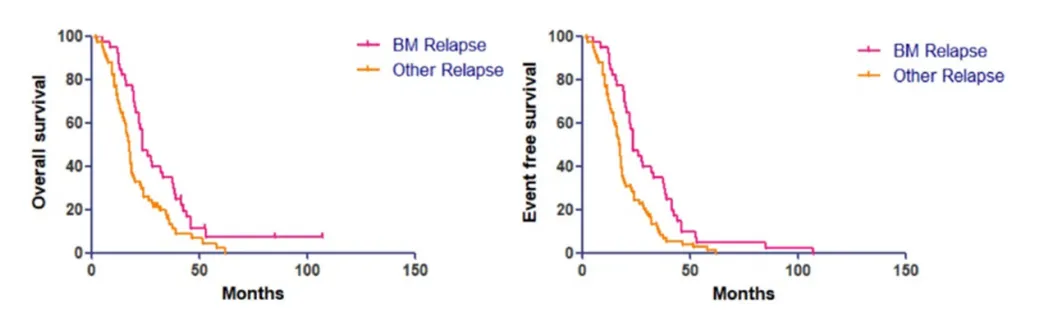
1)50.78%NB患者在治疗期间或治疗结束后出现复发
40例患者发生了骨髓复发事件,其中孤立性骨髓复发29例,合并其他部位复发11例。此外,74例患者发生其他部位复发事件。
2)在诊断时骨髓转移的NB患者随后骨髓复发的风险更高
在初诊时骨髓转移的199名患者中,有37名最终发生骨髓复发(18.6%),而在最初没有骨髓转移的37名患者中,只有3名经历了骨髓复发(5.26%),两者具有统计学差异(P=0.031)。
3)骨髓复发患者的3年总生存率(OS)和无事件生存率(EFS)分别为32.5%和32.5%
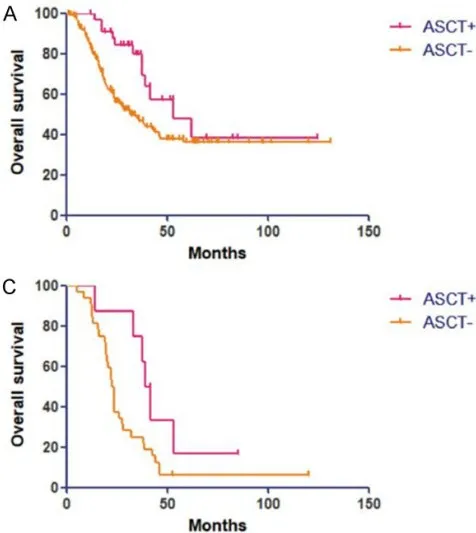
在多因素分析中,自体干细胞移植是与预后最显著相关的因素。在4期NB患者中,接受移植组的3年OS率为79.9%,而未接受移植组仅为46.8%(P=0.018)。而在骨髓复发的患者中,接受移植组的3年OS率为62.5%,而未接受移植组仅为21.88%(P=0.004)。
解读:
近两年随着免疫治疗的获批上市,有研究者开始质疑在高危神经母细胞瘤治疗中自体干细胞移植的价值,然而该项研究的研究结果再次证实了在诊断时缺乏移植会导致患者的总生存率下降,这一点在骨髓复发的患者中尤为明显。在尚未公布任何随机对照研究证实移植可去除性的当今,规范治疗仍然应是每个高危患者需恪守的准则。
此外,就骨髓复发患者的生存预后来看,虽然与2010年以前的数据相比已经实现了约10%的提升,但仍然不尽人意。个人认为,临床应加速神经母细胞瘤复发标志物的研究进程,以进一步优化患者的风险分层,这对于区分需要强化治疗的患者意义重大。
2. 单细胞分析揭示骨髓转移神经母细胞瘤的肿瘤微环境重塑和转移特征

影响因子:8.0
主要内容:
1)肿瘤相关的中性粒细胞(TAN)和巨噬细胞在神经母细胞瘤的骨髓转移中发挥了重要作用
研究发现,骨髓来源的中性粒细胞数量增加,呈现出TANs的表型,可能通过释放促血管生成因子和调节肿瘤微环境中的炎症反应来促进肿瘤转移。此外,与原发肿瘤相比,转移性骨髓中的巨噬细胞显示出与细胞周期和细胞分裂相关的上调基因。
2)细胞毒性T淋巴细胞(CTL)和调节性T细胞(Treg)有助于形成免疫抑制微环境
与源自非转移性骨髓的CTL相比,转移性骨髓中的CTL显示出衰竭相关基因的表达增加,这表明转移环境中可能会发生T细胞衰竭。此外,Tregs的增加会抑制肿瘤相关免疫反应,促进肿瘤进展和转移。
3)与非转移性骨髓神经母细胞瘤细胞相比,转移性骨髓微环境中NK细胞功能受到抑制,且B细胞比例显著降低
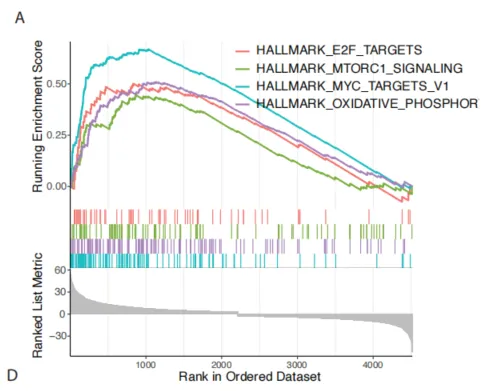
4)转移性骨髓肿瘤细胞中与E2F靶点、氧化磷酸化、mTORC1信号通路和MYC靶点相关的基因上调
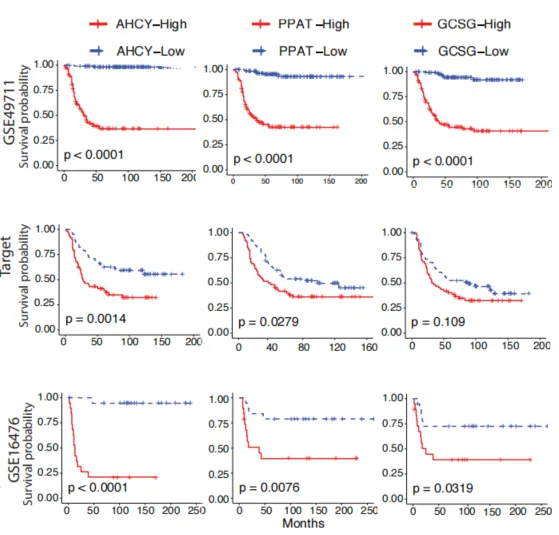
5)AHCY、PPAT和GCSH12基因的上调与较差的患者生存率显著相关
研究表明,AHCY、PPAT和GCSH12基因可以区分原发肿瘤和转移性肿瘤,这表明它们参与了转移过程,因此具有预测肿瘤转移到骨髓的可能性。
6)敲除AHCY基因可抑制神经母细胞瘤细胞的生长,说明AHCY是高危患者的潜在治疗靶点
7)转移性肿瘤细胞与转移微环境中其他细胞之间存在显著的相互作用
细胞相互作用分析显示,肿瘤细胞表达CD24,它可能通过与巨噬细胞表达的抑制性受体SIGLEC10相互作用来促进免疫逃避。
解读:
神经母细胞瘤的骨髓转移是一个复杂而有序的过程,既往研究一致认为这一过程建立在肿瘤细胞与骨髓微环境的相互作用下。这项研究不仅仅分析了骨髓转移神经母细胞瘤的肿瘤微环境特征,应证了先前的理论,其创新之处在于提出了一组具有识别转移风险的基因。如上篇文献所述,对于骨髓转移的患者,要想进一步改善预后,临床的当务之急是“尽早识别”以实现早期干预,如果这些基因特征与转移风险的关系在未来能在患者层面被证实,那么个人认为,它们有望如MYCN基因一样,成为高危患者的风险标志物。
3. MTHFD1在MYCN扩增的神经母细胞瘤中调节还原型辅酶Ⅱ(NADPH)氧化还原稳态
 期刊:Cell Death & Disease
期刊:Cell Death & Disease
影响因子:9.0
主要内容:
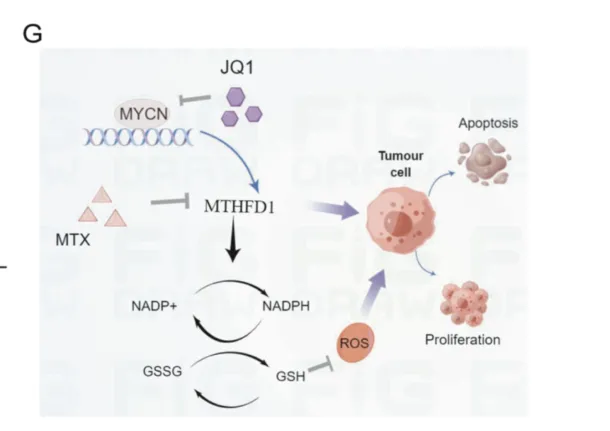
由于表面存在α-螺旋结构,药物抑制剂很难直接靶向MYCN。小分子JQ1是一种BET抑制剂,它可以破坏BET蛋白与转录因子的相关性,抑制癌基因的表达,最终抑制肿瘤细胞生长的。JQ1可下调NB中MYCN的表达,但单独治疗的效果并不理想。因此,本研究进一步探索了MYCN扩增NB的分子机制,旨在寻找潜在的治疗靶点。
1)MTHFD1在MYCN扩增的神经母细胞瘤中高表达,与不良预后相关。
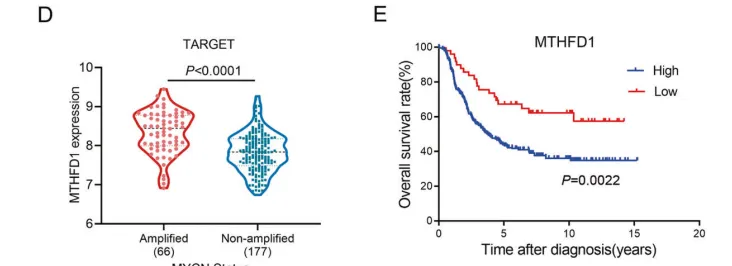
3)MTHFD1通过调节NADPH水平和减少氧化应激来维持NB细胞内的氧化还原稳态
4)敲除MTHFD1可增强JQ1在体外和体内的有效性
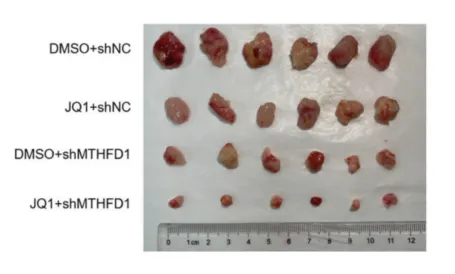
体外实验结果表明,JQ1联合甲氨蝶呤组对细胞增殖的抑制作用比单药组更明显。
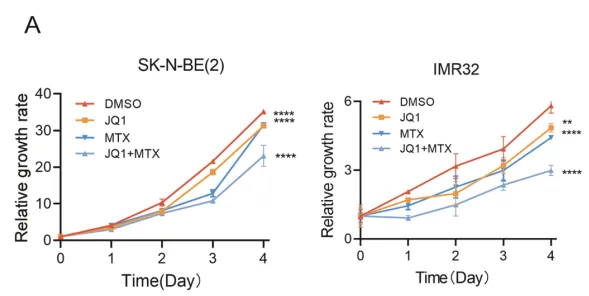
图.不同药物对NB细胞系增殖的抑制作用
MYCN基因在神经母细胞瘤中的预后价值在几十年前就已经被证实,它也是第一个被纳入风险分层的基因。靶向治疗在如今肿瘤的治疗策略中可谓是前景一片光明,但MYCN的不可成药性在很大程度上限制了其靶向药物的发展。近年来,研究者对MYCN这一靶点的兴趣不减反增,发现了诸多间接靶向MYCN的小分子药物,而JQ1正是其中具有代表性的一种。
然而,单药治疗效果不佳是NB治疗中的常见问题,究其原因是NB的发病机制涉及多种通路,该研究的创新点在于从分子机制层面入手,发现了MTHFD1在MYCN扩增神经母细胞瘤中的致瘤作用,而甲氨蝶呤可以降低MTHFD1的表达水平,于是研究顺理成章地探索了JQ1联合甲氨蝶呤的治疗潜力,也证明了该组合的有效性。甲氨蝶呤是一种广泛应用于各种血液肿瘤、风湿病、皮肤病的常见药物,且价格较低,若未来能应用于MYCN扩增的NB患者,将会是一种具有成本效益的辅助治疗药物。
参考文献
1.Li H, et al. Am J Cancer Res. 2024 Jan 15;14(1):145-154.,
2.Mei S, et al. JCI Insight. 2024 Feb 15:e173337.
3.Guan J, et al. Cell Death Dis. 2024 Feb 9;15(2):124