中国抗癌协会
立即下载App患者获益最大化——ADC血液学不良反应的管理策略
近年来,抗体药物偶联物(ADC)一直是肿瘤精准治疗领域的热门研究方向之一¹,具有高效、低毒的抗肿瘤治疗作用²。然而,在ADC的使用过程中依旧会出现各类不良反应,其中血液学不良反应较为常见,例如血小板减少和中性粒细胞减少等,为患者的预后转归带来不利影响¹。基于此,本文针对ADC的血液学不良反应发生情况以及应对措施进行总结,为临床医生提供参考,以改善患者的临床结局。
ADC血液学不良反应简介
ADC由单克隆抗体、连接子和细胞毒药物(有效载荷)3部分共价偶联组成,兼具传统化疗药物对肿瘤细胞的强大杀伤作用以及抗体药物的精准靶向性²。它通过特异性抗体选择性递送小分子细胞毒药物,定向杀死肿瘤细胞,减少小分子细胞毒药物的脱靶作用,有效提高抗肿瘤治疗的效益风险比¹,²。目前我国已有6种ADC类药物上市(恩美曲妥珠单抗T-DM1等)¹,²,在这些药物的使用过程中暴露出了若干问题,例如脱靶引起的不良反应、靶标组织富集度不足等³。血液学不良反应是需要特别关注的不良反应之一,包括全血细胞减少、血小板减少、中性粒细胞减少等¹。
一项纳入169项前瞻性临床试验、共计22492例恶性肿瘤患者的荟萃分析结果表明,恶性肿瘤患者使用ADC过程中的血液学不良反应发生率较高,且以中性粒细胞减少、血小板减少较为常见,见图1⁴。
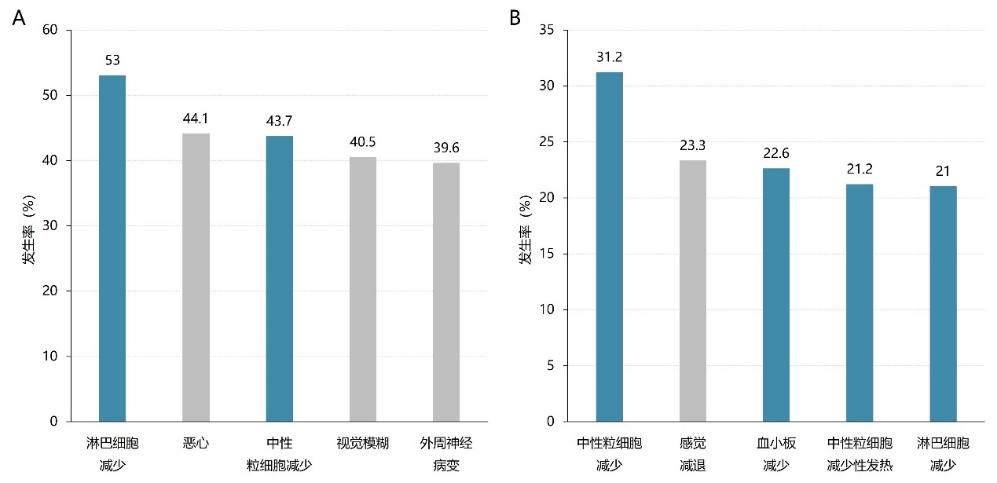
图1. 肿瘤患者接受ADC类药物治疗出现的前5位不良反应。(A)所有级别;(B)≥3级
脱靶作用是ADC类药物出现血液学不良反应的主要原因。一方面,ADC类药物中的单克隆抗体靶向的抗原常为肿瘤相关性,而非肿瘤特异性,且单克隆抗体本身可能经由Fc受体等非特异性地结合至正常细胞,因此ADC类药物可同时具有抗肿瘤活性和肿瘤外不良反应。另一方面,若连接子在血液循环中不稳定,则有效载荷可能损伤正常细胞⁵,具体机制见图2⁶。
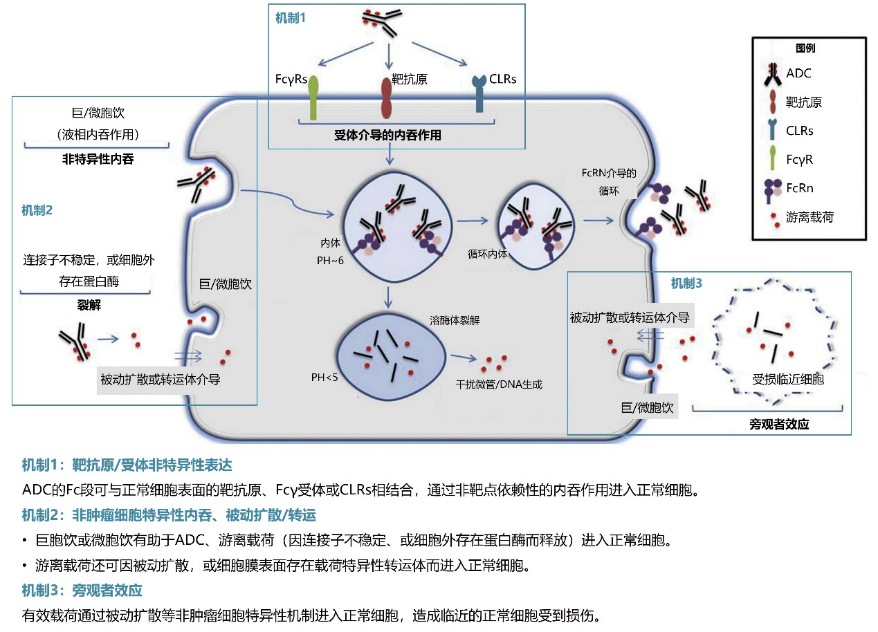
图2. ADC类药物或游离载荷损伤正常细胞的机制
ADC血液学不良反应管理
在ADC类药物的血液学不良反应管理方面,建议使用ADC药物前进行全血细胞计数检查,对于不符合治疗要求的患者应待其血液指标恢复正常(可能需给予支持治疗)后使用ADC药物。在ADC药物治疗期间定期监测患者血细胞计数,同时考虑进行二级预防。ADC类药物的血液学不良反应中,血小板减少和中性粒细胞减少较为常见¹。因此本文重点探讨这两种不良反应的管理。
血小板减少:定义为抗肿瘤治疗药物导致的外周血中血小板计数低于100×10⁹/L,分级见表1⁷:
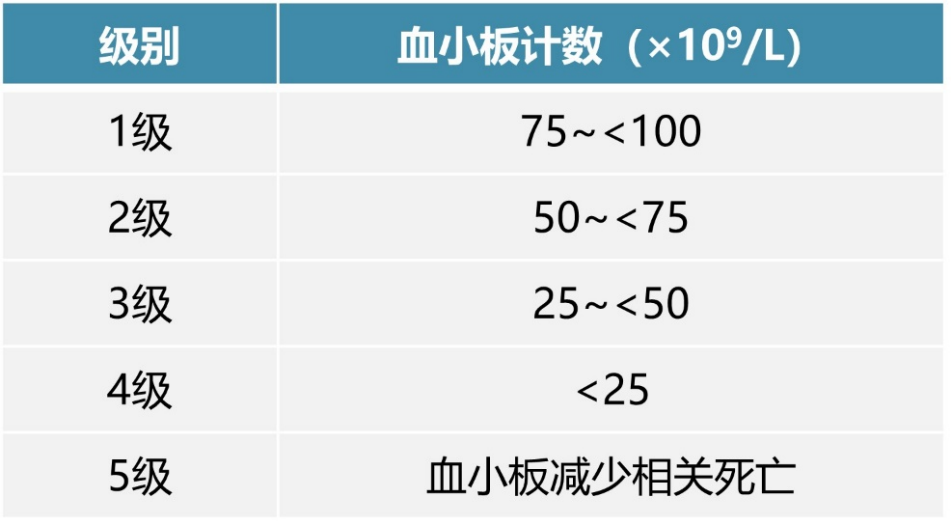
表1. 血小板减少分级标准
常见应对方式为定期监测血常规/血小板、及时调整用药剂量、促血小板生成药物治疗等。以T-DM1为例,其血常规/血小板的监测流程见图3¹: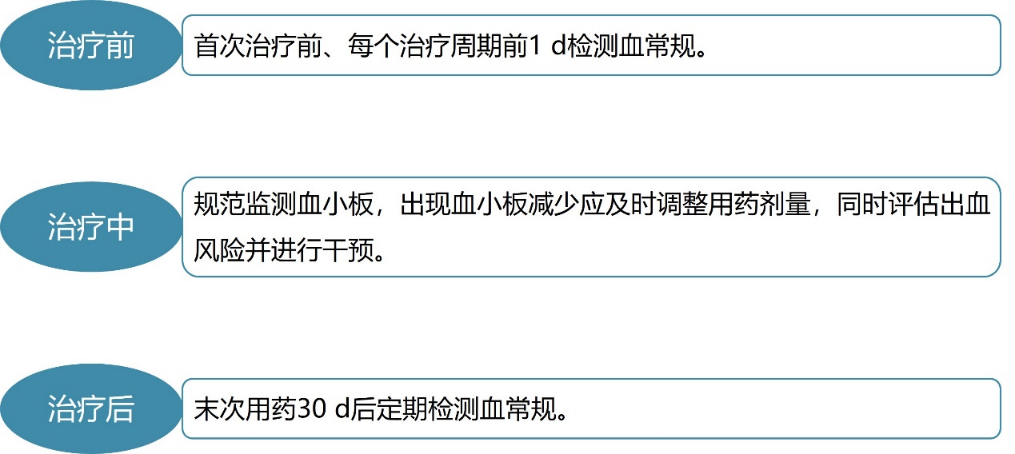
图3. T-DM1治疗前、中、后的血常规/血小板监测流程
药物剂量调整建议见表2¹:

表2. T-DM1治疗过程中出现血小板减少的剂量调整建议
《抗体药物偶联物治疗恶性肿瘤临床应用中国专家共识(2023版)》指出,可对≥3级以上血小板减少的患者使用促血小板生成药物¹,包括重组人血小板生成素(rhTPO)、重组人白介素-11(rhIL-11)、血小板生成素受体激动剂(TPO-RA),使用方法见表3⁷:

表3. 促血小板生成药物用于血小板减少的预防和治疗的患者群体、使用方法
目前,我国临床应用的TPO-RA包括小分子非肽类艾曲泊帕、阿伐曲泊帕、海曲泊帕及肽类药物罗普司亭等⁸。罗普司亭治疗时存在PLT波动较大的风险,艾曲泊帕、海曲泊帕存在有潜在肝毒性的结构,阿伐曲泊帕无肝毒性,无免疫原性,且没有饮食限制、口服更便利,对于抗肿瘤治疗患者而言更安全、更方便⁸,⁹。中性粒细胞减少:定义为外周血中性粒细胞绝对计数(ANC)低于2.0×10⁹/L,分级见表4¹⁰:

表4. 中性粒细胞减少分级标准
对于中性粒细胞减少,常见应对方式为定期监测血常规、及时调整用药剂量、使用粒细胞集落刺激因子(G-CSF)治疗等。以戈沙妥珠单抗(SG)为例,其剂量调整建议见图4¹:
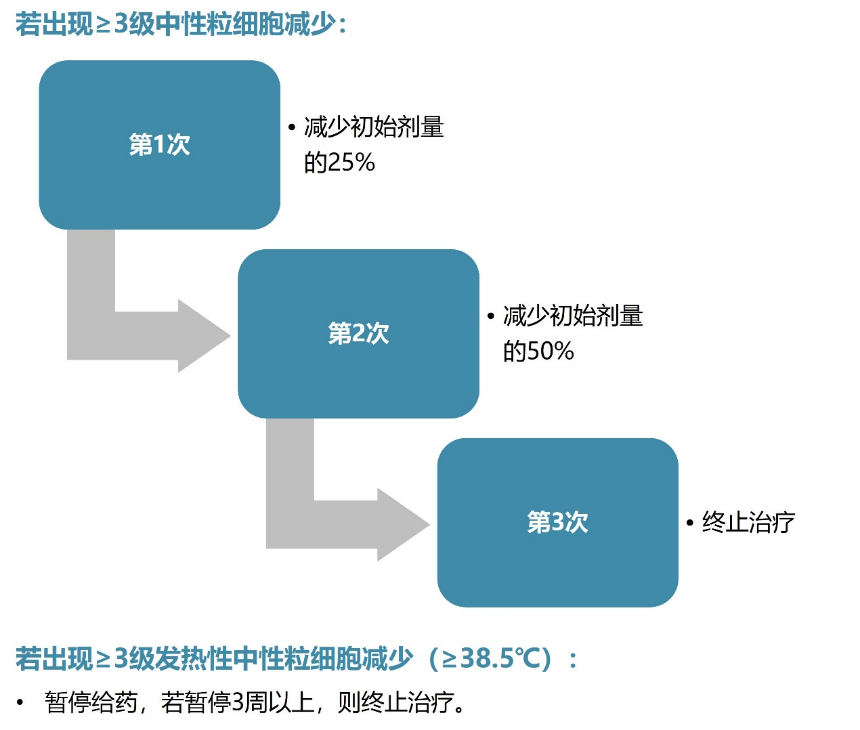
图4. 戈沙妥珠单抗治疗过程中出现中性粒细胞减少的剂量调整建议
ADC类药物治疗开始前,可对发热性中性粒细胞减少(FN)高危(治疗后FN发生率>20%)或中危(治疗后FN发生率10% ~20%)风险、合并其他危险因素的患者给予G-CSF进行预防;或在ADC类药物治疗开始后,对确诊FN的患者给予G-CSF进行治疗,方法见表5¹。
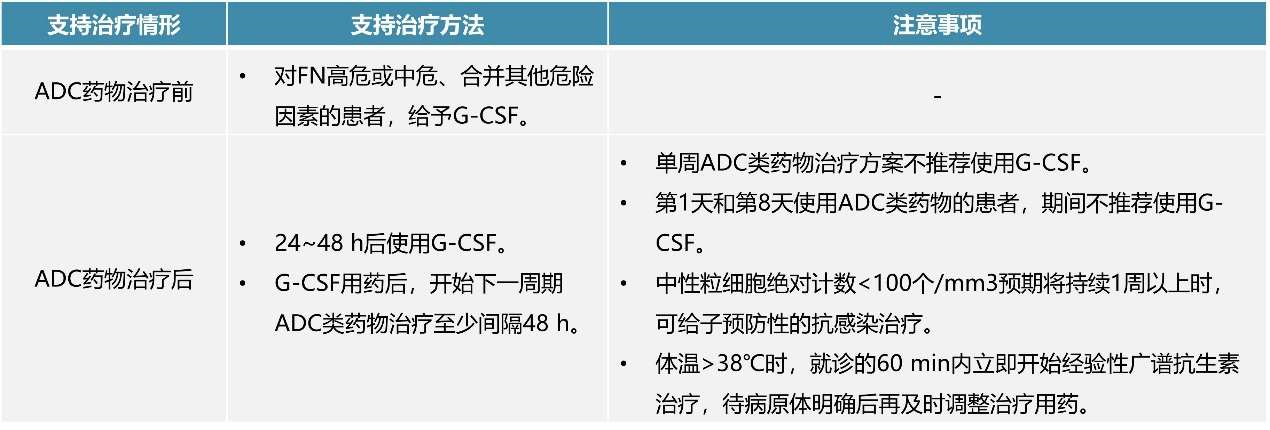
表5. G-CSF支持治疗用于中性粒细胞减少的使用方法、注意事项
目前临床应用的PEG-rhG-CSF包括传统直链PEG-rhG-CSF注射液及Y型支链PEG修饰的拓培非格司亭等,其中拓培非格司亭采用40 KD,药物分子量更大、体内生物学活性更强、剂量更低¹¹,升白作用更强¹²,骨髓过度刺激风险更小,对于患者更安全¹³⁻¹⁵。总结
ADC相关血液学不良反应,例如血小板减少、中性粒细胞减少的发生率较高,患者易出现相关并发症例如出血、感染,影响抗肿瘤治疗的进行。对此,在使用ADC治疗前、治疗期间甚至治疗后,临床医生应对患者进行密切的血细胞计数监测,据此及时调整ADC的使用剂量甚至暂时停用ADC,必要时可分别对血小板减少≥3级、伴FN风险或确诊FN的患者进行TPO-RA、G-CSF的对症治疗,以减少ADC类药物的血液学不良反应或缓解其严重程度,助力肿瘤治疗顺利进行,使患者的获益最大化。
参考文献:
1.中国抗癌协会肿瘤药物临床研究专业委员会,国家抗肿瘤药物临床应用监测专家委员会,国家肿瘤质控中心乳腺癌专家委员会,等. 抗体药物偶联物治疗恶性肿瘤临床应用中国专家共识(2023版)[J]. 中华肿瘤杂志,2023,45(9):741-762.2.中国药学会医院药学专业委员会,中国抗癌协会肿瘤临床化疗专业委员会. 抗体偶联药物安全性跨学科管理中国专家共识[J]. 中国医院药学杂志,2023,43(1):1-10,60.
3.刘文超,李鸿峰,胡朝红. 抗体偶联药物的技术现状和展望[J]. 生物化学与生物物理进展,2023,50(5):1167-1189.
4.Zhu Y, Liu K, Wang K, et al. Treatment-related adverse events of antibody-drug conjugates in clinical trials: A systematic review and meta-analysis. Cancer. 2023 Jan 15;129(2):283-295.
5.中国医师协会肿瘤医师分会乳腺癌学组, 中国抗癌协会国际医疗交流分会. 中国乳腺癌抗体药物偶联物安全性管理专家共识 [J] . 中华肿瘤杂志, 2022, 44(9) : 913-927.
6.Mahalingaiah PK, Ciurlionis R, Durbin KR, et al. Potential mechanisms of target-independent uptake and toxicity of antibody-drug conjugates. Pharmacol Ther. 2019 Aug;200:110-125.
7.中国抗癌协会肿瘤临床化疗专业委员会,中国抗癌协会肿瘤支持治疗专业委员会. 中国肿瘤药物相关血小板减少诊疗专家共识(2023版)[J]. 中华医学杂志,2023,103(33):2579-2590.
8.Al-Samkari H. Thrombopoietin receptor agonists for chemotherapy-induced thrombocytopenia: a new solution for an old problem. Hematology Am Soc Hematol Educ Program. 2022 Dec 9;2022(1):286-295.
9.刘海龙,王江,林岱宗,等.先导化合物结构优化策略(二)——结构修饰降低潜在毒性[J].药学学报,2014,49(1):1-15.
10.中国抗癌协会肿瘤临床化疗专业委员会,中国抗癌协会肿瘤支持治疗专业委员会. 肿瘤化疗导致的中性粒细胞减少诊治中国专家共识(2023版)[J]. 中华肿瘤杂志,2023,45(7):575-583.
11.拓培非格司亭说明书.
12.Bailon P, Won CY. PEG-modified biopharmaceuticals. Expert Opin Drug Deliv. 2009 Jan;6(1):1-16.
13.中国临床肿瘤学会指南工作委员会. 中国临床肿瘤学会(CSCO)肿瘤放化疗相关中性粒细胞减少症规范化管理指南(2021)[J]. 临床肿瘤学杂志,2021,26(7):638-648.
14.拓培非格司亭二期研究报告.
15.Lambertini M, Del Mastro L, Bellodi A, et al. The five "Ws" for bone pain due to the administration of granulocyte-colony stimulating factors (G-CSFs). Crit Rev Oncol Hematol. 2014 Jan;89(1):112-28.
编辑转载:歆语健康