中国抗癌协会
立即下载App肿瘤VS心衰
心血管疾病与肿瘤是对生命威胁最大的2类疾病,它们有许多共同的危险因素与病理机制,并且心血管疾病的部分危险因素可以用来预测肿瘤的风险。近些年来,越来越多的证据表明,心血管疾病尤其是心力衰竭与肿瘤有着共同的危险因素与发病机制,且相互影响(图1)。
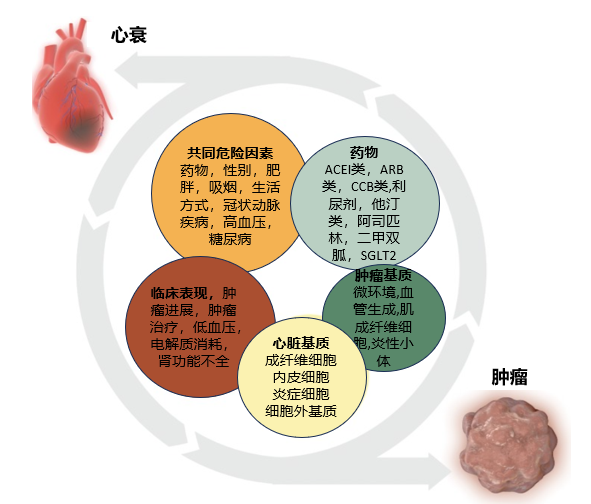
图1.肿瘤和心衰的关系
1、肿瘤患者心力衰竭发生的风险及防治策略1.1发病机制
近年来,随着肿瘤早期诊断方法、靶向疗法的进步以及免疫检查点抑制剂的使用,肿瘤患者存活率明显得到改善;然而,越来越多研究显示肿瘤患者心力衰竭发生率非常高,导致肿瘤患者预后不良。肿瘤患者心力衰竭发生率升高,一方面归因于肿瘤治疗过程中的心脏毒性反应(表1);另一方面,肿瘤自身通过系统性改变驱动心脏恶病质,导致心力衰竭的发生(表2)。
表1.抗肿瘤类药物诱导心衰的机制
|
肿瘤类型 |
抗肿瘤药物类型 |
诱导心衰发病机制 |
|
乳腺癌,淋巴瘤,急性白血病,肉瘤 |
蒽环类药物 |
(1)拓扑异构酶2β:介导DNA断裂,导致线粒体功能障碍和活性氧(ROS)的产生;(2)氧化应激:通过活性氧直接损伤心肌细胞;(3)线粒体功能障碍:线粒体生物能量学、线粒体DNA复制、线粒体氧化/硝化应激、细胞死亡、线粒体动力学失调;(4)系统性炎症;(5)铁代谢:铁过载、铁死亡;(6)心肌萎缩、程序性细胞死亡、细胞凋亡、焦亡、铁死亡、坏死性凋亡;(7)内皮功能障碍;(8)自噬和线粒体自噬 |
|
HER2+乳腺癌 HER2+胃癌 |
HER2抑制剂 |
抑制HER2信号转导,抑制下游PI3K/AKT、mTOR和Ras/RAF/MEK/ERK信号转导,抑制心肌细胞生长和存活、代谢改变、血管生成减少、收缩功能受损、钙处理改变、自噬减少和线粒体功能障碍 |
|
肾癌、肝细胞癌、 甲状腺癌、结肠癌、肉瘤、胃肠道 |
VEGF/VEGFR抑制剂/酪氨酸酶抑制剂(TKIs) |
缺氧诱导因子(HIF)通路诱导线粒体功能障碍 |
|
多发性骨髓瘤 |
蛋白酶体抑制剂 |
蛋白酶体抑制剂抑制26S蛋白酶体的β-亚基催化活性,降低其分解和回收错误折叠蛋白质的能力,导致错误折叠蛋白质和细胞蛋白毒性的积累,导致蛋白质稳态异常、内皮功能障碍、血管舒缩张力异常、心肌细胞凋亡、收缩功能障碍 |
|
黑色素瘤(转移性和辅助性)、转移性肾癌、非小细胞肺癌、小细胞肺癌、难治性霍奇金淋巴瘤,转移性三阴性乳腺癌、转移性尿路上皮癌、肝癌、MMR缺陷型癌 |
免疫检查点抑制剂
|
(1) T细胞多克隆扩增和潜在的抗原特异性细胞免疫反应:T细胞系统性过度增殖、浸润心脏,造成心肌细胞损伤;自反应T细胞克隆和浸润直接导致组织损伤;(2)自身抗体产生:针对cTnI的自身抗体的产生可能通过长期刺激心肌细胞中Ca2+的流入而引起心肌病;(3)相关因子表达增加:趋化因子轴分子如CXCR3-CXCL9/CXCL1和CCR5/CCL5表达增加,可能促进T细胞的全身增殖和趋化性;细胞功能介质的表达,增加CD8+ T细胞的活性;(4)相关基因表达上调:参与抗原传递途径的基因上调可能发挥作用;(5)通过特殊信号通路:通过NLRP3/IL-1β和MyD88通路诱导细胞毒性 |
表2.肿瘤自身诱导心衰的发病机制
|
因素 |
机制 |
|
心脏淀粉样变性 |
免疫球蛋白轻链过度产生 |
|
类癌心脏病 |
血管活性介质 |
|
代谢产物 |
异柠檬酸脱氢酶突变导致致癌代谢物d-2-羟基戊二酸(D2-HG)增加,造成心脏收缩功能障碍 |
|
肿瘤恶病质 |
促炎细胞因子、自噬、活性氧、泛素化;心脏萎缩 |
|
氧化应激 |
Hippo-Yorkie (Yki)途径 |
在临床治疗过程中,我们要重视肿瘤患者心力衰竭的早期识别,并尽快追溯其诱发因素,及时阻断可控的相关诱导因素;当肿瘤患者出现心力衰竭时,我们也要对这部分患者进行科学管理,制定个体化的心血管监测,进行精准治疗。2022 ESC肿瘤心脏病指南对于抗肿瘤治疗引起的心功能不全给出了其管理流程,以蒽环类药物相关心功能不全(图2)和抗HER-2治疗相关心功能不全患者的管理为例(图3)。
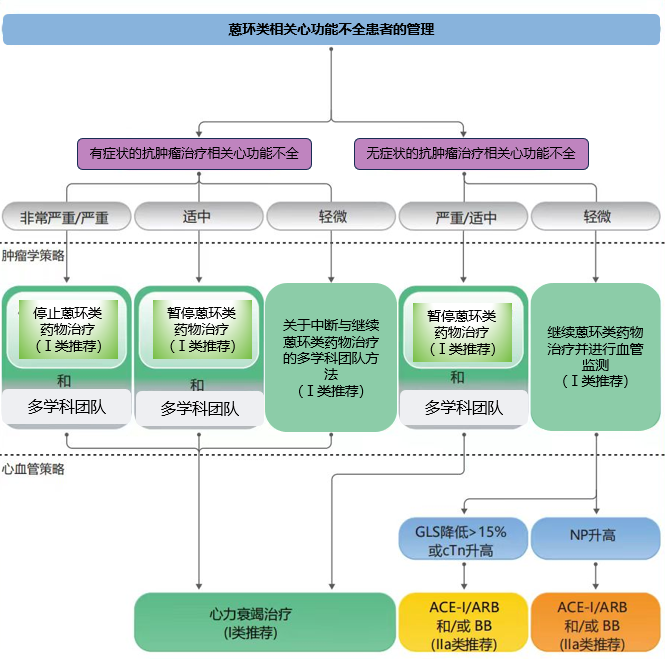
图2.蒽环类相关心功能不全患者的管理

图3.HER-2靶向治疗相关心功能不全患者的管理
|
因素 |
机制 |
|
系统性因素 |
共同危险因素、神经内分泌激活、低度慢性炎症、氧化应激、免疫反应激活 |
|
循环因子 |
心脏分泌蛋白、肿瘤坏死因子-α、白细胞介素-6 (IL-6)、IL-1和血管内皮生长因子 |
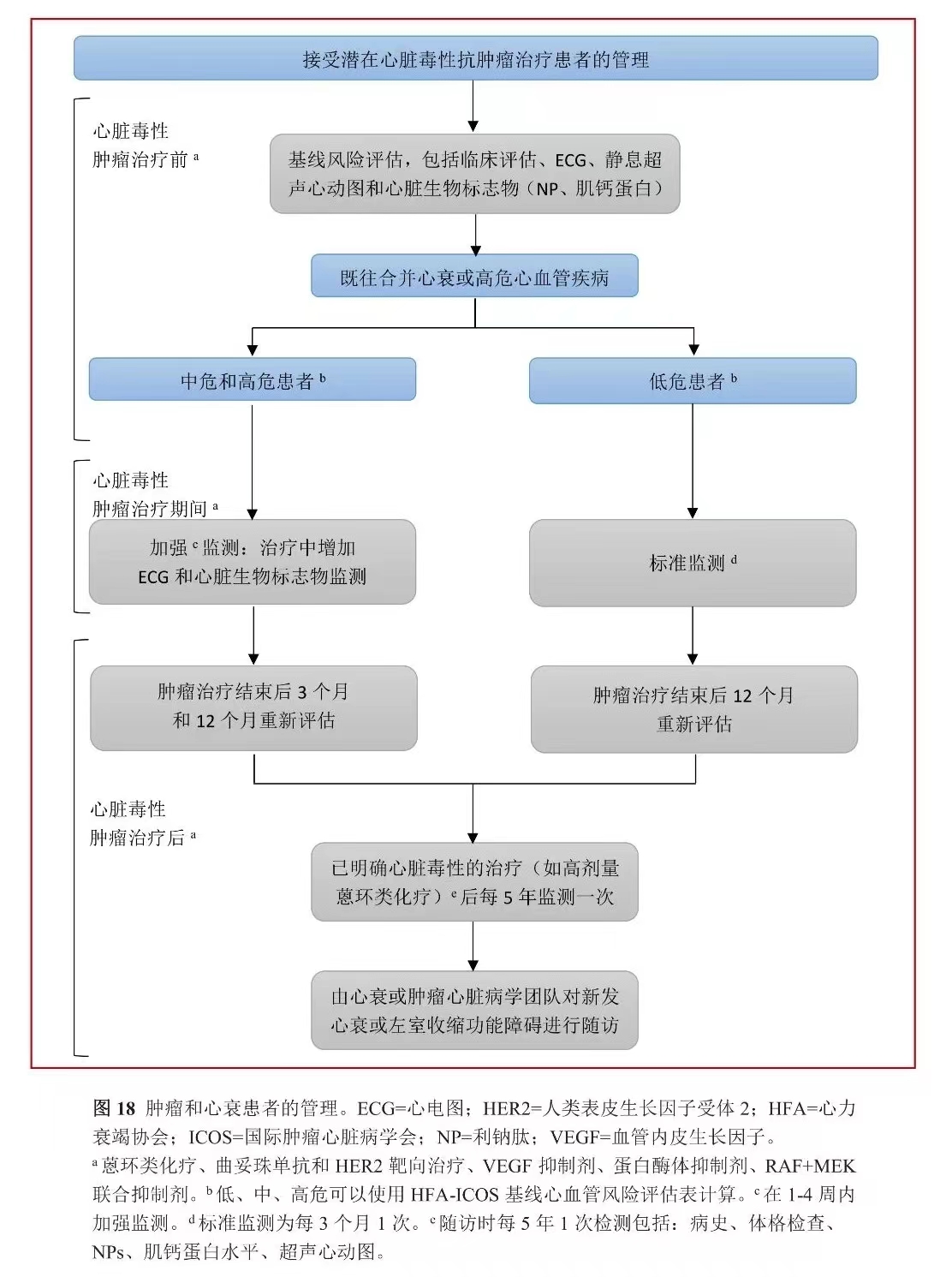 图4.肿瘤和心衰患者的管理
图4.肿瘤和心衰患者的管理
注:a蒽环类化疗,曲妥珠单抗和 HER2 靶向治疗,VEGF 抑制剂,蛋白酶体抑制剂,联合 RAF+MEK 抑制剂。b低、中、高风险可使用 HFA-ICOS 基线心血管风险形式计算。c增加监测计划在 1 至 4 周之间。d计划每 3 个月进行一次标准监测。e后每5 年监测一次:临床回顾的年度监测,包括病史、检查、NPs 和肌钙蛋白水平和超声心动图。
在使用潜在心脏毒性疗法进行肿瘤治疗期间,可以通过超声心动图监测LV 收缩功能。对于出现左室收缩功能障碍(LVEF 绝对值降低 10%或更多至 50%以下)的患者,应重新考虑化疗,并应开始使用ACE-I 和β受体阻滞剂(最好是卡维地洛)治疗。2021ESC急慢性心力衰竭诊断和治疗指南中心衰合并肿瘤管理部分提到了这部分患者的管理推荐(表4)
肿瘤与心力衰竭密切相关,二者在发病过程中不仅具有相同的危险因素,而且具有类似的内环境,二者共同促进肿瘤与心力衰竭的发生与进展。当二者共存时,治疗难度更大,死亡风险更高,预后也更差。因此,临床上应当重视心力衰竭患者中高危易患肿瘤者的筛查,重视肿瘤患者心力衰竭的早期识别,并研究如何降低两种疾病相互诱发的风险。重视这部分患者的管理,平衡好患者的治疗方案,避免加重患者病情。
哈尔滨医科大学附属第二医院心内科 别必柯 张瑶