中国抗癌协会
立即下载App《中国恶性肿瘤学科发展报告(2022)》——腹膜肿瘤研究进展篇

概述
由于腹膜肿瘤尤其是继发腹膜肿瘤患者数量多、治疗难度大、效果不明显,腹膜肿瘤的诊断、治疗持续受到临床医学界关注。腹膜肿瘤诊疗和技术的CACA指南,持续在国内推广。C-HIPEC的规范操作培训也在持续推进。
免疫微环境在腹膜癌的发生发展过程中起着关键作用,腹膜腔免疫微环境的评估与调节也是腹膜癌研究和临床领域的热点之一。在腹膜腔免疫微环境评估方面,最突出的进展就是以单细胞测序、质谱流式、质谱成像、生物芯片等为代表的高通量、多组学检测技术在腹膜腔免疫微环境评估中的应用。
既往认为胆胰肿瘤一旦腹膜转移则治疗手段有限,预后不容乐观。但随着治疗理念的更新和以肿瘤细胞减灭术(CRS)+腹腔热灌注化疗(HIPEC)为核心的治疗策略的建立,患者的预后和生活质量已经得到了极大的改善,甚至有部分患者可能获得临床治愈。纳米药物、PIPAC技术、近红外荧光引导手术等更多新的方法依然在探索中。
人工智能可以辅助腹膜肿瘤的早期筛查和诊断,通过分析大量的医学影像数据,如CT扫描、MRI和超声等,人工智能可以快速准确地检测和定位腹膜肿瘤,帮助医生在早期阶段发现病变,并及时制定治疗方案。

1.原发性腹膜肿瘤研究进展
原发性腹膜癌(primary peritoneal carcinoma, PPC)是一种起源于腹膜间质,呈多灶性的恶性肿瘤[1]。根据组织学对原发性腹膜癌可分为如下几类:卵巢外原发性腹膜癌(EOPPC)、恶性腹膜间皮瘤、播散性腹膜平滑肌瘤病,临床上往往会与继发性腹膜癌、卵巢恶性肿瘤伴转移相混淆[2]。
腹膜癌的临床表现因受累程度而异。所有患有腹膜癌的患者都表现出非特异性症状,如腹胀、恶心、消化不良、厌食、体重减轻、疲劳、便秘、腹痛或背痛。最常见的症状是腹胀和疼痛,而常见体征是可触及的腹部肿块和腹水。非特异性腹部症状和腹水见于85%的患者[3]。肿瘤相关性淋巴结肿大引起局部占位效应,甚至可能导致上腔静脉阻塞。这主要见于腹膜恶性间皮瘤。
原发性腹膜癌的治疗方法是采用多模式治疗,手术、化疗和靶向治疗相结合是主要的治疗方法。EOPPC的治疗方式与浆液性卵巢癌相同。在所有病例中均进行子宫切除术与双侧输卵管卵巢切除术和网膜切除术。一项III期临床试验表明,腹腔内化疗在总生存期方面优于静脉化疗[4]。此外,广泛切除具有<2 cm残余结节的肿瘤的减瘤手术被称为细胞减灭手术(CRS),与化疗联合治疗能在33%至69%的患者中产生最佳效果[1]。相比之下,挽救性化疗用于肿瘤复发,同时联用阿霉素、甲氨蝶呤、紫杉醇和5-氟尿嘧啶。
2.腹膜肿瘤免疫微环境的研究进展
在腹膜腔免疫微环境评估方面,最突出的进展就是以单细胞测序、质谱流式、质谱成像、生物芯片等为代表的高通量、多组学检测技术在腹膜腔免疫微环境评估中的应用。英国斯旺西大学医学院与美国德州A&M健康科学中心团队通过质谱流式细胞技术检测了卵巢癌腹膜转移小鼠腹水中的免疫细胞浸润情况,发现CD4+、CD8+、记忆T细胞等在腹水浸润免疫细胞亚群中占据优势分布[5]。中国医科大学第一附属医院肿瘤与普通外科团队应用单细胞测序技术对胃癌腹膜转移患者腹水单细胞转录组学特征进行研究后发现,胃癌腹膜转移患者腹水中树突状状细胞增加,这些DC抗原提呈能力减弱,同时具有抗血管生成作用[6]。日本自治医科大学团队通过多色流式技术检测胃癌患者腹腔灌洗液,发现CD19(+)B细胞的比例在腹膜转移患者中显着增加,CD14(+)巨噬细胞随着 CD14、CD16 和 M2 巨噬细胞标记物 CD163 表达的增强而增加,腹腔淋巴细胞与巨噬细胞表型的上述剧烈变化可能参与腹膜转移的发生和进展[7]。
在腹膜腔免疫微环境调节方面,以靶向腹膜腔免疫微环境的新的治疗策略也不断涌现。受到天然凋亡小体和囊泡功能的启发,温州医科大学第一附属医院团队构建了工程化细胞凋亡仿生纳米颗粒(EBN)以用于肝癌腹膜转移的治疗[8]。四川大学华西医院团队通过腹腔注射靶向PD-L1的嵌合体开关受体(PD-L1.BB CSR)修饰的CAR-T细胞治疗恶性腹水,使腹腔T细胞活化、增殖、细胞毒性相关基因表达上调,该疗法已进入一期临床实验[9]。
3.胃肠肿瘤腹膜转移研究进展
我国最新统计数据表明,我国结直肠癌(CRC)发病率已跃居恶性肿瘤第二位,死亡率居第四位,并且2000-2016年以来,结直肠癌的发病率和死亡率呈现上升趋势[10]。
腹膜为胃癌最常见的远处转移部位,约30%的病例发生腹膜转移(PM),晚期胃癌患者中约60%对全身化疗表现出耐药性,最终死于腹膜转移[11]。鉴于这些不良结果及与腹膜转移相关的并发症(如肠梗阻和恶性腹水),探讨新的治疗方法以解决腹腔疾病显得尤为重要。
HIPEC已经成为腹膜癌的标准治疗,主要通过热疗、化疗以及物理性冲刷三个方面的共同作用起到清除肿瘤细胞的作用。但三者之间的调控机制仍需要进一步研究, HIPEC 的应用逐渐精细化和规范化,国内学者研发了高精度、大容量、恒温灌注、持续循环等优点的中国腹腔热灌注化疗(China hyperthermic intraperitoneal chemotherapy,C-HIPEC)技术,同时提出了肿瘤治疗C-HIPEC模式,包括预防模式、治疗模式和转化模式:经过HIPEC 联合全身治疗后,肿瘤病灶减少和缩小,争取转化为CRS+HIPEC。
荷兰的一项研究提出了新型PDGFRβ-T靶向纳米抗体检测结直肠癌腹膜转移结直肠癌可以转移到多个远处部位。因此,腹膜转移通常诊断比较困难,并且难以评估其对治疗的反应。对结直肠腹膜转移的大量的分子和细胞分析表明,这些病变表达非常高水平的特异性标志物,可以作为基于成像的诊断和治疗的目标,因此探索了一种这样的标记物PDGFRβ作为通过分子成像检测腹膜转移的靶标的潜在价值[12]。
总之,在胃肠肿瘤的腹膜转移治疗中,CRS+HIPEC、全身化疗、腹腔化疗、靶向治疗、免疫治疗和放疗均有各自的优势和局限。选择合适的治疗方案需要综合考虑患者的临床特点、病理分型、基因特征和生活质量等因素。多学科团队(MDT)在制定个体化治疗方案中起到关键作用。
4.胆胰肿瘤腹膜转移研究进展
胆管癌、胰腺癌、乳腺癌、肺癌、神经内分泌肿瘤和肉瘤等腹膜外转移的肿瘤属于罕见来源的腹膜转移癌。虽然胆胰恶性肿瘤腹膜癌的研究相对较少,但已有的研究显示出了较好的前景。具体管理策略在处理腹膜转移癌方面会因原发肿瘤的不同而有所差别。原则上,通常由多个学科医生参与的诊疗方案会优先考虑围手术期化疗、手术和腹腔内化疗的治疗顺序[13]。
转化手术定义为化疗或放化疗后进行根治性手术,可以提高最初无法切除的晚期胆管癌(包括胆囊癌)患者的生存率。Yusuke Wakasa等人[14]诊治了一名69岁的女性因最初无法切除的胆囊癌伴腹膜癌转移。她接受了吉西他滨加顺铂治疗9个月。然后进行扩大胆囊切除术、肝外胆管切除术和区域淋巴结清扫术以及全网膜切除术作为转化手术。患者在继续化疗的同时,术后19个月(初诊后31个月)无复发生存。这表明中晚期胆囊癌的转化手术和术前新辅助是有效的,可能治愈局部晚期疾病和以及腹膜癌为代表的远处转移。
在胆胰肿瘤转移性腹膜癌中,如何有效的多学科联合治疗以及化疗药物治疗反应和耐药性依然是亟需解决的难题,一些个体化的治疗正在被众多学者尝试。Uehara S等人[15]成功诊疗了一名70多岁的女性因胆囊癌伴肝转移和腹膜播散的患者。在标准化疗失败后,对其进行了肝活检。FoundationOne CDx分析显示肿瘤突变负荷(TMB)很高。免疫检查点抑制剂(ICI)派姆单抗治疗产生了部分反应。总之,ICIs可能对TMB高BTC患者有效。
总之,既往认为胆胰肿瘤一旦腹膜转移则治疗手段有限,预后不容乐观。但随着治疗理念的更新和以肿瘤细胞减灭术(CRS)+腹腔热灌注化疗(HIPEC)为核心的治疗策略的建立,患者的预后和生活质量已经得到了极大的改善,甚至有部分患者可能获得临床治愈。纳米药物、PIPAC技术、近红外荧光引导手术等更多新的方法依然在探索中。
5.卵巢肿瘤腹膜转移研究进展
卵巢癌是女性生殖器官常见的恶性肿瘤,诊断时常为晚期,易广泛植入并转移到盆腔和腹腔,形成恶性腹水,其5年生存率仅为25-30%,是所有妇科恶性肿瘤中最低的。近两年在卵巢癌腹腔转移的机制、诊断和治疗方面都取得了一定的进展。
由于目前卵巢癌腹膜转移的机制不明确,治疗效果并不理想,导致部分患者治疗后复发、耐药伴随一些严重的并发症,探索卵巢癌腹腔内转移的机制,可以提高分子诊断和治疗水平。目前卵巢癌腹膜转移机制方面的进展主要包括基质细胞、衰老、免疫和基因促进肿瘤转移。
卵巢癌腹膜播散后手术不能彻底清楚肿瘤细胞,导致晚期卵巢癌患者的疾病复发和预后不良。常规CT或磁共振成像很难识别小的腹膜转移瘤,在手术中也容易被忽视,目前急需找到更准确的诊断卵巢癌腹膜转移的方法或指标。
碳水化合物抗原125(CA125)的糖基化异常可能与腹膜植入和转移有关。复旦大学妇产科医院纳入72例高级别浆液性卵巢癌(HGSOC)患者,晚期HGSOC患者治疗前血清CA125-Tn水平显著高于早期患者(P=0.029)。在晚期患者中,治疗前CA125-Tn水平随着Fagotti评分的增加(P=0.004)和腹膜播散(P=0.011)而升高。血清CA125-Tn水平可能是腹膜播散的新型生物标志物,也是手术彻底清除肿瘤细胞的有希望的预测指标[16]。
目前,卵巢癌的主要治疗方法是细胞减灭术后进行辅助化疗,一线化疗是卡铂联合紫杉醇,靶向治疗包括血管生成抑制剂和聚腺苷二磷酸核糖聚合酶抑制剂,虽然>80%的患者最初对治疗有效,但大多数患者最终会复发并耐药。
安罗替尼是一种新型口服多靶点酪氨酸激酶抑制剂,四川大学华西医院2023年发表数据显示:安罗替尼通过抑制体内细胞增殖和血管生成来抑制肿瘤生长。此外,安洛替尼在体外能够抑制卵巢癌细胞的迁移。这项研究证明了安洛替尼非凡的抗卵巢癌作用,可能为卵巢癌提供一种有前景的治疗策略[17]。
6.不同国家在腹膜肿瘤领域中的研究成果数量及合作情况
图1显示了每个国家在腹膜肿瘤领域中的研究成果数量及合作地图。可以看出,这一领域的研究以美国为主导,发表的文章最多,共发表论文920篇,欧洲国家次之,其后是日本、中国和澳大利亚,其余各个国家论文的发表数量相对较少。不同国家之间合作发表文章方面,以美国、欧洲国家、澳大利亚三者之间联系最为频繁和紧密,中国、日本与美国之间的合作较多,而与欧洲国家的联系相对较少,其余各个国家之间的合作较少。
图2更为全面地描述了包括美国、英国、法国等在内的其他国家之间的合作。其中美国、英国、法国、中国、德国和意大利合作发表的文章最多。这些主要国家的合作更密切,而其他国家的合作较弱。
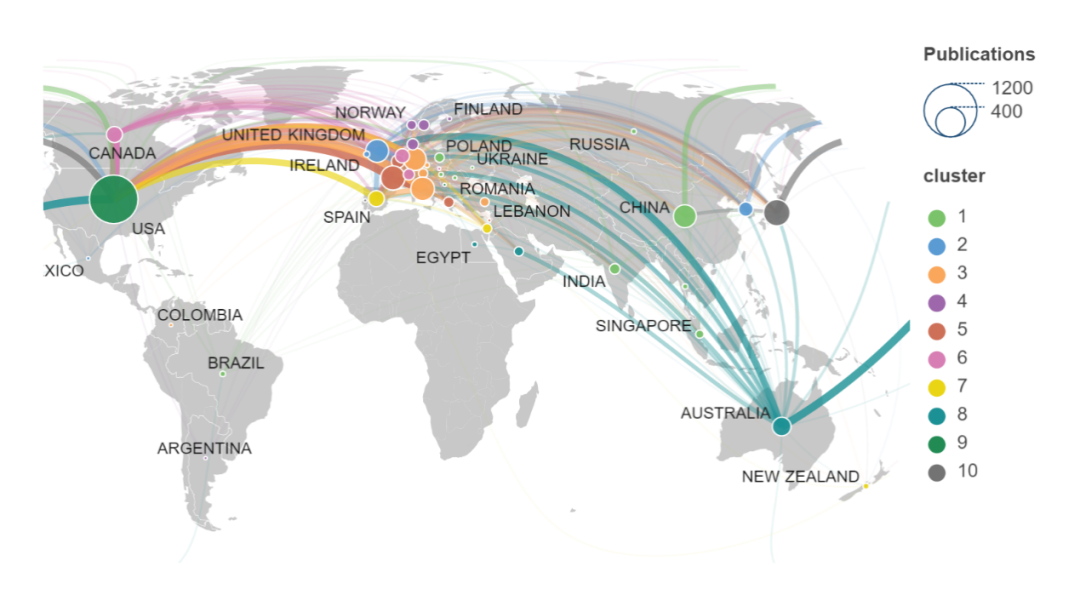
图1 世界各国家在腹膜肿瘤领域的研究成果及合作地图。
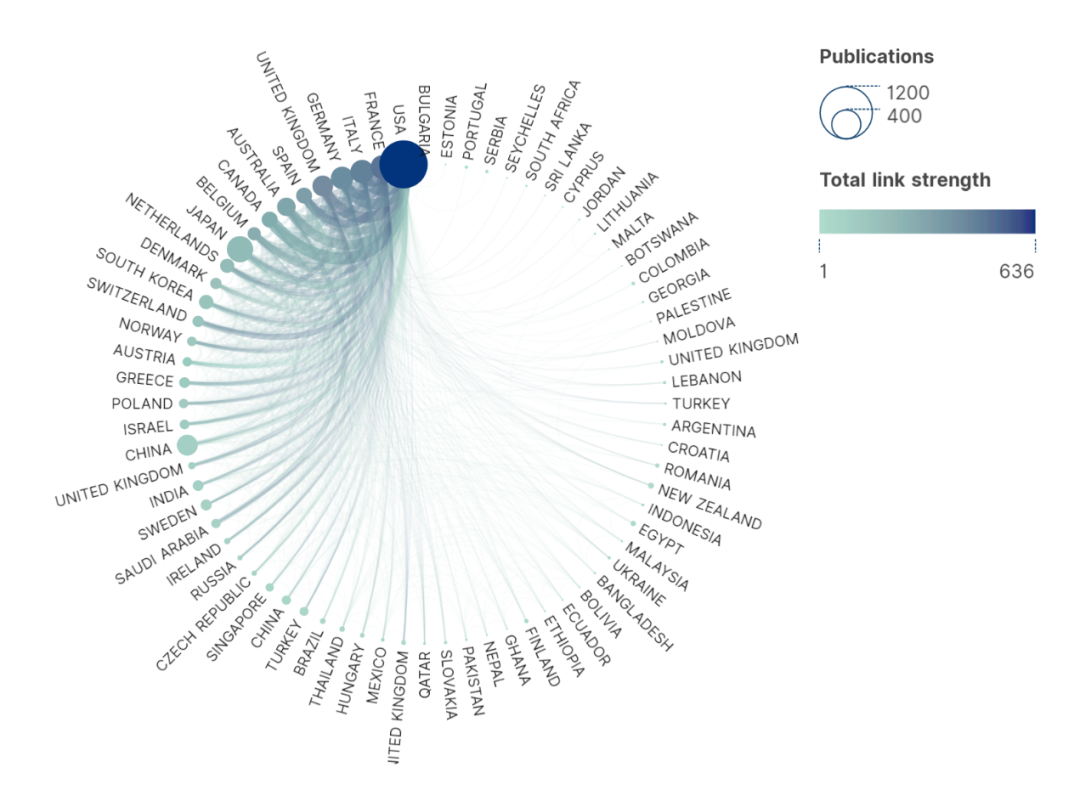
图2 腹膜肿瘤领域研究中的国家间的合作和弦图
7.不同国家及研究机构在腹膜肿瘤研究领域中的影响力分析
根据国家研究成果爆发图(图3),腹膜肿瘤领域的论文影响力自2013年起开始出现引用的高峰,2013年-2015年爆发成果较多的国家包括苏格兰、加拿大、美国、希腊,2015年-2020年丹麦,澳大利亚、新加坡、埃及、巴西、阿根廷、泰国以及沙特阿拉伯8个国家,近年来印度、日本、匈牙利、中国、瑞士五个国家是高被引论文的产出国家。我国从2022年开始在该领域爆发式产出成果,在爆发成果排名中居于第19位。

图3 腹膜肿瘤领域研究中的国家研究成果爆发图
在腹膜肿瘤领域高被引排名前25所研究机构中(图4),欧美国家、澳大利亚和日本的研究机构较多,其中有10家机构近三年来仍在持续发表高水平文章,保持其在本领域的高影响力,例如Netherlands Cancer Institute, University of London, National Cancer Center - Japan等,这也表明该领域仍然有众多科研者在持续开展相关研究。

图4 腹膜肿瘤领域研究中的机构研究成果爆发图
8.腹膜肿瘤研究领域发表文章数量较多的研究者及其合作关系分析
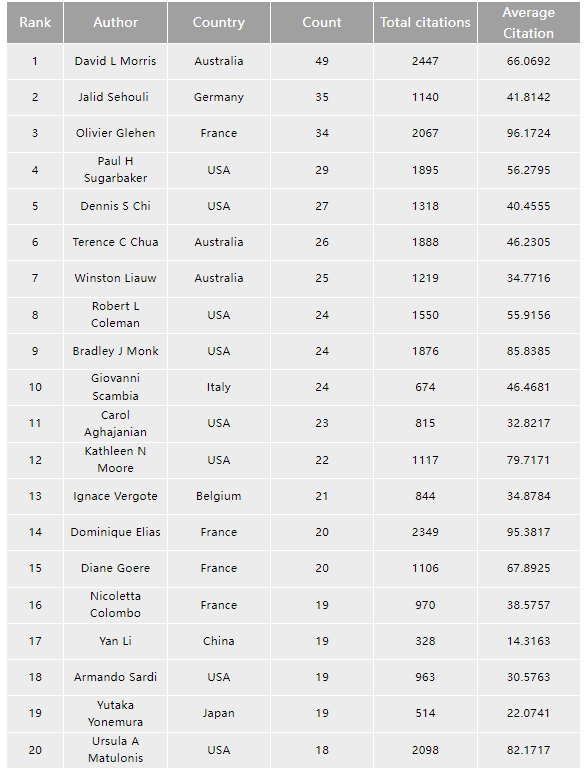
腹膜肿瘤领域发表文章数量(表1)最多的是澳大利亚David L Morris博士,在该领域发文49篇,平均引用次数66.07,该领域发文最多的前20名研究者中,有美国研究者8名,法国4名,澳大利亚3名,在前20名中我国的Yan Li教授位列17位。
表1 腹膜肿瘤领域发表文章数量前20位的研究者
对腹膜肿瘤研究领域中的作者分析表明(图5),该领域中的作者之间合作并不密切,少数作者间的合作基本集中在2014年-2018年,绝大多数论文的作者名单局限在本国之内,跨国的合作研究少见。
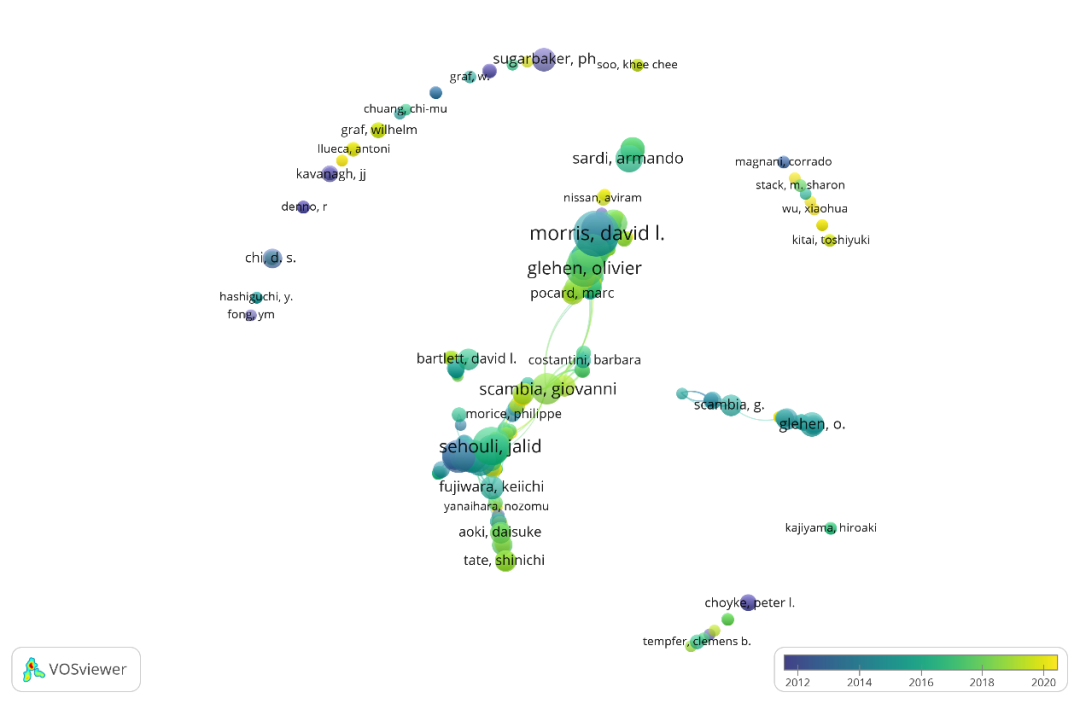
图5 在腹膜肿瘤研究领域各国作者合作关系网
9.腹膜肿瘤研究领域关键词分析
腹膜肿瘤研究领域的关键词大致可分为3类(图6),红色关键词以“细胞减灭术”为核心包含199条关键词,该类中包括次要关键词有“生存”、“管理”、“癌症”、“治疗”、“腹腔灌注化疗”、“扩散”、“并发症”、“腹膜转移”、“系统化疗”、“结直肠癌”,主要关注的是疗法的有效性、安全性和预后分析等;绿色以“卵巢癌”为核心有219条关键词,该类中包括次要关键词有“化学疗法”、“癌”、“治疗”、“原发性腹膜癌”、“铂化合物”、“新辅助化疗”、“上皮性卵巢癌”、“输卵管”、“紫杉醇”、“贝伐单抗”,主要关注的是卵巢癌来源的腹膜转移癌相关治疗手段及并发症等,蓝色区域是以“女性”为核心的一类研究,该类中包括次要关键词有“表达”、“乳腺癌”、“细胞”、“基因”、“间皮瘤”、“肿瘤”、“转移”、“成长”等,主要分析腹膜肿瘤易发群体及危险因素等。
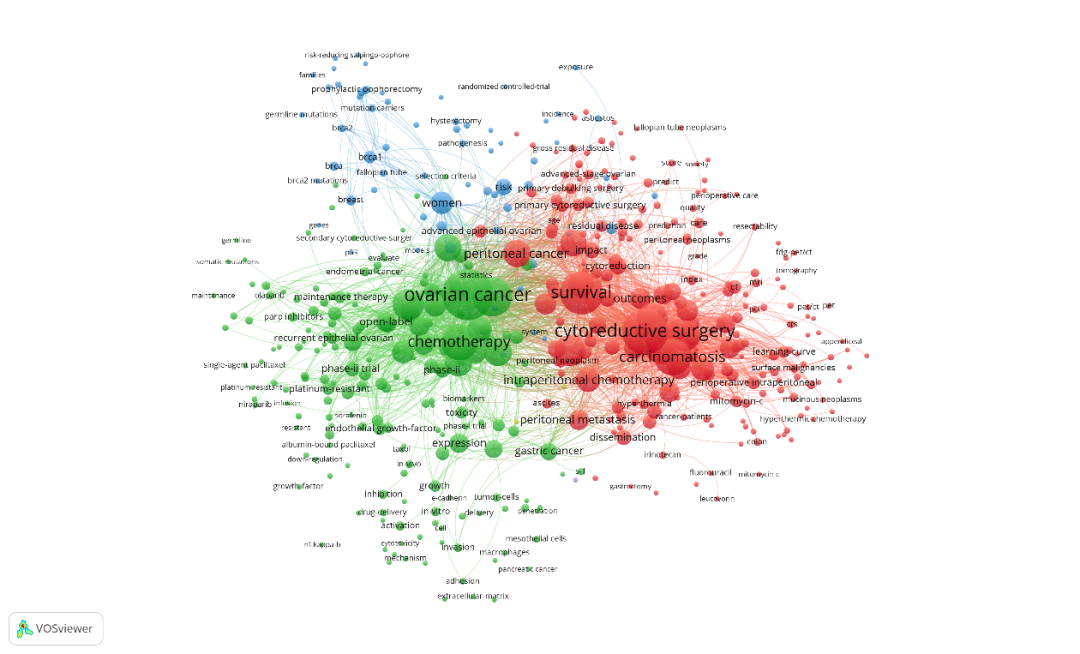
图6 腹膜肿瘤研究领域关键词共现聚类图
从腹膜肿瘤研究领域的关键词在不同时间的分布上看(图7),“奥拉帕梅”、“炎症”、“间质转化”、“恶性腹膜间皮瘤”、“细胞减灭术”、“开放标签”、“腹膜转移”、“围手术期护理”、“腹腔热灌注化治疗”、“吲哚菁绿”等是近3年更受关注的关键词,而“维持治疗”、“功效”、“指标”、“腹膜肿瘤”、“腹膜转移”、“输卵管肿瘤”、“PARP抑制剂”、“安全”、“总生存期”、“复发”也是近年来的热点词汇,并且热度仍在持续(图8)。

图7 腹膜肿瘤研究领域关键词共现时间视图

图8 腹膜肿瘤领域研究中关键词爆发图
【主编】
王西墨 天津大学海河医院
【副主编】
朱正刚 上海交通大学附属瑞金医院
崔书中 广州医科大学附属肿瘤医院
陶凯雄 华中科技大学同济医学院附属协和医院
梁 寒 天津医科大学肿瘤医院
李 雁 首都医科大学附属北京世纪坛医院
丁克峰 浙江大学医学院附属第二医院
林仲秋 中山大学孙逸仙纪念医院
姜小清 海军军医大学第三附属医院(上海东方肝胆外科医院)
【编委】(按姓氏拼音排序)
蔡国响 复旦大学附属肿瘤医院
胡建昆 四川大学华西医院
揭志刚 南昌大学第一附属医院
刘建华 河北医科大学第二医院
彭 正 中国人民解放军总医院
熊 斌 武汉大学中南医院
张相良 广州医科大学附属肿瘤医院
周岩冰 青岛大学附属医院
参考文献
1. Cortés-Guiral D, Hübner M, Alyami M, et al. Primary and metastatic peritoneal surface malignancies[J]. Nat Rev Dis Primers. 2021, 7(1):91.
2. Armstrong D K, Alvarez R D, Backes F J, et al. NCCN Guidelines® Insights: Ovarian Cancer, Version 3.2022[J]. J Natl Compr Canc Netw. 2022, 20(9):972-980.
3. Bhuyan P, Mahapatra S, Mahapatra S, et al. Extraovarian primary peritoneal papillary serous carcinoma[J]. Arch Gynecol Obstet. 2010, 281(3):561-564.
4. Armstrong D K, Bundy B, Wenzel L, et al. Intraperitoneal cisplatin and paclitaxel in ovarian cancer[J]. N Engl J Med. 2006, 354(1):34-43.
5. Pisano S, Lenna S, Healey G D, et al. Assessment of the immune landscapes of advanced ovarian cancer in an optimized in vivo model[J]. Clin Transl Med. 2021, 11(10):e551.
6. Huang X Z, Pang M J, Li J Y, et al. Single-cell sequencing of ascites fluid illustrates heterogeneity and therapy-induced evolution during gastric cancer peritoneal metastasis[J]. Nat Commun. 2023, 14(1):822.
7. Takahashi K, Kurashina K, Yamaguchi H, et al. Altered intraperitoneal immune microenvironment in patients with peritoneal metastases from gastric cancer[J]. Front Immunol. 2022, 13:969468.
8. Huang A, Guo F, Yu Z, et al. Engineered Apoptosis-Bioinspired Nanoparticles Initiate Immune Cascade for Cancer Immunotherapy of Malignant Ascites[J]. ACS Appl Mater Interfaces. 2023, 15(8):10371-10382.
9. Ma Q, He X, Zhang B, et al. A PD-L1-targeting chimeric switch receptor enhances efficacy of CAR-T cell for pleural and peritoneal metastasis[J]. Signal Transduct Target Ther. 2022, 7(1):380.
10. Zheng R S, Zhang S W, Sun K X, et al. [Cancer statistics in China, 2016][J]. Zhonghua Zhong Liu Za Zhi. 2023, 45(3):212-220.
11. Thomassen I, van Gestel Y R, van Ramshorst B, et al. Peritoneal carcinomatosis of gastric origin: a population-based study on incidence, survival and risk factors[J]. Int J Cancer. 2014, 134(3):622-628.
12. Strating E, Elias S, van Scharrenburg G, et al. Detection of Experimental Colorectal Peritoneal Metastases by a Novel PDGFRβ-Targeting Nanobody[J]. Cancers (Basel). 2022, 14(18):4348.
13. Kepenekian V, Bhatt A, Péron J, et al. Advances in the management of peritoneal malignancies[J]. Nat Rev Clin Oncol. 2022, 19(11):698-718.
14. Wakasa Y, Toyoki Y, Kusumi T, et al. Conversion surgery following gemcitabine plus cisplatin therapy for initially unresectable gallbladder cancer with peritoneal carcinomatosis: a case report[J]. Surg Case Rep. 2022, 8(1):50.
15. Uehara S, Naganuma A, Furuichi N, et al. Successful Treatment of Metastatic Gallbladder Carcinoma with a High Tumor Mutational Burden Using Pembrolizumab: A Case Report[J]. Intern Med. 2023.
16. Jin X, Du M, Wang Y, et al. Evaluation of serum CA125-Tn glycoform in peritoneal dissemination and surgical completeness of high-grade serous ovarian cancer[J]. J Ovarian Res. 2022, 15(1):134.
17. Zhu Y, Wang X, Chen Z, et al. Anlotinib Suppressed Ovarian Cancer Progression via Inducing G2/M Phase Arrest and Apoptosis[J]. J Clin Med. 2022, 12(1):162.