中国抗癌协会
立即下载App原发性骨髓纤维化诊断与治疗中国指南(2019年版)
原发性骨髓纤维化(primary myelofibrosis, PMF)的诊治在近年又有了长足的进展,如WHO诊断标准的更新、芦可替尼临床试验数据的更新以及该药在我国的上市。为给我国血液科医生提供PMF的规范化临床实践指导,由中华医学会血液学分会白血病淋巴瘤学组牵头,在《原发性骨髓纤维化诊断与治疗中国专家共识(2015年版)》[1]基础上制定了本指南。
必须仔细询问患者年龄、有无血栓栓塞病史、有无心血管高危因素(如高血压、高血脂、糖尿病、吸烟和充血性心力衰竭),有无疲劳、早饱感、腹部不适、皮肤瘙痒和骨痛,以及活动力、注意力、此前1年内体重下降情况,有无不能解释的发热或重度盗汗及持续时间,有无血制品输注史和家族有无类似疾病的患者等。采用骨髓增殖性肿瘤总症状评估量表(MPN-SAF-TSS,简称MPN-10)[2]对患者进行症状负荷评估。
以下实验室检查应作为疑诊PMF患者必检项目[3,4,5,6,7,8]:①外周血细胞计数;②骨髓穿刺涂片和外周血涂片分类计数;③骨髓活检活组织切片病理细胞学分析;④染色体核型分析(±FISH)(如果骨髓{L-End} "干抽{L-End} ",可用外周血标本);⑤JAK2、MPL和CALR基因突变和BCR-ABL1融合基因检测(如果骨髓{L-End} "干抽{L-End} ",可用外周血标本),ASXL1、TET2、DNMT3a、SRSF2、U2AF1、EZH2、IDH1/2、SF3B1、TP53和CBL等基因突变作为二线检测;⑥血清红细胞生成素(EPO)水平、尿酸、乳酸脱氢酶、肝功能、血清铁、铁蛋白等生化检查;⑦肝脏、脾脏超声或CT检查,有条件单位推荐MRI检测测定患者脾脏容积;⑧有可能接受造血干细胞移植(HSCT)的患者进行HLA配型。
PMF的诊断有赖于骨髓活检,为了保证准确病理分析,活检组织长度应至少1.5 cm,采用石蜡包埋,切片厚度为3~4 μm。骨髓活检活组织切片染色应包括常规HE和(或)Giemsa、网状纤维(嗜银)染色外,尚须进行糖原(PAS)染色、氯乙酸AS-D萘酚酯酶染色(CE)和普鲁士蓝染色(铁染色)等细胞化学染色,以及用CD34和CD61单抗进行免疫组织化学染色。
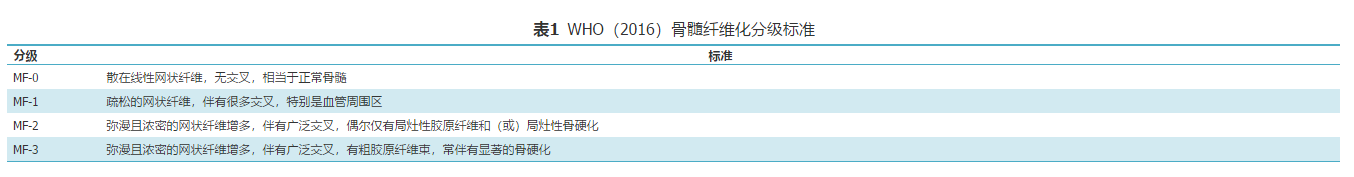
光镜下分析至少应包括以下内容:①细胞增生程度:是减低、正常还是活跃,增生程度是否与患者年龄相符(20~30岁:造血组织70%~60%;40~60岁:造血组织50%~40%;70~80岁:造血组织40%~30%;{L-End} >80岁:造血组织20%~10%);②粒系细胞:增多、正常还是减低,有无核左移;③红系细胞:增多、正常还是减低,有无核左移;④粒/红比值(结合PAS和CE染色);⑤巨核细胞:增多还是减低,分布方式(随机分布、疏松成簇分布、密集成簇分布、骨小梁旁异常分布),细胞大小,细胞核的形态(正常/分叶过多/分叶减少/裸核);⑥CD34+细胞:比例(0~9%/10%~19%/≥20%),有无成簇({L-End} >3个细胞);⑦纤维分级[根据WHO(2016)标准]:纤维分级、胶原分级和骨硬化级别;⑧有无窦内造血细胞。综合分析以上参数后再作出可能诊断。
二、诊断与鉴别诊断
导致反应性骨髓纤维化的常见原因有感染、自身免疫性疾病、慢性炎性疾病、毛细胞白血病或其他淋巴系统肿瘤、骨髓增生异常综合征(MDS)、转移性肿瘤及中毒性(慢性)骨髓疾患。
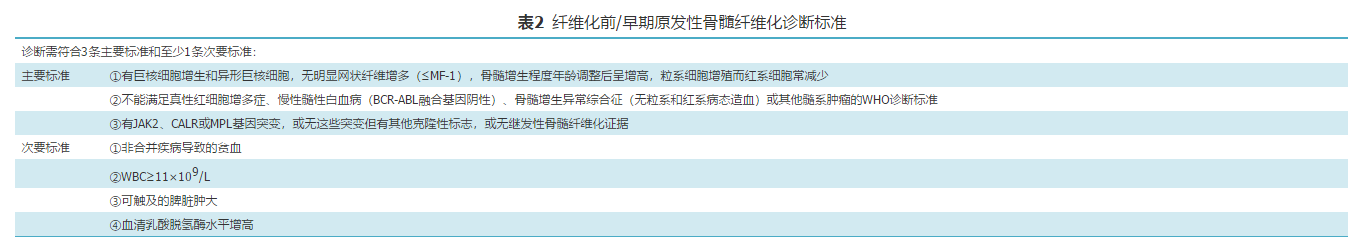
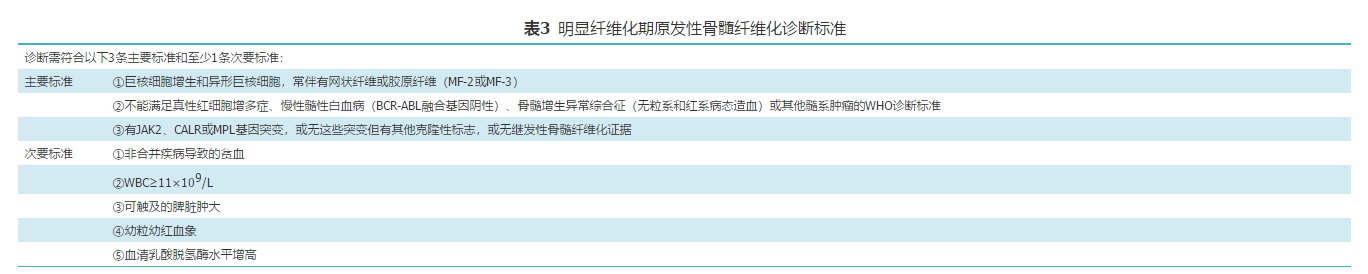
纤维化前/早期PMF应与原发性血小板增多症(ET)进行鉴别,二者的鉴别主要是依靠骨髓活检病理组织学形态分析[11,12]。{L-End} "真正{L-End} "ET患者年龄调整后的骨髓增生程度无或轻微增高,髓系和红系造血无显著增生,巨核细胞胞质和细胞核同步增大,体积大至巨大,细胞核高度分叶(鹿角状),嗜银染色纤维化分级常为MF-0;纤维化前/早期PMF患者年龄调整后的骨髓增生程度显著增高,髓系造血显著增生,红系造血减低,巨核细胞细胞核体积的增大超过胞质,体积小至巨大,成簇分布,细胞核低分叶呈云朵状,嗜银染色纤维化分级常为MF-0或MF-1。
有血细胞减少的PMF应与MDS合并骨髓纤维化进行鉴别诊断:近50%的MDS患者骨髓中有轻至中度网状纤维增多(MF-0或MF-1),其中10%~15%的患者有明显纤维化(MF-2或MF-3)[13]。与PMF不同的是,MDS合并骨髓纤维化常为全血细胞减少,异形和破碎红细胞较少见,骨髓常显示明显三系发育异常,胶原纤维形成十分少见,而且常无肝脾肿大。
PMF患者确诊后应根据国际预后积分系统(IPSS)[14]、动态国际预后积分系统(DIPSS)[15]或DIPSS-Plus预后积分系统[16](表4)对患者进行预后分组。IPSS适合初诊患者,而DIPSS和DIPSS-Plus则适合患者病程中任一时点的预后判定。
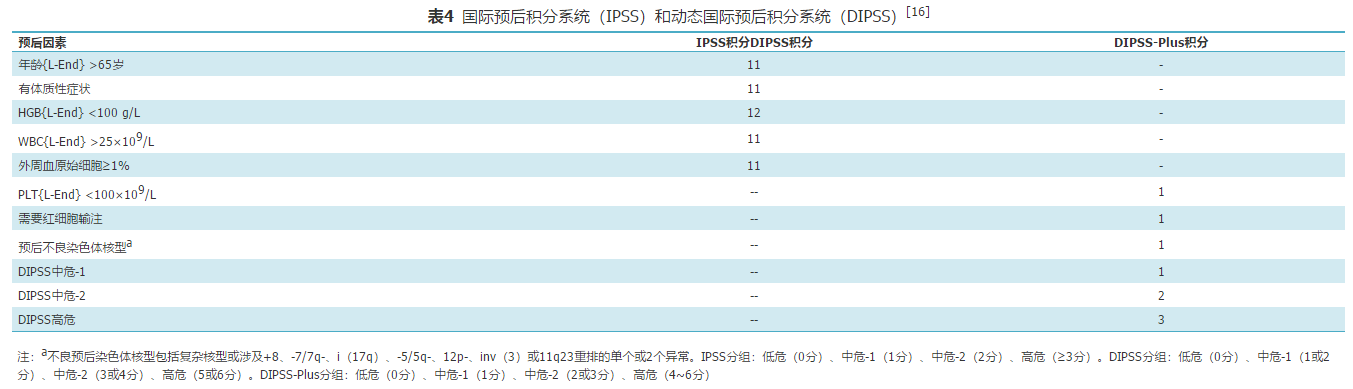
针对中国PMF特征修订的IPSS(IPSS-Chinese)或DIPSS(DIPSS-Chinese)积分[17]如下:①IPSS或DIPSS低危组(0分);②中危-1、触诊无脾脏肿大或PLT{L-End} <100×109/L(1分);③IPSS或DIPSS中危-2(2分);④IPSS或DIPSS高危(3分)。依据积分分为低危(0~1分)、中危(2~3分)和高危(4~5分)三组。
近年,随着对PMF基因突变谱系的阐释,有关基因突变的预后意义也有了初步探讨。意大利一个研究组将JAK2、CALR和MPL基因突变与IPSS预后参数结合,提出了一个PMF新预后积分系统[18]:有体质性症状(在确诊PMF前1年内体重下降10%和(或)不能解释的发热或重度盗汗持续超过1个月)、外周血原始细胞比例{L-End} >1%、HGB{L-End} <100 g/L、JAK2V617F(+)各赋予1分,患者年龄{L-End} >65岁、WBC{L-End} >25×109/L和MPL(+)、无JAK2、CALR和MPL基因突变各赋予2分,将患者分为极低危(0分)、低危(1分)、中危(2分或3分)、高危(4分或5分)和极高危(6分或以上)五组。研究证实该预后积分系统对患者的预后效应高于IPSS系统[19,20]。新近又提出了MIPSS70和MIPSS70-plus预后积分系统[21],但其临床实际应用价值尚待进一步验证。
PMF的治疗策略可依据患者的预后分组来加以制定,IPSS/DIPSS/DIPSS-Plus低危和中危-1患者如果没有明显的临床症状并且无明显的贫血(HGB{L-End} <100 g/L)、无明显的脾脏肿大(触诊左缘肋下{L-End} >10 cm)、白细胞计数增高({L-End} >25×109/L)或显著血小板计数增高({L-End} >1 000×109/L),可以仅观察、监测病情变化,如有降细胞治疗指征,首选羟基脲治疗,IFN-α亦是一个有效的降细胞药物[8]。
由于PMF患者面临一系列临床问题,如贫血、脾脏肿大、体质性症状、症状性髓外造血等,现今PMF的治疗策略制定主要是根据患者是否存在前述临床问题,结合患者预后分组给予适当处理[6,7,8]。
血红蛋白水平低于100 g/L时应开始贫血治疗。现今已证实,对PMF贫血有效的药物有糖皮质激素、雄激素、EPO和免疫调节剂,但所有这些药物均有不足之处,目前尚缺乏随机对照临床试验。
雄激素可使1/3~1/2患者的贫血症状得到改善,糖皮质激素可使1/3严重贫血或血小板减少的患者得到改善,因此,伴贫血和(或)血小板减少的患者初治时可联合雄激素(司坦唑醇6 mg/d或达那唑200 mg每8 h 1次)和糖皮质激素(泼尼松30 mg/d),至少3个月。如果疗效好,雄激素可继续使用,糖皮质激素逐渐减量。有前列腺疾患或有肝病患者不宜选用雄激素治疗。
EPO治疗PMF的观点尚不统一,有研究者对已发表文献进行Meta分析,结果显示EPO治疗PMF贫血的有效率为30%~40%。EPO主要适用于血清EPO{L-End} <100 U/L的贫血患者,常用剂量为每周30 000~50 000 U。
传统剂量({L-End} >100 mg/d)沙利度胺单药治疗有效率较低且不良反应明显,不建议单药治疗。小剂量沙利度胺(50 mg/d)联合泼尼松(0.5 mg·kg-1·d-1)较单用沙利度胺能提高疗效,减少不良反应。在小剂量沙利度胺、泼尼松的基础上再联合达那唑可进一步提高疗效、延长有效期[22]。有2度或以上外周神经病的患者不宜选用沙利度胺。
来那度胺单药治疗MF的Ⅱ期临床试验结果表明,贫血、脾大、血小板减少的有效率分别为22%、33%、50%。来那度胺(PLT{L-End} <100×109/L的患者起始剂量为5 mg/d,PLT≥100×109/L的患者起始剂量为10 mg/d,连续服用21 d后停用7 d,28 d为1个周期)联合泼尼松(30 mg/d)的Ⅱ期临床试验结果显示,贫血和脾肿大的有效率分别为30%、42%。
芦可替尼可作为有脾肿大的IPSS/DIPSS/DIPSS-Plus中危-2和高危患者的一线治疗,对那些有严重症状性脾肿大(如左上腹疼或由于早饱而影响进食量)的中危-1患者亦可以作为一线治疗,其他患者首选药物是羟基脲[8]。脾区照射只能暂时获益。脾切除术仍为药物治疗无效的脾肿大患者的可行选择。
2个大系列的Ⅲ期临床试验COMFORT-1和COMFORT-2肯定了芦可替尼在缩脾和改善骨髓纤维化相关症状的疗效,而且证实芦可替尼与现有常规骨髓纤维化治疗药物相比,可显著延长患者的总生存(OS)期。COMFORT-1和COMFORT-2研究的5年随访数据表明,芦可替尼治疗组的死亡率较对照组降低30%,中位OS时间从对照组的45.9个月延长至芦可替尼组的63.5个月,此外,COMFORT-1试验还发现芦可替尼使33%的患者骨髓纤维化程度改善,49%的患者处于稳定,即82%的患者接受芦可替尼治疗后骨髓纤维化进程会停止,甚至好转。中国大陆(63例)、韩国、日本和中国台湾的国际多中心Ⅱ期临床试验结果与COMFORT-1和COMFORT-2相似[23]。
芦可替尼的起始剂量主要依据患者的血小板计数水平:治疗前PLT{L-End} >200×109/L患者的推荐起始剂量为20 mg每日2次,PLT(100~200)×109/L患者的推荐起始剂量为15 mg每日2次,PLT(50~{L-End} <100)×109/L患者的推荐起始剂量为5 mg每日2次。前4周不应增加剂量,调整剂量间隔至少2周,最大用量为25 mg每日2次。治疗过程中PLT{L-End} <100×109/L时应考虑减量;PLT{L-End} <50×109/L或中性粒细胞绝对计数{L-End} <0.5×109/L应停药。芦可替尼开始治疗前查血常规和包括尿酸和乳酸脱氢酶的详细代谢指标,此后,每2~4周复查1次,直至芦可替尼剂量稳定后,根据临床情况决定复查频率。在治疗前及治疗过程中用MPN-10评估患者临床症状负荷。此外,采用触诊或B超监测脾脏大小变化。停药应在7~10 d内逐渐减停,应避免突然停药,停药过程中推荐加用泼尼松20~30 mg/d。
芦可替尼最常见的血液学不良反应为3/4级的贫血、血小板减少以及中性粒细胞减少[24]。3/4级的贫血可见于治疗的前6个月,主要发生在开始治疗的前8~12周,在24周左右达到稳态水平。治疗过程中出现贫血的患者除红细胞输注外,可加用EPO或达那唑。血小板减少是治疗开始8~12周内最常见的血液学不良反应,随后血小板计数处于稳态水平。血小板减少的主要处理方法是依据血小板计数水平调整芦可替尼用量。
芦可替尼最常见的非血液学不良反应是感染(特别是泌尿系感染和呼吸系统感染)以及病毒再激活[24]。用药前应仔细询问既往感染史(特别是带状疱疹、结核和肝炎病毒感染史),常规筛查HIV和肝炎病毒,肝炎病毒携带者应在用药过程中动态监测病毒拷贝数定量。
缩脾的有效率约为40%。羟基脲治疗无效的患者可用其他骨髓抑制剂替换,如静脉克拉屈滨(5 mg·m-2·d-1×5 d,每次输注2 h,每月1个疗程,重复4~6个月)、口服美法仑(2.5 mg每周3次)或口服白消安(2~6 mg/d,密切监测血常规)。
放射治疗可缓解肝、脾肿大所致的饱胀症状,但症状缓解时间较短(中位时间3~6个月)。脾区照射的总剂量为0.1~0.5 Gy(分为5~10次照射)。主要不良反应是血细胞减少,由此而导致的死亡率可达10%以上。
当前推断细胞因子的异常产生与PMF相关体质性症状和恶病质有因果关系。PMF患者的体质性症状可很严重,须视为一个重要的治疗指征。针对脾脏肿大的治疗常可部分缓解体质性症状。芦可替尼可显著改善PMF的体质性症状,那些MPN-10总积分{L-End} >44分或难治且严重(单项评分{L-End} >6分)的皮肤瘙痒或不是由其他原因导致的超预期的体重下降(过去6个月下降{L-End} >10%)或不能解释的发热的患者,芦可替尼可以作为一线治疗[25]。
胸椎椎体是PMF非肝脾性髓外造血(EMH)的最常见部位。其他的部位包括淋巴结、肺、胸膜、小肠、腹膜、泌尿生殖道和心脏。当出现临床症状时,可采用低剂量病灶局部放疗(0.1~1.0 Gy,分为5~10次照射)。现时,低剂量放疗是PMF相关非肝脾EMH的治疗选择。
allo-HSCT是目前唯一可能治愈PMF的治疗方法,但有相当高的治疗相关死亡率和并发症发生率。常规强度预处理allo-HSCT的1年治疗相关死亡率约为30%,OS率约为50%;减低强度预处理者,5年中位OS率约为45%,与治疗相关和复发相关死亡率相近。与之相比,最近的一项研究显示,符合移植条件(高危或中危-1患者,{L-End} <60岁)但未行HSCT的PMF患者,1年、3年OS率分别为71%~95%、55%~77%。
对于预计生存时间小于5年且符合造血干细胞移植条件者,应权衡allo-HSCT相关并发症的风险。allo-HSCT候选患者包括IPSS高危(中位OS期27个月)或中危-2(中位OS期48个月)患者,以及那些输血依赖(中位OS期20个月)或有不良细胞遗传学异常(中位OS期40个月)的患者。是否最终选择allo-HSCT还必须考虑其他可导致allo-HSCT失败的不良因素,包括红细胞输注负荷、重度脾大、非HLA相合的同胞供者,造血干细胞移植合并疾病指数(HCT-CI)评分高、高龄、疾病晚期和非HLA完全相合无关供者。如选择allo-HSCT,应当向有丰富造血干细胞移植经验的医生进行咨询。
PMF脾切除术的围手术期死亡率为5%~10%,术后并发症发生率约为50%。并发症包括手术部位出血、血栓形成、膈下脓肿、肝脏加速肿大、血小板计数极度增高和伴原始细胞过多的白细胞增多。考虑脾切除的患者须体能状况良好且无弥散性血管内凝血(DIC)的临床或实验室证据。
脾切除术的指征包括:有症状的门脉高压(如静脉曲张出血、腹水),药物难治的显著脾肿大伴有疼痛或合并严重恶病质,以及依赖输血的贫血。相反,严重的血小板减少是即将发生白血病转化的标志,切脾对此类患者的预后不会有良好的影响。脾切除术前推荐的预防性措施包括降细胞药物和抗凝药物。血小板计数应维持在400×109/L以下,因为术后可能出现极度血小板计数增高,建议由有经验的外科小组进行手术。
该期的任何治疗疗效都很差,应考虑试验性或姑息性治疗。应考虑对有选择的患者进行强烈诱导化疗,然后行allo-HSCT进行巩固。对于拟行allo-HSCT的患者,移植前只需疾病逆转至慢性期也许不需达完全缓解。
2005年欧洲骨髓纤维化网(EUMNET)提出的疗效判断标准从3个层面来进行疗效判断:临床血液学疗效、骨髓组织学疗效和细胞遗传学疗效。2006年骨髓增殖性肿瘤研究和治疗国际工作组(IWG-MRT)针对该疗效判断标准的不足,又提出了一个疗效判断标准[29]。本指南疗效标准采用2013年的EUMNET和IWG-MRT共识标准[30](表5)。

(执笔:肖志坚)
参加指南讨论的专家(按姓氏笔画排列):中国医学科学院血液病医院(王建祥、肖志坚、张培红);哈尔滨市血液肿瘤研究所(马军);南方医科大学附属南方医院(刘启发);四川大学华西医院(刘霆、潘崚);上海第二医科大学附属瑞金医院(李军民);苏州大学附属第一医院(吴德沛、陈苏宁);南京大学第一医院(李建勇);广东省人民医院(杜欣);北京协和医院(周道斌、段明辉);天津医科大学总医院(邵宗鸿);华中科技大学同济医学院附属协和医院(胡豫);福建医科大学附属协和医院(胡建达);浙江大学医学院附属第一医院(金洁);中国医科大学盛京医院(杨威);北京大学人民医院(黄晓军、刘开彦、江倩);上海市第六人民医院(常春康)
[30]. Revised response criteria for myelofibrosis: International Working Group-Myeloproliferative Neoplasms Research and Treatment(IWG-MRT)and European LeukemiaNet(ELN)consensus report[J]. Blood, 2013, 122(8):1395-1398. DOI:10.1182/blood-2013-03-488098.