中国抗癌协会
立即下载App成人急性髓系白血病(非急性早幼粒细胞白血病)中国诊疗指南(2017年版)
•年龄
•此前有无血液病史[主要指骨髓增生异常综合征(MDS)、骨髓增殖性肿瘤(MPN)等]
•是否为治疗相关性(包括肿瘤放疗、化疗)
•有无重要脏器功能不全(主要指心、肝、肾功能等)
•有无髓外浸润[主要指中枢神经系统白血病(CNSL)、皮肤浸润、髓系肉瘤]
•血常规、血生化、出凝血检查
•骨髓细胞形态学(包括细胞形态学、细胞化学、组织病理学)
•免疫分型
•细胞遗传学检测[染色体核型分析、荧光原位杂交(FISH)]
•分子学检测
初级检查:PML-RARα、AML1-ETO、CBFβ-MYH11、MLL重排、BCR-ABL融合基因及C-Kit、FLT3-ITD、NPM1、CEBPA、TP53、RUNX1(AML1)、ASXL1基因突变,这些检查是急性髓系白血病(AML)分型和危险度分组的基础[1,2,3]。
次级检查:IDH1、IDH2、DNMT3a、TET2及RNA剪接染色质修饰基因突变(包括SF3B1、U2AF1、SRSF2、ZRSR2、EZH2、BCOR、STAG2),这些检查对于AML的预后判断及治疗药物选择具有一定的指导意义[4]。
•有意愿行异基因造血干细胞移植(allo-HSCT)的患者可以行HLA配型
AML的诊断标准参照WHO(2016)造血和淋巴组织肿瘤分类标准,诊断AML的外周血或骨髓原始细胞比例下限为0.200。当患者被证实有克隆性重现性细胞遗传学异常t(8;21)(q22;q22)、inv(16)(p13q22)或t(16;16)(p13;q22)以及t(15;17)(q22;q12)时,即使原始细胞<0.200,也应诊断为AML[2]。
•年龄≥60岁
•此前有MDS或MPN病史
•治疗相关性/继发性AML
•高白细胞计数(WBC≥100×109/L)
•合并CNSL
•伴有预后差的染色体核型或分子遗传学标志
•诱导化疗2个疗程未达完全缓解(CR)
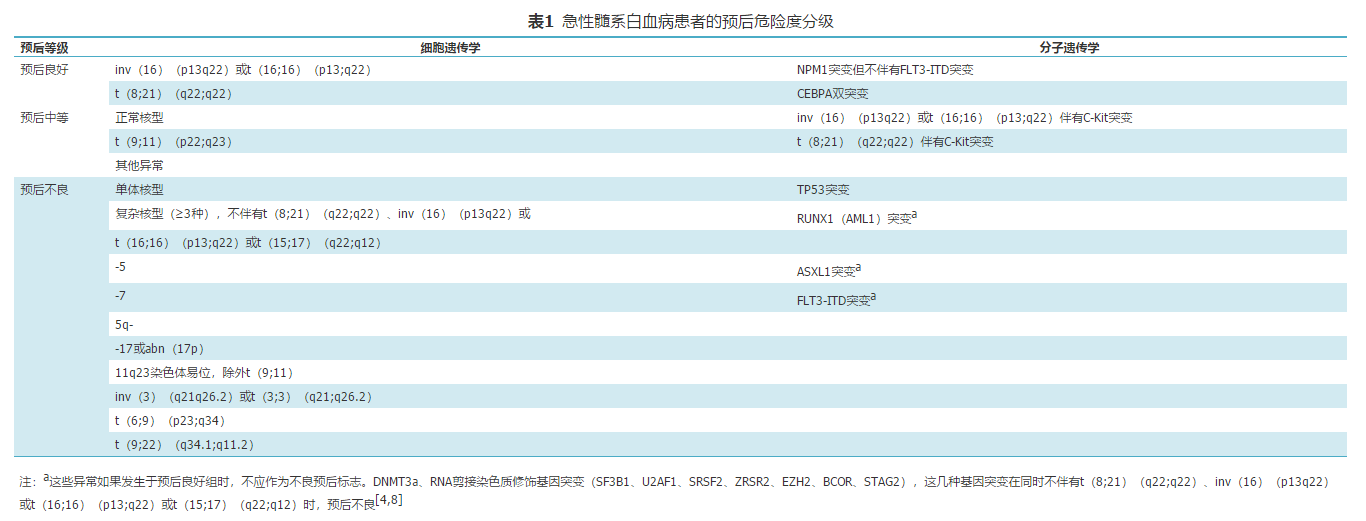
目前国内主要是根据初诊时白血病细胞遗传学和分子遗传学的改变进行AML预后危险度判定[3,5,6,7]。具体见表1。
二、治疗
所有AML患者,可以参加临床研究的情况下,均建议首选参加临床研究。在没有临床研究的情况下,可以参照下述建议进行治疗。
(1)常规的诱导缓解方案:标准剂量阿糖胞苷(Ara-C)100~200 mg·m-2·d-1×7 d联合去甲氧柔红霉素(IDA)12 mg·m-2·d-1×3 d或柔红霉素(DNR)60~90 mg·m-2·d-1×3 d[9,10,11]。IDA和DNR的用量可以根据患者的情况,按照下述化疗药物推荐剂量范围进行调整。
(2)含中大剂量Ara-C的诱导治疗方案:
①蒽环类药物(包括IDA、DNR等)联合中大剂量Ara-C:蒽环类药物为3 d用药,剂量同下述化疗药物推荐使用剂量;Ara-C用量为1.0~2.0 g/m2,每12 h 1次,第1、3、5天或第1~5天。
②含中剂量Ara-C的HAD方案:高三尖杉酯碱(HHT)2 mg·m-2·d-1×7 d,DNR 40 mg·m-2·d-1×3 d,Ara-C前4天为100 mg·m-2·d-1,第5、6、7天为1.0~1.5 g/m2,每12 h 1次[12]。
(3)其他诱导方案:HA+蒽环类药物组成的方案,如HAA[HA+阿克拉霉素(Acla)]、HAD(HA+DNR)方案等[13]。HA为HHT(或三尖杉酯碱)联合标准剂量Ara-C的方案。
化疗药物推荐剂量:标准剂量Ara-C 100~200 mg·m-2·d-1×7 d,IDA 10~12 mg·m-2·d-1×3 d,DNR 45~90 mg·m-2·d-1×3 d,Acla 20 mg/d×7 d,HHT 2.0~2.5 mg·m-2·d-1×7 d(或4 mg·m-2·d-1×3 d)。临床工作中可以参照上述方案、药物剂量,根据患者情况调整。
诱导治疗过程中建议在骨髓抑制期(停化疗后第7~14天)、恢复期(停化疗后第21~28天)复查骨髓。根据骨髓抑制期、恢复期的骨髓情况进行治疗调整。
(1)标准剂量Ara-C诱导治疗后的监测:
①停化疗后第7~14天复查骨髓:
a.存在明显的残留白血病细胞(≥10%),可以考虑双诱导治疗,建议方案:
•中大剂量Ara-C为基础的联合方案:如联合IDA或DNR的方案;FLAG(氟达拉滨+Ara-C+G-CSF)方案等
•标准剂量Ara-C+蒽环或蒽醌类等药物[IDA、DNR、米托蒽醌(Mitox)等]
•含G-CSF的预激方案(如CAG方案:G-CSF+Ara-C+Acla)
•等待观察(尤其是骨髓增生低下的情况下)
b.残留白血病细胞<10%,但无增生低下:可给予双诱导治疗,采用标准剂量Ara-C+蒽环或蒽醌类药物(IDA、DNR或Mitox等);或等待恢复。
c.增生低下,残留白血病细胞<10%:等待恢复。
②停化疗后第21~28天(骨髓恢复期)复查骨髓、血常规:
a.取得CR,进入缓解后治疗。
b.白血病细胞比例下降不足60%的患者,按诱导治疗失败对待。
c.未取得CR,但白血病细胞比例下降超过60%的患者可重复原方案1个疗程;也可换二线方案。
d.增生低下,残留白血病细胞<10%时,等待恢复;残留白血病细胞≥10%时,可考虑下一步治疗(参考双诱导治疗的方案或按诱导治疗失败患者选择治疗方案)。
(2)含中大剂量Ara-C方案的诱导治疗后监测:
①停化疗后第7~14天复查骨髓:
a.存在明显的残留白血病细胞(≥10%):按诱导失败对待。
b.残留白血病细胞<10%,但无增生低下:等待恢复。
c.残留白血病细胞<10%,增生低下:等待恢复。
②停化疗后第21~28天(骨髓恢复期)复查骨髓、血常规:
a.取得CR,进入缓解后治疗。
b.骨髓已恢复,但达不到CR标准的,按诱导治疗失败对待。
c.增生低下:残留白血病细胞<10%时,等待恢复;残留白血病细胞≥10%时,按治疗失败对待。
按遗传学预后危险度分组治疗;蒽环、Mitox(6~10 mg·m-2·d-1×3 d)的剂量同诱导治疗方案。
(1)预后良好组:
①多疗程的大剂量Ara-C:大剂量Ara-C(3 g/m2,每12 h 1次,6个剂量),3~4个疗程,单药应用[14,15]。②其他缓解后治疗方案:
a.中大剂量Ara-C(1~2 g/m2,每12 h 1次,6个剂量)为基础的方案:与蒽环/蒽醌类、氟达拉滨等联合应用,2~3个疗程后行标准剂量化疗,总的缓解后化疗周期≥4个疗程[12]。
b. 2~3个疗程中大剂量Ara-C为基础的方案巩固,继而行自体造血干细胞移植(auto-HSCT)。
c.标准剂量化疗(Ara-C联合蒽环/蒽醌类、HHT、鬼臼类等),总的缓解后化疗周期≥6个疗程或标准剂量化疗巩固3~4个疗程后行auto-HSCT[16]。
(2)预后中等组:
①allo-HSCT:寻找供者期间行1~2个疗程的中大剂量Ara-C为基础的化疗或标准剂量化疗[17]。
②多疗程的大剂量Ara-C:大剂量Ara-C (3 g/m2,每12 h 1次,6个剂量),3~4个疗程,单药应用[14,15]。
③2~3个疗程中大剂量Ara-C为基础的巩固治疗后行auto-HSCT。
④其他巩固治疗方案:
a.中大剂量Ara-C(1~2 g/m2,每12 h 1次,6个剂量)为基础的方案:与蒽环/蒽醌类等药物联合应用,2~3个疗程后行标准剂量化疗,总的缓解后化疗周期≥4个疗程[12]。
b.标准剂量化疗(Ara-C联合蒽环/蒽醌类、HHT、鬼臼类等),总的缓解后化疗周期≥6个疗程或标准剂量化疗巩固3~4个疗程后行造血干细胞移植[16]。
(3)预后不良组:
①尽早行allo-HSCT。寻找供者期间行1~2个疗程的中大剂量Ara-C为基础的化疗或标准剂量化疗[17]。
②无条件移植者予大剂量Ara-C(3 g/m2,每12 h 1次,6个剂量),3~4个疗程,单药应用[14,15]。
③其他巩固治疗方案:
a. 2~3个疗程的中大剂量Ara-C为基础的化疗,或标准剂量化疗巩固治疗,继而行auto-HSCT。
b.标准剂量化疗巩固治疗(≥6个疗程)[16]。
(4)未进行染色体核型等检查、无法进行危险度分组者:参考预后中等组患者治疗。若诊断时WBC≥100×109/L,则按预后不良组治疗。
(1)适合接受强烈化疗的患者(根据年龄、PS评分及合并基础疾病判断):治疗前应尽量获得遗传学检测结果,根据患者的预后可以分为两种情况[18]。
①没有不良预后因素(预后不良遗传学异常;前期血液病病史;治疗相关AML):对于治疗前没有获得遗传学结果的患者,治疗原则可以参照没有不良预后因素的情况。
a.标准剂量化疗:标准剂量Ara-C(100 mg·m-2·d-1×7 d)联合IDA(8~12 mg·m-2·d-1)或DNR (40~60 mg·m-2·d-1)或Mitox(6~8 mg·m-2·d-1)
b.低强度化疗方案,具体方案见具有不良预后因素患者的低强度化疗方案。
②具有不良预后因素(预后不良遗传学异常;前期血液病病史;治疗相关AML)
a.低强度化疗:地西他滨(20 mg·m-2·d-1,5~10 d);小剂量化疗±G-CSF(如小剂量Ara-C为基础的CAG、CHG、CMG等方案,C:Ara-C;A:Acla;H:HHT;M:Mitox);地西他滨联合小剂量化疗等[23,24,25,26]。
b.标准剂量化疗:标准剂量Ara-C(100 mg·m-2·d-1×7 d)联合IDA(8~12 mg·m-2·d-1)或DNR(40~60 mg·m-2·d-1)或Mitox(6~8 mg·m-2·d-1)1~2个疗程。
(2)不适合标准剂量化疗的患者:
①低强度化疗:地西他滨(20 mg·m-2·d-1,5~10 d);地西他滨联合小剂量化疗;小剂量化疗±G-CSF(如小剂量Ara-C为基础的CAG、CHG、CMG等方案);小剂量Ara-C(20 mg,每日2次,连用10 d,4~6周为1个疗程)[23,24,25,26,27]。
②支持治疗。
(1)低强度化疗:地西他滨(20 mg·m-2·d-1,5 d);地西他滨联合小剂量化疗;小剂量化疗±G-CSF(如小剂量Ara-C为基础的CAG、CHG、CMG等方案);小剂量Ara-C(20 mg,每日2次,连用10 d,4~6周为1个疗程)[23,24,25,26,27]。
(2)支持治疗。
(1)停化疗后第7~14天复查骨髓:
①骨髓仍存在明显的残留白血病细胞(≥10%):a.等待恢复;b.按诱导治疗失败对待。
②残留白血病细胞<10%,但无增生低下:等待恢复。
③残留白血病细胞<10%且增生低下:等待恢复。
(2)停化疗后第21~28天复查骨髓、血常规:
①取得CR,进入缓解后治疗。
②白血病细胞比例下降不足60%的患者,按诱导治疗失败对待。
③未达CR但白血病细胞比例下降超过60%的患者,可重复原方案1个疗程或更换二线方案。
④增生低下:残留白血病细胞<10%时,等待恢复;残留白血病细胞≥10%时,按诱导治疗失败对待。
①标准剂量Ara-C(75~100 mg·m-2·d-1×5~7 d)为基础的方案巩固强化。可与蒽环或蒽醌类(IDA、DNR或Mitox等)、HHT、鬼臼类等联合。总的缓解后化疗周期4~6个疗程[20]。
②年龄<70岁,一般状况良好、肾功能正常(肌酐清除率≥70 ml/min)、预后良好核型或伴有良好分子遗传学异常的正常核型患者可接受Ara-C 1.0~1.5 mg·m-2·d-1×4~6个剂量,1~2个疗程。后改为标准剂量方案治疗,总的缓解后治疗周期4~6个疗程[14,28]。
③年龄<70岁,一般状况良好、重要脏器功能基本正常、伴有预后不良因素、有合适供者的患者,可进行非清髓预处理的allo-HSCT[29,30]。
④去甲基化药物(如地西他滨)治疗,直至疾病进展。
AML患者CNSL的发生率远低于急性淋巴细胞白血病,一般不到3%。参考NCCN的意见,在诊断时对无症状的患者不建议行腰椎穿刺(腰穿)检查。有头痛、精神混乱、感觉改变的患者应先行放射学检查(CT/MRI),排除神经系统出血或肿块。这些症状也可能是由于白细胞淤滞引起,可通过白细胞分离等降低白细胞计数的措施解决。若体征不清楚、无颅内出血的证据,可在纠正出凝血紊乱和血小板支持的情况下行腰穿。脑脊液中发现白血病细胞者,应在全身化疗的同时鞘内注射(鞘注)Ara-C(40~50 mg/次)和(或)甲氨蝶呤(MTX,5~15 mg/次)+地塞米松(5~10 mg/次)。若症状持续存在,脑脊液无异常,应复查。
已达CR的患者,尤其是治疗前WBC≥40×109/L或单核细胞白血病(M4和M5)、t(8;21)/AML1-ETO、inv(16)白血病患者,建议至少行腰穿、鞘注1次,以进行CNSL的筛查。
首先应进行CT/MRI检查,除外出血或肿块。
(1)未发现颅内/脊髓肿块者,进行腰穿。脑脊液正常者,予以观察;如果症状持续存在可以再次腰穿。脑脊液发现白血病细胞者,予以每周2次鞘注化疗药物直至脑脊液正常,以后每周1次×4~6周。
(2)发现颅内/脊髓肿块或颅压增高者,建议先行放射治疗;然后鞘注,每周2次鞘注化疗药物直至脑脊液正常,以后每周1次×4~6周。
每周2次鞘注化疗药物直至脑脊液正常,以后每周1次×4~6周。若患者接受大剂量Ara-C治疗,应于治疗完成后复查脑脊液(证实脑脊液正常);也可以配合腰穿、鞘注,至脑脊液恢复正常。
WBC≥40×109/L或单核细胞白血病(M4和M5)、t(8;21)/AML1-ETO、inv(16)白血病患者,每疗程行1~2次腰穿、鞘注,共4~6次(采用大剂量Ara-C治疗者可以减少腰穿次数)。其余患者不再特别强调腰穿、鞘注的次数;以后出现神经系统症状者应再次腰穿。
(四)特别说明
在AML的整个治疗过程中应特别注意化疗药物的心脏毒性问题,注意监测心功能(包括心电图、心肌酶、超声心动图等)。DNR的最大累积剂量550 mg/m2,活动性或隐匿性心血管疾病、目前或既往接受过纵隔/心脏周围区域的放疗、既往采用其他蒽环类或蒽二酮类药物治疗、同时使用其他抑制心肌收缩功能的药物或具有心脏毒性的药物(如曲妥珠单抗)等情况,累积剂量一般不超过400 mg/m2。IDA的最大累积剂量为290 mg/m2,Mitox的累积剂量为160 mg/m2。计算累积剂量时还应考虑整个治疗周期的持续时间、类似药物的使用情况。
(执笔:魏辉)
参加共识讨论的专家:中国医学科学院血液学研究所、血液病医院(王建祥、肖志坚、秘营昌);上海交通大学附属瑞金医院(沈志祥、李军民、赵维莅);浙江大学附属第一医院(金洁);第二军医大学长海医院(王健民);哈尔滨血液病肿瘤研究所(马军);四川大学华西医院(刘霆);中国医学科学院北京协和医院(周道斌);北京大学人民医院、北京大学血液病研究所(黄晓军、江滨);华中科技大学同济医学院附属协和医院(胡豫、邹萍);山西医科大学第二医院(杨林花);苏州大学附属第一医院(吴德沛、陈苏宁);上海交通大学附属上海市第一医院(王椿);广东省人民医院(杜欣);中山大学附属第一医院(李娟);华中科技大学同济医学院附属同济医院(周剑峰);河北医科大学第二医院(罗建民);河南省肿瘤医院(宋永平);中南大学湘雅二医院(张广森);解放军总医院(于力、刘代红);北京大学第一医院(任汉云);中国医科大学附属第一医院(李艳);贵州医科大学附属医院(王季石);兰州大学第二医院(张连生);第四军医大学附属唐都医院(梁英民);第四军医大学附属西京医院(陈协群);福建医科大学附属协和医院(胡建达);南昌大学第一附属医院(陈国安);上海交通大学医学院附属仁济医院(陈芳源);南京医科大学第一附属医院(李建勇);安徽省立医院(孙自敏);山东大学齐鲁医院(纪春岩);山东省立医院(王欣);南方医科大学南方医院(刘启发);广西医科大学附属第一医院(赖永榕)