中国抗癌协会
立即下载AppBCR-ABL酪氨酸激酶区突变检测实验室规范中国专家共识(2015年版)
慢性髓性白血病(CML)及部分急性淋巴细胞白血病(ALL)具有标志性的细胞遗传学异常––t(9;22)(q34;q11)形成的Ph染色体,分子水平形成BCR-ABL融合基因,导致ABL酪氨酸激酶处于持续活化状态。伊马替尼等ABL酪氨酸激酶抑制剂(TKI)已成为CML一线治疗及Ph+ ALL治疗方案的重要组成,大部分患者能够获得满意疗效,但是仍有部分患者发生原发或继发耐药,BCR-ABL酪氨酸激酶区突变是耐药的主要机制。直接测序法是当前临床工作中ABL突变检测的常规方法,其结果是指导临床治疗的主要指标。为了实现实验室检测标准化,保证结果准确可靠,现根据BCR-ABL酪氨酸激酶区突变室间比对过程暴露的问题制定检测规范。各实验步骤分述如下。
根据白细胞计数采集相应的标本量,以保证足量的有核细胞数,建议白细胞计数正常的患者,抽取4 ml骨髓或8 ml外周血标本。采用EDTA-Na2或枸橼酸钠抗凝标本。标本应尽量没有凝块,标本抽取后冷藏储存和运送,24 h内进入处理步骤。
建议采用裂解红细胞的方法获得有核细胞,RNA提取可以采用经典的TRIzol法或过柱法。逆转录过程建议采用高效逆转录酶及随机六聚体引物或商品化的逆转录试剂盒。
高质量的cDNA样本是突变检测扩增的高成功率及突变结果的可重复性和准确性的保证,建议用于突变检测的样本ABL拷贝数>10 000。此外,BCR-ABL融合基因检测阳性是实施ABL突变检测的前提。因此,每份检测突变的样本应首先检测BCR-ABL和ABL的拷贝数,以判断标本质量以及是否能够检测突变。
建议采用巢式PCR扩增以针对BCR-ABL检测突变并提高扩增测序的成功率。首先扩增BCR-ABL,再扩增BCR-ABL上的ABL。由于P210、P190及P230型BCR-ABL的上游引物不同,因此扩增前需明确患者BCR-ABL类型。PCR产物应覆盖目前已报道的有临床意义的突变,建议能够准确检测ABL上第230~490号氨基酸密码子。选用高保真及高扩增能力的DNA聚合酶。优化扩增条件使PCR特异产物多而非特异产物尽可能少。PCR产物建议采用切胶纯化法去除非特异条带。采用上下游引物分别进行双向测序。测序图谱应完整且背景干净,无明显的染料峰,整个测序区域中测序峰强度始终不变。
3.结果分析:
采用测序软件(如Mutation Surveyor)或者相关网站上(如http://blast.ncbi.nlm. nih.gov/Blast)与参比序列比对的方法确定读取的序列中突变点的存在及位置。
仔细观察整个测序图谱各个位点的测序峰以防止漏掉低比例突变的突变点,正反向测序图谱相结合以减少漏检和提高准确性。对于少见或未见报道的突变类型要谨慎,应当通过再次扩增测序来验证,以排除扩增或测序过程中因操作不当引起的错误。如果突变峰很小难以判定时建议重复扩增检测。对于某个氨基酸位点发生一个以上碱基位点突变时可以根据目前已广泛报道的突变类型辅助判断,为得出明确结果需要进行克隆测序。
注意特殊突变类型表现,如L248V型点突变,往往同时与缺失81个碱基的Δ(D248-274)突变体同时存在,由第248号氨基酸密码子中C突变为G后形成剪切位点造成,结果导致测序图谱从突变点开始表现为双峰,可以通过特征性的突变图谱判断(图1)或克隆测序确定。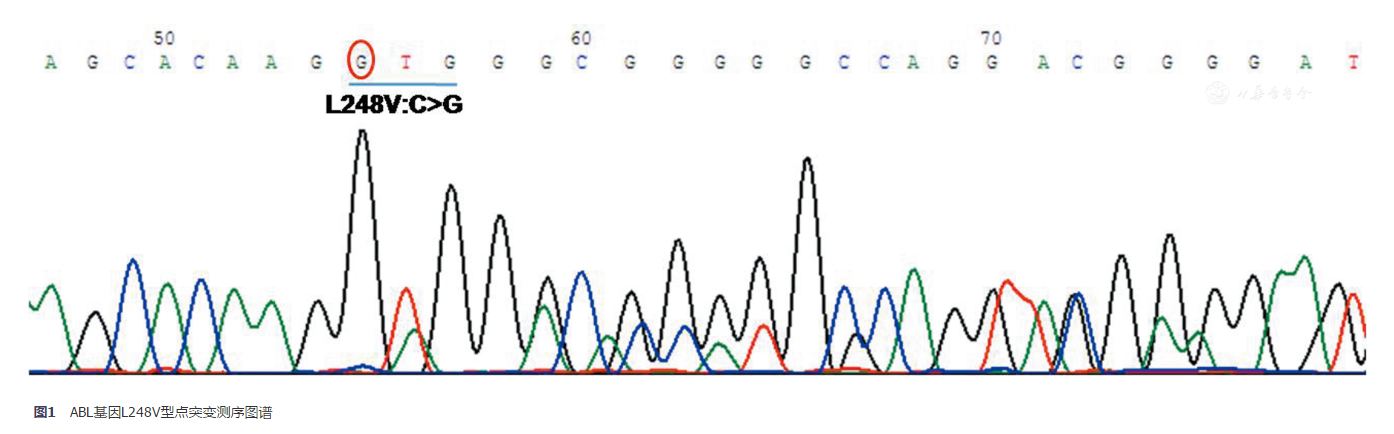
图1 ABL基因L248V型点突变测序图谱
关于缺失突变。BCR-ABL突变检测时常出现整个外显子7的缺失(图2),导致测序图谱从中段开始为双峰表现,目前这种类型的缺失突变临床意义不明,建议不报告。此外,双峰影响微小突变的判断,建议从扩增步骤开始重新操作并测序,若重复后双峰情况依然存在,建议患者重新抽取标本检测,也可以通过克隆测序解决。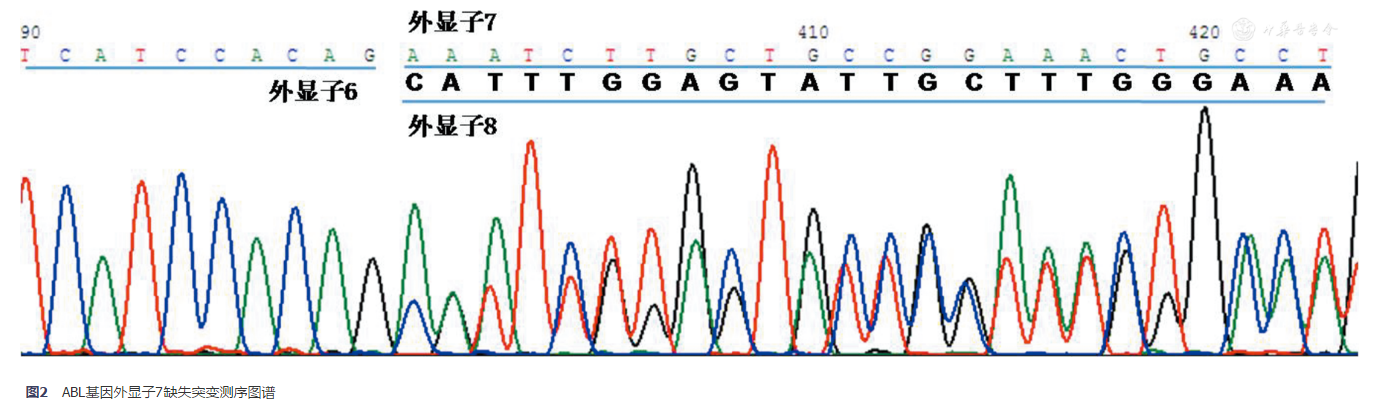
图2 ABL基因外显子7缺失突变测序图谱
1个白血病克隆同时具有2种或2种以上突变类型称作复合突变,发生复合突变已证实具有临床意义。因此,如果样本同时检测到2种或2种以上突变,建议进行克隆测序来确定是否是复合突变。
检测报告中除了患者基本信息外,需包括①检测方法;②是否检测到突变,是否为复合突变(如检测到2种或2种以上突变,并经克隆测序确认);③突变的氨基酸位点、氨基酸类型及碱基;④突变比例。突变比例具有一定的临床意义,因此最好包括到报告中,但是由于测序峰比例不完全代表样本中真实的突变比例,因此建议只报告大概的突变比例(如,大部分、小量、约80%等),无需精确的数值展示。对于因标本质量差或BCR-ABL mRNA水平低导致扩增及测序失败时,应如实报告而不能报告未检测到突变。对于因突变比例低重复检测仍然难以判定的突变,如果是常见的或与耐药高度相关的突变类型,建议报告结果,以尽早提示临床医师,不过要在结果中标注"可疑""建议复查"等,如果是少见或未见报道的突变类型报告要谨慎。
BCR-ABL激酶区突变的检测结果作为CML及Ph+ ALL制定治疗方案的必要依据之一,准确性十分重要,建议实验室按照以上推荐进行检测。突变检测敏感性是一个重要问题,如果能够在低水平突变时检测到突变,临床医师可以尽早采取相应的治疗措施,然而直接测序法的敏感度只有10%~20%,无法充分满足当前临床要求。新一代的突变检测技术(如二代测序、质谱技术等)的成熟及临床应用,将显著提高突变检测的敏感度及复合突变的检测能力,从而进一步提升CML及Ph+ ALL治疗水平。
附:半巢式PCR引物及条件,引自Branford S, Hughes T. Methods Mol Med, 2006, 125:69-92并略作修改,供参考。
引物序列如表1所示。第一轮扩增所用引物:P210型BCR-ABL:SMBF1/SMAR;P190型BCR-ABL:SMBF2/SMAR。反应条件为95 ℃ 5 min;95 ℃ 40 s, 61 ℃ 1 min,72 ℃ 2 min, 30个循环;72 ℃ 7 min。PCR产物大小:P210型(b2a2/b3a2):1 504/1 579 bp; P190型(e1a2):1 641 bp。第二轮扩增所用引物均为SMAF/SMAR,反应条件为95 ℃ 5 min; 95 ℃ 40 s, 62 ℃ 1 min, 72 ℃ 1.5 min, 30个循环;72 ℃ 7 min,PCR产物为863 bp,相应于ABL蛋白的第220~ 506个氨基酸。
(执笔:秦亚溱)
参与本共识讨论专家(排名不分前后):北京大学人民医院(黄晓军、江倩、秦亚溱);中国医学科学院血液学研究所、血液病医院(王建祥、刘兵城);江苏省人民医院(李建勇、钱思轩、乔纯);苏州大学附属第一医院(吴德沛、陈苏宁、沈宏杰、岑建农);浙江大学附属第一医院(金洁、王冬梅、娄引军);广东省人民医院(杜欣、耿素霞)