中国抗癌协会
立即下载App【第九期】李剑-轻链型淀粉样变的诊治
疫情期间,为了给临床医生精准触达优质医疗资源,提升临床工作者规范化诊疗经验,由中国抗癌协会(CACA)血液肿瘤专业委员会、中国医学科学院血液病医院发起,CCMTV临床频道全程线上支持的“血液科专家在线教育讲座”栏目已经启动。本期讲座由北京协和医院李剑教授带来【轻链型(AL)淀粉样变】的讲题,已经于 2020年3月27日上线,以下是针对此次精彩内容的回顾。
AL淀粉样变:2nd需治疗的浆细胞病
虽然轻链型淀粉样变被认为是一种罕见病,但并不是那么少见的。在需要治疗的浆细胞病中,除多发性骨髓瘤,排名第二的即为轻链型淀粉样变。美国的流调数据显示,AL淀粉样变整体患病率在8~14/百万人,每年美国新发病例数3000例左右,患病人数约在12000例。中国人口在美国的四倍左右,因此中国每年新发AL淀粉样变人数可能会在1万例以上。此外,AL淀粉样变患者约占所有M蛋白阳性人群的3%,提示如果在5个骨髓瘤患者中如果没有出现1个淀粉样变的话,轻链型淀粉样变就可能被误诊或漏诊了,因此在临床上应加强对疾病的认识。本院单中心数据显示,5年内初治的轻链型淀粉样变人数明显增加。
AL淀粉样变的早期诊断
AL淀粉样变的漏诊/误诊常见
美国的数据显示,AL淀粉样变整体的中位发病到诊断的时间为2年,1年内确诊率仅37%,有1/3的患者在诊断前至少看过5名专科医生。本中心数据也可看出,10年前我国整体中位诊断时间约在1年半~2年。近几年由于肾内科大夫认识加强及肾穿的普及,AL淀粉样变发病到诊断的时间逐渐缩短,漏诊、误诊的情况得到了改善。
早期诊断对AL淀粉样变至关重要。我国淀粉样变患者中位生存期在59个月左右,但早期诊断的患者整体预后非常好,绝大多数患者OS可达10年以上,但晚期如出现心肌受累的淀粉样变患者中位生存期仅6个月。因此早期诊断非常重要。
AL淀粉样变的器官受累
AL淀粉样变的早期诊断取决于MDT合作、熟知疾病的特征性表现、M蛋白的筛查和重视MGUS到AL的进展路径。AL淀粉样变的多学科合作团队应包括血液科、心内科、病理科、放射科、检验科等,尽早从各个角度得到更快的诊断。AL淀粉样变的器官受累比较多样化,包括心脏、肾脏、肝脏、周围神经、消化道等,绝大部分患者会有两个或两个以上器官受累。
- 肾脏受累的表现主要为水肿、蛋白尿、肾病综合征,很少出现血尿。早期淀粉样变通常不会出现肾功能不全,若出现肾功能不全意味着疾病相对比较晚期。确诊需要依赖肾穿的病理。M蛋白合并肾病为一大组病,即肾脏意义的单克隆免疫球蛋白血症(MGRS),其中淀粉样变为绝大部分,占据约80~90%,需要与轻链沉积病,Fanconi M蛋白、冷球蛋白、免疫触须状肾病、POEMS、C3肾炎、M蛋白沉积相关的增生型肾炎等鉴别。诊断高度依赖于肾脏病理,光镜、免疫荧光、电镜、免疫电镜等多维度检测可以显著提高疾病的诊断率。
- 心脏受累最典型的临床表现为舒张性心衰,患者出现气短、水肿、浆膜腔积液。体位性低血压等。心电图会出现肢导低电压及“假心梗”病理性Q波/QS波,同时心脏超声中可看出心室/心房肥厚,EF一般不低,心肌内回声不均匀,可见“牛眼征”。目前相对更特异性或更敏感的指标为心肌增强MRI,特别是延迟强化LGE、T1-Mapping、ECV等。心内膜下环形强化是淀粉样变最经典最常用的影像学特征,诊断敏感性85%,特异性99%。其余指标也可以和放射科合作进行新的探索。
- 肝脏受累主要表现为肝大,肝脏缓慢增大,质地很硬,平脐不少,脾大较为罕见。通常表现为胆管酶ALP或/和GGT高,转氨酶正常,一般无黄疸,白蛋白不低。这类患者常被误诊为原发胆汁性肝硬化或胆管炎,如果提示淀粉样变的话可行肾穿确诊。
- 典型神经表现为周围神经病变,常为对称性、远端起病,逐渐进展,上下肢均可受累但下肢更常见。一般以感觉异常起病,逐渐发展为运动异常,易被误诊为慢性格林巴利CIDP或POEMS综合征。高水平血清游离轻链异常有提示意义,诊断依赖于神经活检病理。M蛋白合并周围神经病变需要与多种疾病鉴别,如IgM相关的周围神经病变、冷球蛋白继发神经病变、WM侵犯周围神经、POEMS综合征、MGUS合并其他没有关系的周围神经病变如CIDP等,需要结合临床、实验室、病理学、冷球检测等进行鉴别诊断。
- 其他表现可能包括黏膜出血,颈部、前胸部、眶周疏松组织出血;获得性X因子缺乏,PT和APTT特别是APTT延长,X因子不到10%;还有舌体大等。
因此出现不明原因的蛋白尿、舒张性心力衰竭、肝大/碱性磷酸酶增高、周围神经病/体位性低血压、舌大、皮下黏膜出血等,需要考虑到淀粉样变的可能性。
AL淀粉样变的诊断/活检部位
刚果红染色是目前诊断的金标准,但同样存在假阳性和假阴性的问题,一定要结合临床表现,否则可能出现误诊或过度诊断。
关于活检部位的选择,国外文献常报道腹壁脂肪和骨髓的活检,但国内骨髓活检阳性率仅为7%,腹壁脂肪仅为17%,而实体脏器如肾脏、心脏及肺的阳性率均较高,因此建议在没有相关禁忌的情况下尽量选择受累器官活检,如果患者病情不允许,腹壁脂肪或舌体为阳性率较高的选择。我们不推荐直肠活检,因其阳性率较低,患者也较为不适。若患者病情相对较重需要尽快得到结果,应选择受累脏器活检。本院与心内科合作进行经颈内静脉的右心室心内膜心肌活检,目前已完成200余例,仅有1例出现了心包填塞,安全性较好。若患者有严重的低血压不能平卧,则只能通过其它方式确诊。
AL淀粉样变的分型鉴定
淀粉样变是一组疾病,只要具有β折叠的结构即可形成病理学表现,但沉积的蛋白是不同的。国内最常见的为轻链型淀粉样变,常累及心肝肾等器官、第二常见的为AA型,多继发炎症性疾病,出现慢性感染,如儿童期出现自身免疫性炎症性疾病地中海热、反复的高炎症状态。本院血液科最近收治了继发于Castleman病的AA型淀粉样变患者,主要受累器官为肾脏,少数患者可出现心肌受累。此外还有突变型甲状腺转运球蛋白ATTP型淀粉样变,在国外较多,目前有一些反义RNA及促TTR降解的小分子药物进行治疗。未来心内科大夫可能会更关注ATTP型淀粉样变,因其主要累及心脏和周围神经,可以是遗传性或非遗传性的疾病。
因此对于血液科医生,最重要的是识别出AL淀粉样变,因为只有AL淀粉样变通过化疗或移植手段可以进行治疗。如将其他类型淀粉样变误诊为AL淀粉样变进行移植或化疗无法获益。同时不能漏诊AL淀粉样变,这类患者通过化疗可以获益,应尽早治疗。
M蛋白是诊断轻链型淀粉样变的必要条件。仅做血清蛋白电泳阳性率较低,大多数M蛋白<5g/L;仅做血IFE阳性率64%,仅尿IFE阳性率80%,若联合血IFE+尿IFE+血FLC,阳性率可达98%,因此应尽量完善检查。骨髓提供的信息比较有限,绝大部分AL患者BM-PC<5%,基本与正常人群无异。
现在还可以做淀粉样变沉积物的直接鉴定,方法包括高锰酸钾染色、免疫组化、肾脏免疫荧光等。其中肾脏免疫荧光通过肾脏组织的染色可以较好地避免假阳性或假阴性的问题,准确率较高。比较疑难的患者可以采用激光纤维切割/质谱蛋白质组学鉴定。
根据美国的指南所有的患者理论上都应进行轻链鉴定,但在临床实践操作中不现实。由于中国遗传性淀粉样变很少,合并MGUS的其他类型淀粉样变往往FLC正常,因此出现典型临床表现+高水平FLC的患者可以不做鉴定直接按AL淀粉样变治疗。但是不典型临床表现者、无M蛋白者、有家族史者应进行鉴定。
原发性VS继发性AL淀粉样变
区分原发性或继发AL淀粉样变需要寻找有没有MM,WM或其他NHL的证据。约10~15%的MM患者可发生AL淀粉样变,这类患者预后更差。需要注意的是,流式的浆细胞表型不是区分原发与继发淀粉样变的证据,因为其中的浆细胞免疫表型均为类似的CD19-,CD138+,CD38+,CD56-。骨髓的浆细胞遗传学也不是区分依据,因为轻链型淀粉样变中同样会出现许多常见于骨髓瘤的遗传学改变,如t(11;14),13q-,t(4;14),17p-等。骨髓浆细胞超过10%也不是区分依据,有无不能用淀粉样变解释的CRAB才是区分依据,病理学证据是区分其他MHL继发的重要证据。
局灶性VS系统性AL淀粉样变
局灶性淀粉样变的定义为:非重要脏器(心脏/肾脏/肝脏/神经/舌)的单一器官受累的淀粉样变,常以黏膜受累为主,很少累及实质,最常见为呼吸道,其次为泌尿系、皮肤、消化道、眼部等一些其他的器官黏膜受累。局灶性AL淀粉样变预后极好,很少有患者发展为系统性淀粉样变,且多属于继发性疾病,化疗不获益。因此诊断时应排除重要器官受累,同时进行靶器官功能的定期监测,防止进展为系统性AL淀粉样变。
轻链型淀粉样变的诊断流程
若临床出现以上提到的脏器受累,怀疑为淀粉样变,应进行刚果红染色,如刚果红染色阳性,应寻找M蛋白,没有M蛋白考虑为其他疾病类型,M蛋白阳性需要鉴定轻链,注意排除继发性和局灶性的淀粉样变,最终诊断出原发性轻链型淀粉样变的患者。
少见的AL淀粉样变亚型
- IgM型:约占AL淀粉样变的8~10%,患者年龄更大,非心/肝/肾/PN的受累更多见,常见于肺及淋巴结受累。治疗多以靶向B细胞为主,联合利妥昔单抗,整体预后较差。
以压缩性骨折为首发表现的临床亚型:以缓慢的自发性椎体压缩性骨折起病,易被误诊为骨质疏松或MM,具有椎体压缩性骨折、肝脏受累、骨髓受累及均为Kappa型M蛋白四个特征,通过有效的抗浆细胞治疗后预后较好。
诊断总结
我们应熟悉轻链型淀粉样变常见的临床表现及确诊方法,熟悉其他M蛋白相关性疾病的鉴别诊断,准备分型是治疗轻链型淀粉样变的基础,还应注意区分系统性和局灶性淀粉样变,警惕过度治疗或治疗不足。
AL淀粉样变的预后
轻链型淀粉样变的预后在近几年得到显著改善。梅奥的数据显示AL淀粉样变2年生存率已由2000年左右的42%提高到现在的60%,本中心数据也显示AL淀粉样变中位生存期可达近5年,轻链型淀粉样变患者预后不一定比骨髓瘤差。
AL淀粉样变的分期
AL型淀粉样变最重要的预后因素取决于器官的受累程度。Mayo 04分期主要包括cTnT和NT-proBNP两项指标来判断高危患者,后来欧洲人在此基础上又将NT-proBNP≥8500ng/L的患者划分为IIIb期,这些患者预后非常差。2012年该分期系统进行了更新,纳入了游离轻链和肿瘤负荷的指标,根据危险因素数目0~3个分为1~4期,1期患者预后非常好,而4期患者预后相对较差。AL淀粉样变的其他预后较差因素还包括游离轻链水平较高,BM-PC>10%,t(11;14)会对硼替佐米疗效不佳,ECV水平较高,以及基因突变个数多等。未来我们还将开发越来越多的预后因素如治疗后的转归等。
疗效评价标准
与多发性骨髓瘤不同,轻链型淀粉样变疗效评价包括血液学评价和器官评价两部分。血液学评价主要分为CR,VGPR,PR,NR和PD五个层次,CR定义为血尿IFE(-),FLCR正常;VGPR为血dFLC<40mg/L,PR为血dFLC下降超过50%,由此可见游离轻链的水平至关重要。除血液学疗效外,还有器官缓解,心脏主要关注NT-proBNP,肾脏主要关注肌酐,肝脏通过碱性磷酸酶水平和肝脏大小进行疗效判断。
目前总体来看,缓解越好疗效越好。目前治疗目标下VGPR为游离轻链<40ng/L,未来可能下调到<10,因为<10的患者整体预后更好。我们现在的目标仍为追求最好最深(≥VGPR)的血液学缓解,一般不太追求器官缓解,因为器官缓解较为滞后,以此为目标可能造成过度治疗。
AL淀粉样变的疗效仍存在一些挑战。血液学缓解是器官缓解的基础,但有时血液学缓解并不能有效转化为器官缓解,未来可能仍需要针对器官缓解的药物获得更好的疗效。
AL淀粉样变的治疗
AL淀粉样变治疗的进展
从上世纪60年代的秋水仙碱到马法兰,到90年代的自体移植,2000年左右的沙利度胺,到现在更多的新药如硼替佐米、来那度胺、伊莎佐米、泊马度胺以及最新的Dara单抗等,淀粉样变的治疗突飞猛进,治疗模式也发生转变。现在移植患者越来越少,自体移植前也会先进行硼替佐米诱导治疗,降低肿瘤负荷。非移植组的患者硼替佐米应用越来越多,梅奥诊所数据与本中心数据均表现出这一趋势。
总体治疗策略的改变
低危患者有条件可以做自体移植,但不愿意做自体移植的患者,通过硼替佐米也可以获得非常好的血液学缓解。在高危患者中尽早使用硼替佐米,中危患者差别不大。
- 自体移植是低危患者的一线治疗,能够获得很好的长期缓解率和长期生存率。但自体移植存在风险,移植早期死亡率可高达30%,或有不同程度的并发症发生。因此现阶段自体移植的进行越来越少,会严格筛选年轻、无器官衰竭的低危患者进行自体移植。本中心自体移植治疗AL的研究统计了60余位年轻低危的患者,总体血液学缓解率达82%,中位PFS为近6年,疗效较好。但目前自体移植费用较高,性价比较低,各中心需要根据自身条件选择是否进行自体移植。
- 对于经济困难的中低危患者,马法兰是比较好的选择。本中心77例使用MD方案的患者ORR 60%,3年PFS 51%,总体疗效也是肯定的。
- 目前大部分患者使用硼替佐米治疗,在182名使用BD/BCD方案治疗的患者中,92%选择BCD方案,绝大部分患者有心脏受累,ORR 80%,VGPR+疗效达到69%,中位PFS 28个月,中位OS未达到,这个疗效非常好。
- 极高危患者是否积极治疗是一个值得思考的问题,本中心使用硼替佐米治疗极高危的患者,采用BCD/BD方案治疗的患者6个月内死亡率为32%,比姑息治疗的患者下降了一半。这部分患者经过化疗后长期生存得到了改善,中位生存期达到30个月,因此这类患者在条件允许的情况下应该进行治疗。
- 现在还有很多新药如泊马度胺,伊莎佐米和Dara单抗。美国对25例使用Dara/Dex治疗难治/复发性AL的患者进行了回顾性研究,76%的患者可以获得血液学缓解,60%的患者获得VGPR+疗效,11例难治性AL中也有8例达到了VGPR+,疗效非常不错。
现在还有靶向于沉积蛋白的新药,如NEOD 001、抗SAP抗体、11-1F4单抗及多西环素等。国外有一些随机对照试验及回顾性研究认为多西环素效果较好,但我们进行的140余例患者的多中心研究中期分析疗效可能不佳,还需要最后随访和生存的数据。
总结
AL淀粉样变需要采取分层治疗策略,硼替佐米治疗AL型淀粉样变高度有效安全,可以明显改善极高危患者的预后,新药特别是CD38单抗联合硼替佐米可进一步提高疗效。
Case-1
M/67,双下肢麻木疼痛半年,进行性加重,仅1m出现行走困难,EMG+NCV提示为神经源性损害,血IgG-,lambda+,疑诊为POEMS综合征来诊。

本例中判断POEMS病需要格外关注神经外表现和FLC水平。POEMS病神经外表现包括水肿及皮肤、性腺、内分泌及各个器官表现,FLC水平通常正常,即使异常水平也较低,异常率不足15%。该患者后续检查结果如下:

对单纯周围神经受累,高水平FLC的患者我们高度怀疑轻链型淀粉样变,因此进行了腓肠神经活检,最后确诊为AL型淀粉样变,经BCD治疗取得了很好的疗效。
Case 2
M/53,活动后气短6m,外院echo/MRI均提示淀粉样变,心肌活检淀粉样变+,心功能2级,NT-proBNP 2489,就诊于我院门诊。

在我院门诊查血尿IFE均阴性;FLC-κ19.1,FLC-λ18.2,同时发现有一个哥哥,心肌病多年,近期也被疑诊为淀粉样变。
对于这类没有M蛋白且有可疑家族史的患者,应怀疑为遗传性淀粉样变,进行TTR基因突变检测发现这位患者为mTTR型淀粉样变,有TTR Ser43Asn突变。影响心肌的淀粉样变除AL型还有TTR型、重链型、AA型、ApoA-I型,需注意与轻链鉴别。
Case 3
M/57,2016-7因活动后气短行心肌活检确诊为淀粉样变,治疗前NYHA-2级,Mayo 04 2期,dFLC 274mg/L,IVS 17mm,EF 42% 。
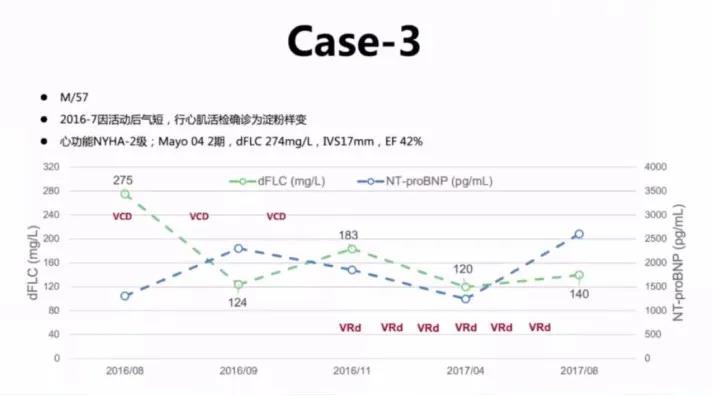
16年该患者首先进行了VCD治疗,但经3个疗程的VCD和6个疗程的VRD治疗之后未达预期疗效。17年该患者进行了Dara-Rd方案,主要不良反应为1级输液反应。使用Dara后游离轻链水平显著下降,长期维持在10以下水平,同时NT-proBNP已由原来的2000多降至几百的水平,取得了非常好的血液学及器官疗效。
问题一
M蛋白阳性,有大量血红蛋白尿,血清游离轻链阴性,BM-PC<5%的患者能否诊断为淀粉样变?
李剑教授:该患者需进行肾穿确诊,可能是M蛋白合并的慢性肾炎,其他原因的慢性肾炎或淀粉样变。在淀粉样变中也有些患者游离轻链水平是正常的。
问题二
压缩性骨折起病的淀粉样变和MM应如何鉴别?
李剑教授:MM的ALP水平通常不会升高,但压缩性骨折起病的淀粉样变常有肝脏受累,ALP水平非常高,因此ALP水平有助于评估这两种疾病
问题三
轻链型淀粉样变必须要有骨髓克隆性浆细胞吗?
李剑教授:不是必须的。骨髓克隆性浆细胞还可能取决于检测手段。轻链型淀粉样变一定要有M蛋白,但不一定要在骨髓中找到克隆性浆细胞,这是两个不同层面检测的问题。若患者骨髓中没有发现克隆性浆细胞,但血尿中有M蛋白或游离轻链水平高,也符合诊断要求。
问题四
直肠活检还是心肌活检更合适?
李剑教授:直肠活检不太合适,应该被淘汰,不如做腹壁/齿龈/舌体的活检。若都没有阳性且患者表现明确的心肌受累,心肌活检比较合适,因为阳性率高且出结果快,能够尽早开始治疗。
问题五
BCD诱导后要不要做维持治疗?
李剑教授:目前淀粉样变的维持治疗尚不明确。我们目前没有做维持治疗,通常使用BCD 8~9个周期,达到CR或VGPR后停药观察随诊,若患者病情变化再做进一步治疗。但现在也有人认为像VGPR这样游离轻链水平下降不够好的患者,从维持治疗中可能会获益,但目前还没有很多的循证医学证据。