中国抗癌协会
立即下载AppAML靶向治疗你需要知道的(一)
什么是靶向治疗/靶向药物?一般的化疗药物是作用于全身的,在对肿瘤细胞造成损伤的同时,也对正常的细胞有杀伤作用,所以会有强烈的副作用。靶向药物可以识别某一种肿瘤靶点,这种靶点可以是一个蛋白分子或基因片段。药物进入人体后可以特异性选择肿瘤的靶点进行结合,杀灭肿瘤细胞,而不损伤不具备该靶点或该靶点较少的正常细胞。所以毒副作用要小于常规化疗,作用也更好1。

靶向药物种类很多,这是因为肿瘤细胞异常或突变的种类也有很多2,针对不同的异常或突变所设计靶向药物各不相同。每个AML患者可以根据自己的基因检测结果来寻找适合自己的靶向药物。下面我们一起来看看目前的靶向药物有哪些。
针对FLT3突变:FLT3蛋白是一种受体酪氨酸激酶,在正常造血祖细胞中表达。FLT3突变是最常见的基因组异常,约占成人AML的30%,并且和预后不良有关。常见两种突变形式,FLT3-ITD和FLT3-TKD。在3期临床试验中证明可作为挽救性单药疗法或与常规化疗联合使用的FLT3抑制剂有米哚妥林 (midostaurin),吉瑞替尼 ( gilteritinib),奎扎替尼 ( quizartinib)3。具体的报道以及中位生存期请看下表。FLT3抑制剂在复发/难治性(R/R)AML患者中显示出大约50%的CR率并可延长生存期。
表1:FLT3抑制剂的临床3期试验。
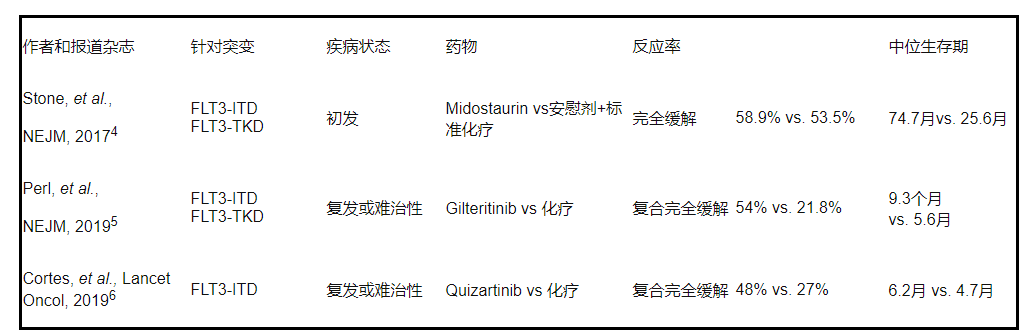
注:复合完全缓解:包括完全缓解,血细胞计数未恢复的完全缓解,及血细胞计数部分恢复的完全缓解
针对IDH1/IDH2的突变:异柠檬酸脱氢酶(IDH)1和IDH2蛋白参与线粒体三羧酸循环。突变的IDH1和IDH2表现异常的酶活性,可将α-酮戊二酸(α-KG)转化为癌代谢物2-羟基戊二酸(2-HG),使表观遗传改变,进而阻止造血分化。IDH1和IDH2基因突变存在于大约20%的AML以及12%的骨髓增生异常综合征(MDS)中。在一项临床1期研究中,特异性IDH1抑制剂艾伏尼布(ivosidenib)治疗伴IDH1突变的复发或难治性AML患者的完全缓解率为21.6%。艾伏尼布单独使用时,总体反应率为42.4%。还有研究表明,在不适用传统疗法且伴IDH1突变的初发AML患者中,艾伏尼布与阿扎胞苷联合使用可达60.9%的完全缓解率。此外,艾伏尼布联合阿扎胞苷治疗初发AML/MDS的3期AGILE研究目前正在进行中。同样,IDH2抑制剂恩西地平()治疗伴IDH2突变的复发或难治性AML患者的总体反应率为40.3%,中位反应持续时间为5.8个月。
表2:评估IDH抑制剂联合或不联合细胞毒药物的临床研究。
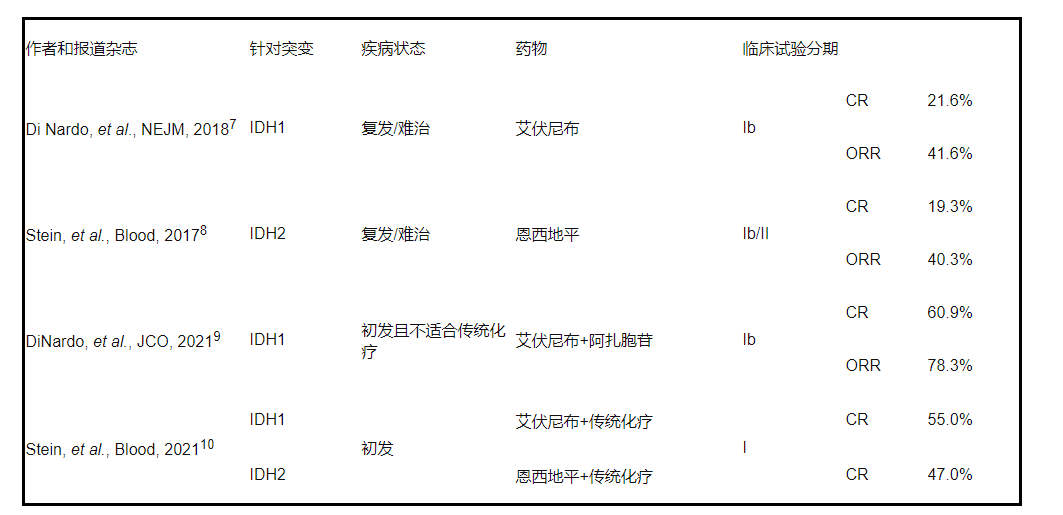
注:CR:完全缓解;ORR:客观缓解率,指完全缓解率+部分缓解率之和
针对BCL2的突变:BCL-2家族通过控制线粒体外膜透化(MOMP)和细胞色素c的释放来调节线粒体凋亡途径。BCL-2抑制剂与BCL-2蛋白竞争性结合以释放BH3-only蛋白并抑制BAX/BAK,最终启动肿瘤细胞的凋亡级联反应。简单理解就是BCL2抑制剂可以促进肿瘤细胞凋亡。2020年,一项3期、多中心、随机、双盲、安慰剂对照试验评估了阿扎胞苷加venetoclax(维奈托克)与阿扎胞苷加安慰剂相比的的疗效和安全性11。在中位随访 20.5 个月时,阿扎胞苷-维奈托克组的中位总生存期为 14.7 个月,对照组为 9.6 个月。阿扎胞苷-维奈托克组完全缓解的发生率高于对照方案(36.7% vs. 17.9%;P<0.001)
篇幅有限,本文先介绍到这里,我们会在下篇继续介绍现在已有或正在进行的靶向治疗研究。
参考文献:
1. Greiner J, Götz M, Wais V. Increasing Role of Targeted Immunotherapies in the Treatment of AML. International Journal of Molecular Sciences 2022; 23(6): 3304.
2. Andreozzi F, Massaro F, Wittnebel S, Spilleboudt C, Lewalle P, Salaroli A. New Perspectives in Treating Acute Myeloid Leukemia: Driving towards a Patient-Tailored Strategy. International Journal of Molecular Sciences 2022; 23(7): 3887.
3. Chi S-G, Minami Y. Emerging Targeted Therapy for Specific Genomic Abnormalities in Acute Myeloid Leukemia. International Journal of Molecular Sciences 2022; 23(4): 2362.
4. Stone RM, Mandrekar SJ, Sanford BL, et al. Midostaurin plus Chemotherapy for Acute Myeloid Leukemia with a FLT3 Mutation. N Engl J Med 2017; 377(5): 454-64.
5. Perl AE, Martinelli G, Cortes JE, et al. Gilteritinib or Chemotherapy for Relapsed or Refractory FLT3-Mutated AML. N Engl J Med 2019; 381(18): 1728-40.
6. Cortes JE, Khaled S, Martinelli G, et al. Quizartinib versus salvage chemotherapy in relapsed or refractory FLT3-ITD acute myeloid leukaemia (QuANTUM-R): a multicentre, randomised, controlled, open-label, phase 3 trial. Lancet Oncol 2019; 20(7): 984-97.
7. DiNardo CD, Stein EM, de Botton S, et al. Durable Remissions with Ivosidenib in IDH1-Mutated Relapsed or Refractory AML. N Engl J Med 2018; 378(25): 2386-98.
8. Stein EM, DiNardo CD, Pollyea DA, et al. Enasidenib in mutant IDH2 relapsed or refractory acute myeloid leukemia. Blood 2017; 130(6): 722-31.
9. DiNardo CD, Stein AS, Stein EM, et al. Mutant Isocitrate Dehydrogenase 1 Inhibitor Ivosidenib in Combination With Azacitidine for Newly Diagnosed Acute Myeloid Leukemia. J Clin Oncol 2021; 39(1): 57-65.
10. Stein EM, DiNardo CD, Fathi AT, et al. Ivosidenib or enasidenib combined with intensive chemotherapy in patients with newly diagnosed AML: a phase 1 study. Blood 2021; 137(13): 1792-803.
11. DiNardo CD, Jonas BA, Pullarkat V, et al. Azacitidine and Venetoclax in Previously Untreated Acute Myeloid Leukemia. N Engl J Med 2020; 383(7): 617-29.